高三化学第一学期十月考试试题
高 三 化 学 试 卷
制卷:李振兵
全卷满分150分,考试时间120分钟。
第一卷(选择题 共64分)
可能用到的相对原子质量:H 1 C 12 N 14 O 16 S 32 Cl 35.5 K39 Fe 56
一、单项选择题(本题包括8小题,每小题4分,共32分。每小题只是一个选项符合题意)
1.下列物质按照纯净物、混合物、电解质和非电解质顺序排列的是
A.盐酸、水煤气、醋酸、干冰 B.冰醋酸、福尔马林、硫酸钠、乙醇
C.胆矾、漂白粉、氯化钾、氯气 D.王水、混甘油酯、苛性钾、石灰石
2.近年来,科学家试图探索利用铝粉作为新能源的可能性。假如铝作为一种普遍使用的新型能源被开发利用,下列关于其有利因素的说法中,肯定不成立的是
A.铝矿资源比较丰富
B.铝燃烧时热值高
C.铝质轻,有利于运输和贮存
D.用电解法冶炼铝的工业技术是铝作为新能源的重要基础
3.在试管中注入某红色溶液,给试管微热,溶液颜色逐渐变浅,则原溶液可能是
①滴有石蕊的NH4Cl溶液; ②滴有酚酞的饱和氢氧化钙溶液;
③滴有酚酞的Na2CO3溶液; ④溶有SO2的品红溶液
A.② B.④ C.②④ D.②③
4.将甲和乙气体同时通入过量的丙溶液中,能产生沉淀的组合是
| 序号 | 甲 | 乙 | 丙 |
| ① | CO2 | SO2 | Ca(OH)2 |
| ② | HCl | CO2 | Ca(OH)2 |
| ③ | CO2 | SO2 | Ba(NO3)2 |
| ④ | NO2 | SO2 | BaCl2 |
| ⑤ | CO2 | NH3 | CaCl2 |
| ⑥ | SO2 | H2S | NaOH |
A.①③④⑤ B.③④⑤⑥ C.①②③④⑤ D.全部
5.类推的思维方法在化学学习和研究中有时会产生错误的结论,因此类推出的结论最终要经过实践的检验才能决定其正确与否。下列几种类推结论中正确的是
A.第二周期元素氢化物稳定性顺序是HF>H2O>NH3;则第三周期元素氢化物稳定性顺序也是HCl>H2S>PH3
B.Fe3O4可写成FeO·Fe2O3;Pb3O4也可写成PbO·pb2O3
C.可电解熔融MgCl2来制取金属镁;也能电解熔融AlCl3来制取金属铝
D.晶体中有阴离子,必有阳离子;则晶体中有阳离子,也必有阴离子
6.已知胆矾溶于水时溶液温度降低。胆矾分解的热化学方程式为
CuSO4·5H2O(s)![]() CuSO4(s)+5H2O(l);ΔH=
+Q1 kJ/mol
CuSO4(s)+5H2O(l);ΔH=
+Q1 kJ/mol
室温下,若将1mol无水硫酸铜溶解为溶液时放热Q2 kJ,则Q1与Q2的关系为
A.Q1<Q2 B.Q1=Q2 C.Q1>Q2 D.无法比较
7.有下列五种判断:
①两种弱酸相互反应生成了两种强酸;
②一种弱酸和一种盐溶液作用后,得到一种强酸和一种盐;
③发生复分解反应,但产物既没有水生成,也没有沉淀和气体生成;
④两种酸溶液充分反应后,所得溶液的酸性减弱,甚至呈中性;
⑤有单质参加或生成的反应,但该反应不是氧化还原反应。
其中有具体例证的是
A. ①②③④ B. ①③④⑤ C. ①②③⑤ D. ①②③④⑤
8.a g密度为d1 g/cm3质量分数为ω1的硝酸钾溶液,采取某种措施变成bg密度为d2g/cm3质量分数为ω2的硝酸钾饱和溶液(无硝酸钾析出),下列表达一定正确的是
A.a>b B.bω2 ≥aω1 C.d1 >d2 D. a d1ω1= b d2ω2
二、不定项选择题(本题包括8小题,每小题4分,共32分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个该小题就为0分)
9.常温下,某溶液中含有大量Fe2+、Fe3+、Mg2+和NH4+,其中c(H+)=10-2 mol·L-1,在该溶液中可以大量存在的阴离子是
A.SO42- B.NO3- C.SCN- D.ClO-
10.NA代表阿伏加德罗常数,下列说法正确的是
A.12g金刚石中含有碳碳键的个数为2NA
B.常温常压下,92gNO2和N2O4混合气体中含有的原子数为6NA
C.32g皇冠硫(S 8)与足量的Cu反应时转移NA个电子
D.标准状况下,11.2L氯仿中含有的C-Cl键的数目为1.5NA
11.在20世纪90年代末期,科学家发现并证明碳有新的单质形态C60存在。后来人们又相
继得到了C70、C76、C84、C90、C94等另外一些球碳分子。21世纪初,科学家又发现了管状碳分子和洋葱状碳分子,大大丰富了碳元素单质的家族。下列有关说法错误的是
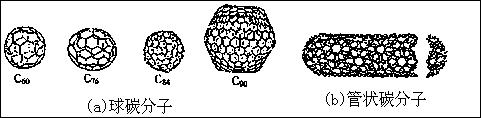
A.熔点比较:C60<C70<C90<金刚石<石墨
B.已知C(石墨,s)![]() C(金刚石,s);△H>0,则石墨比金刚石稳定
C(金刚石,s);△H>0,则石墨比金刚石稳定
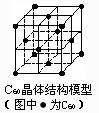 C.C60晶体(其结构模型如右图)中每个C60分子周围与它距离最
C.C60晶体(其结构模型如右图)中每个C60分子周围与它距离最
近且等距离的C60分子有12个
D.金刚石为非分子形式的粒子存在,属原子晶体;C60、C70、管
状碳和洋葱状碳以分子形式的粒子存在,属分子晶体。两类
不是同素异形体
12.有三种短周期元素,最外层电子数之和为17,质子数之和为31。如果这三种元素中有一种是氩元素,则关于另外两种元素的说法正确的是
A.如果一种元素是金属元素,则另一种元素一定是稀有气体元素
B.如果一种元素的单质通常情况下是气体,则另一种元素的单质通常情况下是固体
C.如果一种元素的气态氢化物是三角锥形分子,则另一种元素的气态氢化物一定是正四面体形分子
D.如果一种元素的最高正价是+3,则另一种元素的单质有两种常见的同素异形体
13.下列离子方程式书写正确的是
A.醋酸洗涤铜器表面的碱式碳酸铜 Cu2(OH)2CO3 +4H+ = 2Cu2+ +CO2↑+3H2O
B.氧化铁溶于氢碘酸 Fe2O3+6H+=2Fe3++3H2O
C.氯酸钾与浓盐酸制取少量氯气 6H+ + ClO3- + 5Cl- = 3Cl2 ↑ +3H2O
D.明矾溶液加入Ba(OH)2溶液至沉淀质量最多
2Al3++3SO![]() +3Ba2++6OH
+3Ba2++6OH![]() =2Al(OH)3↓+ 3 BaSO4↓
=2Al(OH)3↓+ 3 BaSO4↓
14.下列各选项所述的两个量,前者一定大于后者的是
①HF和HBr的沸点,
②H-和H+离子半径,
③同温下分别在100g水中最多能溶解的无水CuSO4和CuSO4·5H2O的质量,
④金刚石晶体和石墨晶体中,每个最小碳环里所含的实际碳原子数,
⑤在NH3+NO→N2+H2O反应中,被氧化和被还原的N原子数,
⑥耐火材料MgO和CaO的熔点,
A.①②⑤⑥ B.①②③⑤ C.①⑤⑥ D.①②⑥
15.2005年诺贝尔化学奖获得者施罗克等人发现金属钼的卡宾化合物可以作为非常有效 的烯烃复分解催化剂。工业上冶炼钼的化学原理为
① 2MoS2+7O2
![]() 2MoO3+4SO2 ②
MoO3+2NH3·H2O==(NH4)2MoO4+H2O
2MoO3+4SO2 ②
MoO3+2NH3·H2O==(NH4)2MoO4+H2O
③ (NH4)2MoO4+2HCl==H2MoO4↓+2NH4Cl ④ H2MoO4==MoO3+H2O
⑤ 用还原剂将MoO3还原成金属钼。
则下列说法中正确的是
A.MoS2煅烧产生的尾气可用于硫酸工业
B.MoO3是金属氧化物,也是碱性氧化物
C.H2MoO4是一种强酸
D.利用H2、CO和铝分别还原等量的MoO3,所消耗还原剂的物质的量之比为3:3:2
16.对于平衡体系mA(g)+nB(g)![]() pC(g)+qD(g);△H<0。下列结论中正确的是
pC(g)+qD(g);△H<0。下列结论中正确的是
A.若升高温度时,平衡混合气体的平均相对分子质量增大,则m+n<p+q
B. 若温度不变,将容器的体积增大1倍,此时A的浓度变为原来的0.48倍,则m+n>p+q
C.若m+n=p+q,则往含有a mol气体的平衡体系中再加入b mol B,达到新平衡时,气体的总物质的量等于(a+b)mol
D.若平衡时A、B的转化率之比为m∶n,说明反应开始时,A、B的物质的量之比一定等于m∶n
第二卷(非选择题 共86分)
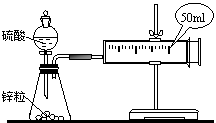 三、(本题包括2小题,共20分)
三、(本题包括2小题,共20分)
17.(10分)两套如图所示装置,各盛有2g锌粒(颗粒大小相同),分别加入40mL1mol/L的硫酸和40mL4mol/L的硫酸,比较二者收集10mLH2时所用的时间。
(1)当收集到10mLH2时,哪个实验所耗时
间较长?为什么? 。
(2)两个实验的现象相同的有 ;不同的有 。
(3)注射器针筒活塞外移的情况是
A、均匀外移 B、先快后慢 C、先慢后快 D、先慢后快然后又逐渐变慢
你选择的理由是 。
(4)当按如图所示装置装配好仪器和加入试剂后,开始实验的第一步操作是 。
18.(10分) 归纳整理是科学学习的重要方法之一。某同学在学习了氧族元素的各种性质后,归纳整理出如下表所示的表格(部分)。
| 性质\元素 | 8O | 16S | 34Se | 52Te |
| 单质熔点(℃) | -218.4 | 113 | 450 | |
| 单质沸点(℃) | -183 | 444.6 | 685 | 1390 |
| 主要化合价 | -2 | -2,+4,+6 | -2,+4,+6 | |
| 原子半径 | 逐渐增大 | |||
| 单质与H2反应情况 | 点燃时易化合 | 加热化合 | 加热难化合 | 不能直接化合 |
请你参与并协助他完成相关学习任务:
 ⑴硒的熔点范围可能是: 113 ;
⑴硒的熔点范围可能是: 113 ;
⑵写出氧族元素中含有18e-的两种氢化物的电子式 ~450 ~4℃ ;
⑶工业上Al2Te3可用来制备H2Te,完成下列化学方程式并配平:
[ 1 ]A12Te3 + [ 6 ] HO ==[ 2 ]A1(OH)3↓+[ 3 ]H2Te↑
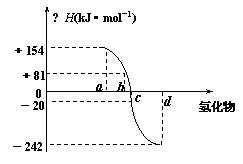
⑷已知:在热力学标准态(298K、1.01×105Pa)下,由稳定的单质发生反应生成1mol化合物的反应热叫该化合物的生成热(△H)。上图为氧族元素氢化物a、b、c、d的生成热数据示意图。请你归纳:非金属元素氢化物的稳定性与氢化物的反应热△H的关系 。
⑸写出硒化氢在热力学标准态下,发生分解反应的热化学方程式 。
四、(本题包括2小题,共18分)
 19.(8分) 元素周期表是20世纪科学技术发展的重要理论依据之一。2006年3月有人预言,未知超重元素第126号元素有可能与氟形成稳定的化合物。按元素周期系的已知规律,该元素应位于第
周期。假设NH4+是“元素”NH4的阳离子,则“元素” NH4在元素周期表中的位置应该是 ;“元素” NH4的单质常温常压下应为
(填“高”或“低”)熔点 (填“固”、“液”或“气”)体,
(填“能”或“不能”)导电;NH4的碳酸盐应 (填“易”或“不易”)溶于水,“元素” NH4与氯元素形成的化合物为 (填“离子化合物”或“共价化合物”)。
19.(8分) 元素周期表是20世纪科学技术发展的重要理论依据之一。2006年3月有人预言,未知超重元素第126号元素有可能与氟形成稳定的化合物。按元素周期系的已知规律,该元素应位于第
周期。假设NH4+是“元素”NH4的阳离子,则“元素” NH4在元素周期表中的位置应该是 ;“元素” NH4的单质常温常压下应为
(填“高”或“低”)熔点 (填“固”、“液”或“气”)体,
(填“能”或“不能”)导电;NH4的碳酸盐应 (填“易”或“不易”)溶于水,“元素” NH4与氯元素形成的化合物为 (填“离子化合物”或“共价化合物”)。
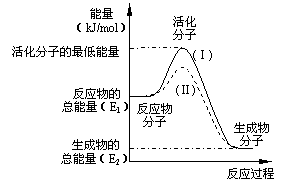
20.(10分) 在化学反应中,只有极少数能量比
平均能量高得多的反应物分子发生
有合适取向的碰撞时才可能发生化学反应,
这些分子被称为活化分子。
使普通分子变成活化分子所需提供的最
低限度的能量叫活化能,其单位通常用kJ·mol-1
表示。请认真观察左图,然后回答问题。
(1)图中所示反应是________(填“吸热”或“放热”)反应,该反应_______(填“需要”或“不需要”)加热,该反应的△H =__________(用含E1、E2的代数式表示)。
(2)已知热化学方程式:H2(g)+![]() O2(g) = H2O(g) ;△H = - 241.8 kJ·mol-1,该反应的活化能为167.2 kJ·mol-1,则其逆反应的活化能为____________________。
O2(g) = H2O(g) ;△H = - 241.8 kJ·mol-1,该反应的活化能为167.2 kJ·mol-1,则其逆反应的活化能为____________________。
(3)对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能大大降低,活化分子百分数增多,反应速率加快,你认为最可能的原因是 。
五、(本题包括1小题,共10分)
21.(10分)科学家预测“氢能”将是未来最理想的新能源。
根据“绿色化学”的思想,为了制备H2,某化学家设计了下列化学反应步骤:
![]()
![]() ①CaBr2+H2O CaO+2HBr ②2HBr+Hg HgBr2+H2
①CaBr2+H2O CaO+2HBr ②2HBr+Hg HgBr2+H2
③HgBr2+CaO HgO+CaBr2 ④2HgO 2Hg+O2↑
你认为该方法的主要缺点是 。
利用核能把水分解,制出氢气,是目前许多国家正在研究的课题。下图是国外正在研究中的一种流程(硫—碘热循环法),其中用了过量的碘。
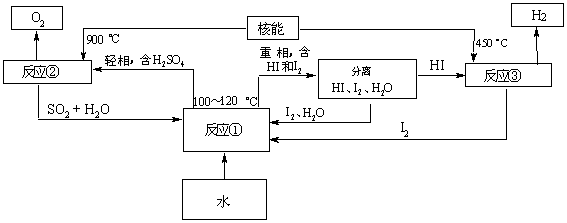 请写出反应①、②、③的化学方程式:反应① 反应② 反应③
请写出反应①、②、③的化学方程式:反应① 反应② 反应③
用硫—碘热循环法制取氢最大的优点是 。
六、(本题包括2小题,共18分)
22.(8分) 对于可逆反应:mA(g)+nB(g) ⇌ pC(g)+qD(g),当在一定温度下达到平衡时,可以得出平衡常数K: ![]() 平衡常数K表示可逆反应的进行程度,K值越大,表示可逆反应进行的程度越大。
平衡常数K表示可逆反应的进行程度,K值越大,表示可逆反应进行的程度越大。
下面A、B、C、D四张图是用计算机制作的在密闭容器、不同条件下进行的反应:
![]() X ⇌ Y;的进程图解。图中的纵坐标表示X和Y的物质的量的分数(物质的量的百分数);横坐标表示时间:分(以分为单位的反应进程)。图中的“ ”是X,“ ”是Y。
X ⇌ Y;的进程图解。图中的纵坐标表示X和Y的物质的量的分数(物质的量的百分数);横坐标表示时间:分(以分为单位的反应进程)。图中的“ ”是X,“ ”是Y。
A 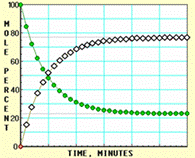 B
B 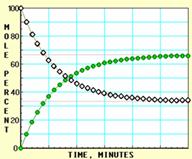
C 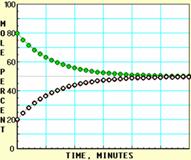 D
D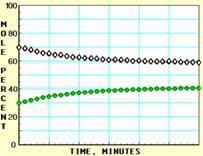
K值大小与温度的关系是:温度升高,K值___ __ ____(填“一定增大”、“一定减小”、或“可能增大也可能减小”)。平衡常数K最小的图是 ;(用A、B、C、D回答,下同)平衡常数K最大的图是 ;平衡常数K=1的图是 。
23.(10分)原子数相同、电子总数也相同的不同粒子,互称为等电子体。等电子体的结构相似、物理性质相近。HN3称为叠氮酸,N3-也被称为类卤离子。
试回答下列问题:
⑴N3-与CO( 或NO)分子互为等电子体,N3-的空间构型是 直 线型
HN3为[N= (填“极性分子”或“非极性分子”)。
⑵酸性:HN3 < __HX (卤化氢) (填“>”或“<”);
热稳定性:HN3_< _HX (填“>”或“<”)。
⑶HN3与硝酸银溶液作用,可得一种不溶于水的白色固体,该固体加热时,会发生爆炸产生两种含不同类型化学键的物质。试写出该白色固体加热爆炸的化学方程式 N__。
⑷叠氮酸钠(NaN3)是抗禽流感药物“达菲”合成过程中的中间活性物质;叠氮酸钠也可用于汽车保护气囊中。3mol NaN3受撞击会生成4mol 氮气和一种离子化合物A。请写出该反应的化学方程式 3NaN aN +4N↑____ 。
七、(本题包括2小题,共20分)
24.(8分)铬位于元素周期表中第四周期第ⅥB族,其主要化合价为+6、+3、+2、O,其中+3价较为稳定。+3价的铬在水溶液中以水合离子的形式存在(如[Cr(H2O)6]3+,但常常简写为Cr3+ ,Cr3+在水溶液中呈蓝紫色。校化学兴趣小组的同学查阅资料,对铬的化合物进行探究性研究并掌握了一些课堂内学不到的知识和技能。
(1)Cr2O3呈绿色,微溶于水,与Al2O3类似,是两性氧化物;Cr(OH)3呈灰蓝色,与Al(OH)3类似,也是两性氢氧化物,在水中存在酸式和碱式电离平衡,则Cr(OH)3电离方程式是:
。
(2)在K2Cr2O7溶液中存在着Cr2O72—与CrO42—,并达到以下平衡:
![]() Cr2O72—+H2O 2 CrO42—+2H+
Cr2O72—+H2O 2 CrO42—+2H+
(橙红色) (黄色)
试填空:向K2Cr2O7溶液中加入适量的NaOH溶液时,溶液呈 色;当加入浓盐酸时,溶液呈 色。
(3)在试管中加入3mL硫酸酸化的K2Cr2O7溶液,然后向其中滴加乙醇,观察到橙红色褪去,变为蓝紫色,并产生酸味物质。请写出该过程的离子方程式: 。
25.(12分)(Ⅰ)如图所示,甲、乙之间的隔板K和活塞F都可左右自由移动,甲中充入2molA和1molB,乙中充入2molC和1molHe,此时K停在0处。在一定条件下发生可逆反应:2A(g)+B(g)![]() 2C(g);反应达到平衡后,再恢复至原温度。
2C(g);反应达到平衡后,再恢复至原温度。
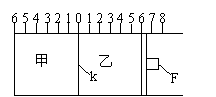 回答下列问题:
回答下列问题:
(1)可根据
现象来判断甲、乙都已达到平衡。
(2)达到平衡时,隔板K最终停留在0刻度左侧a处,则a的取值范围是 。
(3)若达到平衡时,隔板K最终停留在左侧刻度1处,则甲中C的物质的量为
mol,乙中C的转化率 50%(填:>、<、=),此时,乙中可移动活塞F最终停留在右侧刻度 处(填下列序号:① <6 ② >6 ③ =6)。
(4)若达到平衡时,隔板K最终停留在左侧刻度靠近0处,则乙中可移动活塞F最终停留在右侧的刻度不大于 (填:6、7、8);若K最终停留在左侧刻度靠近2处,则乙中F最终停留在右侧的刻度不小于 (填:4、5、6)。
(Ⅱ)若一开始就将K、F固定,其它条件均不变,则达到平衡时:
(1)甲、乙中C的物质的量的关系是
(填:“甲>乙”或“甲<乙”或“甲=乙” );
(2)测得甲中A的转化率为b,则乙中C的转化率为 ;
(3)假设乙、甲两容器中的压强比用d表示,则d的取值范围是 。
高三化学试卷参考答案及评分标准
1.B 2.D 3.A 4.C 5.A 6.C 7.D 8.B
9.A 10.A B 11.D 12.BD 13.C 14.D 15.AD 16.AC
17.(1)1mol/L的硫酸所用的时间长,因为浓度小的反应速率慢。 (2分)
(2)锌溶解 有气泡产生 活塞外移 (2分); 产生气泡的速率不同 (1分)
(3)D (1分) 此反应是放热反应,温度升高,反应速率加快;随反应的进行,H+浓度不断减小,反应速率减慢。 (2分)
(4)打开分液漏斗的玻璃塞 (2分)
18.⑴ 113℃ ~450℃ (2分)
⑵ ![]() (2分)
(2分)
⑶ [ 1 ]A12Te3 + [ 6 ] H2O ==[ 2 ]A1(OH)3↓+[ 3 ]H2Te↑ (2分)
⑷ 非金属元素的氢化物越稳定,△H越小,反之亦然 (2分)
⑸ H2Se(g)=Se(s)+H2(g);△H=-81kJ/mol (2分)
19.八 (1分) 第三周期第IA族 (2分)
低 (1分) 固 (1分) 能 (1分) 易 (1分) 离子化合物 (1分)
20.(1)放热; (2分) 需要; (2分)
-(E1 - E2) kJ·mol-1 或E2 - E1 kJ·mol-1 (2分)
(2)409 kJ·mol-1 ; (2分)
(3)使用了催化剂。 (2分)
21.循环过程需要很高的能量,且使用重金属汞,会产生污染。 (2分)
① SO2+I2+2H2O![]() 2HI+H2SO4 (2分)
2HI+H2SO4 (2分)
② 2H2SO4![]() 2SO2+O2 +2H2O (2分)
2SO2+O2 +2H2O (2分)
③ 2HI![]() H2 + I2 (2分)
H2 + I2 (2分)
SO2和I2可循环使用,无污染。 (2分)
22.可能增大也可能减小 (2分) A (2分) B (2分) C (2分)
23.⑴ CO2(或N2O); (2分) 直线型 (1分) ;极性分子 (1分)
⑵ < (1分) ; < (1分)
⑶ 2AgN3=2Ag+3N2 (2分)
⑷ 3NaN3 = Na3N +4N2↑ (2分)
24.(1)Cr3++3OH—![]() Cr(OH)3
Cr(OH)3
![]() H++CrO2—+ H2O (2分)
H++CrO2—+ H2O (2分)
(2) 黄;(2分) 蓝紫 (2分)
(3)3CH3CH2OH+2 Cr2O72—+16H+ = 3CH3COOH+4Cr3+ +11 H2O(2分)
25.(Ⅰ)(1)K、F不再移动 (1分)
(2)0<a<2 (1分)
(3)1 > ② (2分)
(4)8 4 (2分)
(Ⅱ)(1)甲=乙 (2分)
(2)1-b (2分)
(3)![]() <d<
<d<![]() (2分)
(2分)