高三化学第一学期期中测试题
高三化学测试题
本试卷分选择题和非选择题两部分,满分为150分。考试用时120分钟。
可能用到的相对原子质量:
H 1 Li 7 C 12 N 14 O 16 Na 23 Mg 24
Al 27 Cl 35.5 K 39 Fe 56 Rb 85 Cr 52 S 32
第一卷 选择题 (共70分)
一、选择题(本题包括10小题,每小题3分,共30分。每小题只有一个选项符合题意。)
1.下列有关物质分类或归类正确的是
①混合物:石炭酸、福尔马林、水玻璃、水银
②化合物:CaCl2、烧碱、聚苯乙烯、HD
③电解质:明矾、胆矾、冰醋酸、硫酸钡
④同系物:CH2O2、C2H4O2、C3H6O2、C4H8O2
⑤同素异形体:C60、C70、金刚石、石墨
A.①③④ B.②④ C.②③④ D.③⑤
2.下列选项所述的两个量中,前者一定大于后者的是
A. 在80℃和25℃时,纯水的pH
B. 常温常压下,HF与HCl的沸点
C. Cl2与CO2在水中的溶解度
D. 等浓度的CH3COOH与CH3COONa溶液中的c(CH3COO-)
3."类推"是一种常用的学习方法,但有时会产生错误的结论,下列类推结论中正确的是
A.ⅣA族元素氢化物沸点顺序是:GeH4>SiH4>CH4;则ⅤA族元素氢化物沸点顺序也是:AsH3>PH3>NH3
B.第二周期元素氢化物的稳定性顺序是:HF>H2O>NH3;则第三周期元素氢化物的稳定性顺序也是:HCl>H2S>PH3
C.晶体中有阴离子,必有阳离子;则晶体中有阳离子,必有阴离子
D.干冰(CO2)是分子晶体,则SiO2也是分子晶体
4.下列叙述中不正确的是
A.油脂水解后一定能得到丙三醇
B.相同温度下,把100g水面上的空气换成相同压力的纯氧,则水中溶入氧气的质量增加
C.天然蛋白质水解的最后产物只有一种α—氨基酸
D.向某一饱和硫酸铜溶液中,加入含18O的带标记的无水硫酸铜粉末a g,如果保持温度不变,则溶液中可找到带标记的S18O42-,而且白色粉末变为蓝色晶体,其质量大于a g
5.化学实验室中常将溶液或试剂进行酸化,下列酸化处理中正确的是
A.检验C2H5Br中含Br元素时,将C2H5Br和NaOH溶液混合加热后,加硫酸酸化
B.为提高KMnO4溶液的氧化能力,用盐酸将KMnO4溶液酸化
C.鉴定待测溶液中是否含有Fe2+时,用硝酸酸化
D.鉴别溶液中是否含有SO42-时,所加的氯化钡溶液可以用盐酸酸化
6.金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍(已知:氧化性Fe2+<Ni2+<Cu2+),下列叙述正确的是
A.阳极发生还原反应,其电极反应式:Ni2+ + 2e— = Ni
B.电解过程中,阳极质量的减少与阴极质量的增加相等
C.电解后,溶液中存在的金属阳离子只有Fe2+ 和Zn2+
D.电解后,电解槽底部的阳极泥中只有Cu和Pt
7.在乙烯分子中有5个σ键、一个π键,它们分别是
A.sp2杂化轨道形成σ键、未杂化的2p轨道形成π键
B.sp2杂化轨道形成π键、未杂化的2p轨道形成σ键
C.C-H之间是sp2形成的σ键,C-C之间是未参加杂化的2p轨道形成的π键
D.C-C之间是sp2形成的σ键,C-H之间是未参加杂化的2p轨道形成的π键
8.有五个系列同族元素的物质,101.3kP时测定它们的沸点(℃)如下表所示:
| ① | He -268.8 | (a) -249.5 | Ar -185.8 | Kr -151.7 |
| ② | F2 -187.0 | Cl2 -33.6 | (b) 58.7 | I2 184.0 |
| ③ | (c) 19.4 | HCl -84.0 | HBr -67.0 | HI -35.3 |
| ④ | H2O 100.0 | H2S -60.0 | (d) -42.0 | H2Te -1.8 |
| ⑤ | CH4 -161.0 | SiH4 -112.0 | GeH4 -90.0 | (e) -52.0 |
对应表中内容,下列叙述中正确的是
A.上表中各物质形成的晶体均为分子晶体
B.系列②物质均有氧化性;系列③物质对应水溶液均是强酸
C.系列④中各化合物的稳定性顺序为:H2O<H2S<H2Se<H2Te
D.上表内物质HF和H2O,由于氢键的影响,其分子特别稳定
9.下列有关溶液中所含物质或离子的检验,判断中正确的是
A.加入AgNO3溶液生成的白色沉淀不溶于稀盐酸,则原溶液中一定有Cl-存在
B.加入数滴新制的Cu(OH)2浊液并加热,出现红色沉淀,则原溶液中一定有葡萄糖
C.加入盐酸有能使澄清石灰水变浑浊的气体产生,则原溶液中一定有CO32-存在
D.加入氨水时生成白色沉淀,当氨水过量时白色沉淀消失,则原溶液中一定无Al3+存在
10.7 gCu—Ag合金与足量的HNO3反应,将放出的气体与560 mLO2(标准状况下)混合,通入水中,恰好全部吸收,则合金中Cu的质量为
A.1.6g B.3.2g C.6.4g D.9.6g
二、选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分。)
11.几种短周期元素的原子半径及主要化合价见下表:
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +2 | -2 |
下列叙述正确的是
A.L、M的单质与稀盐酸反应速率M> L
B.常用M与T形成的化合物做为耐火材料
C.R的最高价氧化物的水化物的碱性比L的最高价氧化物的水化物的强
D.L、Q形成的简单离子核外电子数相等
12.下列反应的离子方程式书写正确的是
A. 氯化铝溶液中加入过量氨水:
Al3+ + 4NH3•H2O AlO2- + 4NH4+
+ 2H2O
B. 澄清石灰水与少量苏打溶液混合:
Ca2+ + OH- + HCO3- CaCO3↓ + H2O
C. 碳酸钙溶于醋酸:CaCO3 +
2H+ Ca2+ + CO2↑ + H2O
D. 氯化亚铁溶液中通入氯气:2Fe2+ +
Cl2 2Fe3+ + 2Cl-
13.下列物质性质的变化规律,与共价键的键能大小有关的是
A.F2、Cl2、Br2、I2的熔点、沸点逐渐升高
B.HF、HCl、HBr、HI的热稳定性依次减弱
C.金刚石的硬度、熔点、沸点都高于晶体硅
D.NaF、NaCl、NaBr、NaI的熔点依次降低
14.已知25℃、101kPa条件下:
4Al(s)+3O2(g)==2Al2O3 △H=-2834.9kJ·mol-1
4Al(s)+2O3(g)==2Al2O3 △H=-3119.1kJ·mol-1
由此得出的正确结论是
A.等质量的O2比O3能量低,由O2变O3为放热反应
B.等质量的O2比O3能量低,由O2变O3为吸热反应
C.O3比O2稳定,由O2变O3为放热反应
D.O2比O3稳定,由O2变O3为吸热反应
15.下列叙述正确的是
A.0.1mol·L-1氨水中,c(OH- )=c(NH4+)
B.10 mL 0.02mol·L-1HCl溶液与10 mL 0.02mol·L-1Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=12
C.在0.1mol·L-1CH3COONa溶液中,c(OH- )=c(CH3COOH)+c(H+ )
D.0.1mol·L-1某二元弱酸强碱盐NaHA溶液中,c(Na+)=2c(A2-)+c(HA- )+c(H2A)
16. 25℃时,将稀氨水逐滴加入到稀硫酸中,当溶液的PH=7时,下列关系正确的是
A.c(NH4+)==c(SO42-) B.c(NH4+)>c(SO42-)
C.c(NH4+)<c(SO42-) D.c(OH-)+c(SO42-)==c(H+)+c(NH4+)
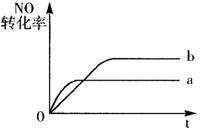
17.在容积不变的密闭容器中,一定条件下进行如下反应:
NO(g)+CO(g)=0.5N2(g)+CO2(g); △H=-373.2kJ/mol。
右图曲线a表示该反应过程中,NO的转化率
|
过程按照曲线b进行,可采取的措施是
A.加催化剂
B.降低温度
C.增大反应物中NO的浓度
D.向密闭容器中加入氩气
18.用相同浓度的盐酸分别中和等体积的Ca(OH)2、NaOH、NH3·H2O三种溶液时,若碱溶液pH相等,消耗的体积分别为V1、V2、V3,则下列关系可以成立的是
A.V1 > V2=V3 B.V1 > V2 > V3 C.V1=V2 < V3 D.V1=V2=V3
19. 盖斯定律认为:不管化学过程是一步完成或分为数步完成,这个过程的热效应是相同的。
已知 H2O(g)=H2O(l) △H1=-Q1 kJ/mol
C2H5OH(g)=C2H5OH(l) △H2=-Q2 kJ/mol
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) △H3=-Q3 kJ/mol
若使23 g酒精液体完全燃烧,最后恢复到室温,则放出的热量为
A.Q1+Q2+Q3 B.0.5(Q1+Q2+Q3)
C.0.5Q1-1.5Q2+0.5Q3 D.0.5Q2-0.5Q3-1.5Q1
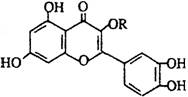 20.天然维生素P(结构如图)存在于槐树花蕾中,它是一种营养增补剂。关于维生素P的叙述错误的是
20.天然维生素P(结构如图)存在于槐树花蕾中,它是一种营养增补剂。关于维生素P的叙述错误的是
A. 可以和溴水反应
B. 可用有机溶剂萃取
C. 分子中有三个苯环
D. 1mol维生素P可以和5molNaOH反应
第二卷 非选择题(共80分)
三、实验部分(本题包括3小题,共34分)
21.(10分)
(1)下列有关实验的基本操作及安全知识的叙述,正确的是 (填序号)。
A.附着于试管内壁的苯酚,可用碱液洗涤
B.用结晶法可以除去硝酸钾中混有的少量氯化钠
C.切割白磷时,必须用镊子夹取,置于桌面上的玻璃片上,小心用刀切割
D.实验时,不慎打翻燃着的酒精灯,可立即用湿抹布盖灭火焰
E.浓硫酸不小心沾到皮肤上,立刻用稀烧碱溶液洗涤
F.在氢氧化铁胶体中滴加少量稀硫酸会产生沉淀
(2)下表是某种常见金属的部分性质:
| 颜色状态 | 硬度 | 密度 | 熔点 | 导电性 | 导热性 | 延展性 |
| 银白色固体 | 较软 | 2.70g/cm3 | 660.40C | 良好 | 良好 | 良好 |
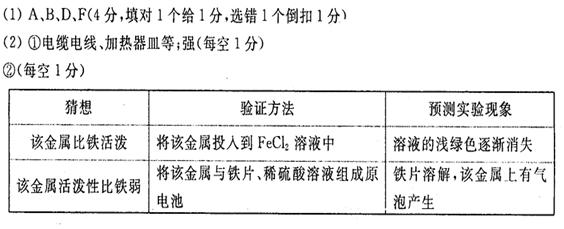
将该金属投入冷水中无变化,投人稀盐酸中可产生大量的无色气体。试回答:
①推断该金属可能的一种用途 ,该金属的活动性比铜 (填“强”或“弱”)。
②请自选试剂,设计不同的实验探究该金属与铁的活动性强弱,并完成下表:
| 猜想 | 验证方法 | 预测实验现象 |
| 该金属比铁活泼 | ||
| 该金属活泼性比铁弱 |
22.(14分)空气吹出法工艺,是目前“海水提溴”的最主要方法之一。其工艺流程如下:
 |
(1) 溴在周期表中位于_________周期,_________族。
(2) 步骤①中用硫酸酸化可提高Cl2的利用率,为什么? 。
(3) 步骤④的离子方程式: 。
(4) 步骤⑥的蒸馏过程中,溴出口温度为何要控制在80—900C。温度过高或过低都不利于生产,请解释原因: 。
(5) 步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差很大的特点进行分离。分离仪器的名称是_____________,分离时液溴从分离器的_____(填“上口”或“下口”)排出。
(6)为什么不直接用含溴的海水进行蒸馏得到液溴,而要经过“氯化、空气吹出、SO2吸收”: 。
23.(10分)某化学兴趣小组按照下列方案进行“由含铁废铝制备硫酸铝晶体”的实验:
步骤1:取一定量含铁废铝,加足量的NaOH溶液,反应完全后过滤。
步骤2:边搅拌边向滤液中滴加稀硫酸至溶液的pH=8~9,静置、过滤、洗涤。
步骤3:将步骤2中得到的固体溶于足量的稀硫酸。
步骤4:将得到的溶液蒸发浓缩、冷却、结晶、过滤、干燥。
请回答以下问题:
⑴上述实验中的过滤操作需要玻璃棒、______________、______________等玻璃仪器。
⑵步骤1过滤的目的是__________________________________________。
⑶当步骤2中的溶液pH=8~9时,检验沉淀是否完全的方法是______________。
⑷步骤2中溶液的pH控制较难操作,可改用________________ ____。
四、无机部分(本题包括4小题,共36分)
24.(10分)我国有丰富的天然气资源。以天然气为原料合成尿素的主要步骤如下图所示(图中某些转化步骤及生成物未列出):
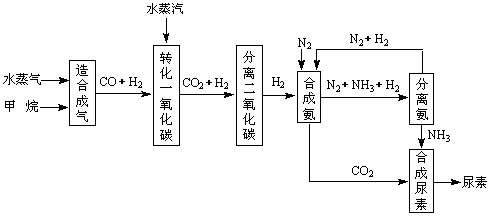 |
请填写下列空白:
(1)已知0.5 mol甲烷和0.5 mol水蒸气在t ℃,p k Pa时,完全反应生成一氧化碳和氢气(合成气),吸收了a kJ热量。该反应的热化学方程式是: 。
(2)在合成氨的实际生产过程中,常采取的措施之一是:将生成的氨从混合气体中及时分离出来,并将分离出氨后的氮气和氢气循环利用,同时补充氮气和氢气。请应用化学反应速率和化学平衡的观点说明采取该措施的理由: 。
(3)当甲烷合成氨气的转化率为75%时,以5.60×107 L甲烷为原料能够合成 L 氨气。(假设体积均在标准状况下测定)
(4)已知尿素的结构简式为 ,请写出两种含有碳氧双键的尿素的同分异构体的结构简式:① ,② 。
25.(11分)有常见A、B、C三种短周期元素,它们的原子序数逐渐增大,B元素原子最外层电子数是C元素原子最外层电子数的一半,A元素最外层电子数比B多一个。甲、乙、丙是3种含氧酸的钠盐,甲中含B元素,乙中含C元素,丙中含A元素,甲、丙溶液pH>7,乙溶液pH<7;丁为气体,戊为淡黄色固体。甲、乙、丙、丁、戊、己六种物质之间的相互反应关系如下图:
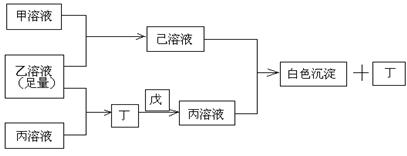
请回答:
(1)写出C元素的原子结构示意图_______________,写出丁和戊的电子式____________、_________________;
(2)用有关化学用语解释:
乙溶液呈酸性的原因____________________________;
丙溶液呈碱性的原因____________________________;
(3)写出有关反应的离子方程式:
①乙溶液+丙溶液→丁______________________________;
②己溶液+丙溶液→丁______________________________。
26.(6分)合成氨工业生产中所用的α—Fe催化剂的主要成分是FeO、Fe2O3
(1)某FeO、Fe2O3混合物中,铁、氧的物质的量之比为4:5,其中Fe2+与Fe3+物质的量之比为___________。
(2)当催化剂中Fe2+与Fe3+的物质的量之比为1:2时,其催化活性最高,此时铁的氧化物混合物中铁的质量分数为____________
(3)以Fe2O3为原料制备上述催化剂,可向其中加入适量炭粉,发生如下反应:
2 Fe2O3十C ![]() 4FeO十CO2↑。为制得这种活性最高的催化剂,应向480g Fe2O3粉末中加入炭粉的质量为_________g。
4FeO十CO2↑。为制得这种活性最高的催化剂,应向480g Fe2O3粉末中加入炭粉的质量为_________g。
27.(9分)有X、Y、Z三种元素,已知:
①X2-、Y-均与Y的气态氢化物分子具有相同的电子数;
②Z与Y可组成化合物ZY3,ZY3溶液遇苯酚呈紫色。
请回答:
⑴Y的最高价氧化物对应水化物的化学式是 。
⑵将ZY3溶液滴入沸水可得红褐色液体,反应的离子方程式是
,
此液体具有的性质是 (填写序号字母)。
a.光束通过该液体时形成光亮的“通路”
b.插入电极通直流电后,有一极附近液体颜色加深
c.向该液体中加入硝酸银溶液,无沉淀产生
d.将该液体加热、蒸干、灼烧后,有氧化物生成
⑶X单质在空气中燃烧生成一种无色有刺激性气味的气体。
①已知一定条件下,每1mol该气体被O2氧化放热98.0kJ。若2mol 该气体与1mol O2在此条件下发生反应,达到平衡时放出的热量是176.4kJ,则该气体的转化率为 。
②原无色有刺激性气味的气体与含1.5molY的一种含氧酸(该酸的某盐常用于实验室制取氧气)的溶液在一定条件下反应,可生成一种强酸和一种氧化物,若有1.5×6.02×1023个电子转移时,该反应的化学方程式是 。
五、有机部分(本题包括1小题,共10分)
28.(10 分)某芳香烃A有如下转化关系:
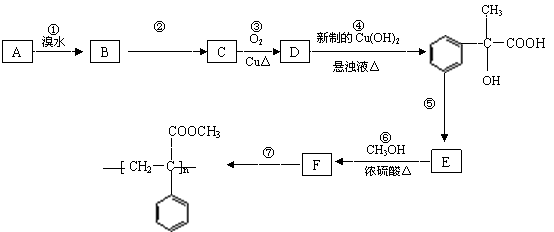
按要求填空:
⑴写出反应②和⑤的反应条件:② ;⑤ 。
⑵写出A和F结构简式:A ;F 。
⑶写出反应③对应的化学方程式:
③ 。
高三化学测试题 答 题 卷
班级 姓名 座号 评分
第一卷 选择题部分 (共70分)
一、(本题包括10小题,每小题3分,共30分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 |
二、(本题包括10小题,每小题4分,共40分)
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 |
第二卷 非选择题部分 (共80分)

三、(本题包括3小题,共34分)
21.(10分)(1)、_____________________
(2) ① ,
 ②
②
| 猜想 | 验证方法 | 预测实验现象 |
| 该金属比铁 活泼 | ||
| 该金属活泼性比铁弱 |
22.(14分)
(1) , 。
(2) 。
(3) 。
(4)
。
(5) , 。
(6) 。
 23.(10分)(1)、__________、___________
23.(10分)(1)、__________、___________
(2)
(3)
(4)
四、(本题包括4小题,共36分)
24.(10分)
(1) 。
(2)
。
(3) 。
(4) 。
25.(11分)
(1)、 ; ; ;
 (2)、 ;
(2)、 ;
;
(3)、① ;
② ;
26、(6分) (1)、 (2)、 (3)、
27、(9分)
(1)、
(2)、 ,
。
(3)、①
②
五、(本题包括小题,共10分)
28.(10 分)(1)② ; ⑤ 。
(2)、A: F:
(3)、
高三化学测试题 参考答案及评分细则
第一卷 选择题部分 (共67分)
一、(本题包括9小题,每小题3分,共27分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | D | B | B | C | D | D | A | A | D | A |
二、(本题包括10小题,每小题4分,共40分)
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | B | D | BC | BD | BC | B | B | C | D | CD |
第二卷 非选择题部分 (共83分)
21.(10分)
22.(14分)
(1)4 VIIA (2分)
(2)酸化可防止Cl2 、Br2与水反应 (2分)
(3)Br2+SO2+2H2O=4H++2Br-+SO42- (2分)
(4)温度过高,大量水蒸气随水排除出,溴气中水增加;
温度过低,溴不能完全蒸出,吸收率低。 (2分)
(5)分液漏斗 下口 (2分)
(6)氯化后的海水虽然含有溴单质,但浓度低,如果直接蒸馏原料,产品成本高。(2分)
“空气吹出、SO2吸收、氯化”的过程实际上是一个Br2的浓缩过程。(2分)
 23.(10分)
23.(10分)
(1)烧杯 漏斗 (各1分)
(2)除去铁等不溶于碱的杂质(2分)
(3)取上层清夜,逐滴加入稀硫酸,若变浑浊则说明沉淀不完全,若不变浑浊则说明沉淀完全(3分)
(4)通入足量的CO2气体(3分)
24.(10分)
(1)CH4(g)+H2O(g)![]() CO(g)+3H2(g);△H=2a
kJ/mol (2分)
CO(g)+3H2(g);△H=2a
kJ/mol (2分)
(2)增大氮气和氢气的浓度有利于增大反应速率;减小氨气的浓度,增大氮气和氢气的浓度都有利于平衡向正反应方向移动。(2分)
(3)1.12×108 ;(2分)
![]() (4)
(4分)
(4)
(4分)
25.(11分)
(1)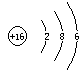

 (每空1分)
(每空1分)
(2)NaHSO4=Na++H++SO42-、NaHSO4在水溶液中完全电离出氢离子使溶液呈酸性
![]() CO32-+H2O HCO3-+OH-、CO32-水解使溶液呈碱性
CO32-+H2O HCO3-+OH-、CO32-水解使溶液呈碱性
(每空方程式1分,叙述1分)
(3)2H++CO32-=H2O+CO2↑;(方程式2分)
2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑(方程式2分)
26.(6分)(1)1 :1 (2分) (2)71% (2分) (3)6g(2分)
27.(9分)
(1)HClO4 (1分)
(2) Fe3+ + 3 H2O ![]() Fe(OH)3(胶体) + 3H+ (2分)
Fe(OH)3(胶体) + 3H+ (2分)
a b d (2分)
(3) ①90% (2分)
② SO2 + HClO3 = H2SO4 + 2ClO2 (2分)
28.(10分)
(1)NaOH溶液、△(2分); 浓硫酸、△(2分)。
(2)A: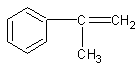 (2分) F:
(2分) F: 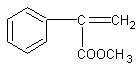 (2分)
(2分)
(3)
2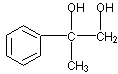 +O2
+O2 2
2 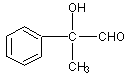 +2H2O (2分)
+2H2O (2分)