高三化学第一学期期中考试
(考试时间120分钟,满分150分)
相对原子质量:Fe-56 Cu-64 H-1 O-16 N-14
第Ⅰ卷(共66分)
一、选择题(本题共10分,每小题2分,只有一个正确答案)
1、“信息”、“材料”和“能源”被称为新科技革命的三大支柱。下列有关说法中,错误的是[ ]
A、在即将到来的新能源时代,核能、太阳能、氢能将成为主要能源
B、目前中美日等国掌握的陶瓷发动机技术,大大提高了发动机的能量转化效率
C、“神舟六号”载人飞船使用了大量的复合材料
D、合成高分子材料的广泛应用是有百利而无一害的
2、中国科学家以二氧化碳为碳源,金属钠为还原剂,在470℃、80MPa下合成金刚石。下列说法不正确的是[ ]
A、由二氧化碳合成金刚石是化学变化
B、金刚石是碳的一种同位素
C、钠被氧化最终生成碳酸钠
D、金刚石中只含有非极性共价键
3、将等物质的量的Ag+、Na+、Ca2+、NO3-、SO42-、Cl-放入水中形成混合溶液,以石墨为电极,将该溶液放在电解槽中电解片刻,氧化产物与还原产物的质量比为………( )
A、35.5:108 B、2:27 C、8:1 D、108:35.5
4、为了进一步提高合成氨的生产效率,科研中最后开发价值的是[ ]
A、研制低温下活性较大的催化剂、
B、研制高温下活性较大的催化剂
C、寻求氮气的新来源
D、研制耐高温、高压材料,用于制造合成塔。
5、2002年诺贝尔化学奖得主之一的瑞士科学家维特里希巧妙地选用生物大分子中的M原子作为测量对象,测出相邻M原子间的距离和方位,再通过计算机破译了某些生物大分子的空间结构。已知M原子是有机分子中数量最多的原子,该原子是[ ]
A、C B、H C、O D、N
二、选择题(本题共36分,每小题3分,只有一个正确答案)
6、在化学研究性学习中,常常要查阅数据材料。下面是某学生对数据的利用,其中不正确的是[ ]
A、利用固体溶解度数据可判断煮沸Mg(HCO3)2溶液时,得到的产物是Mg(OH)2,而不是碳酸镁
B、由原子(或离子)半径数据可推断某些原子(或离子)的氧化性和还原性强弱
C、利用液体密度数据可以判断液体物质挥发性的大小
D、利用沸点数据可推测一些液体混合物一一分离的可能性
7、某温度下,向PH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的PH=2,对于该溶液,下列叙述中不正确的是[ ]
A、该温度高于25℃
B、由水电离出的氢离子浓度为1×10-10摩尔/升
C、c(H+)=c(OH-)+c(SO42-)
D、该温度下加入等体积PH为12的NaOH溶液,可使反应后的溶液恰好呈中性。
8、下列离子方程式正确的是[ ]
A、铝和氢氧化钠溶液的反应
2Al+2OH-+H2O → 2AlO2- + 3H2↑
B、将二氧化碳气体持续通入饱和碳酸钠溶液中
CO2 +2Na++ CO32- + H2O → NaHCO3↓
C、含等物质的量的硫酸氢钠与氢氧化钡两溶液混合
2H+ +2OH-+Ba2+ +SO42- →BaSO4 ↓+2H2O
D、碳酸氢钙溶液中加入足量的烧碱溶液
Ca2+ +HCO3- +OH- → CaCO3 ↓ +H2O
9、医院里用HgCl2的稀溶液做手术刀的消毒剂,已知HgCl2的熔点为277℃,熔融状态的HgCl2不能导电,HgCl2的稀溶液有很弱的导电能力。则关于HgCl2的下列叙述正确的是[ ]
A、HgCl2的溶液中存在HgCl2分子
B、固态HgCl2是离子晶体
C、HgCl2是一种正盐,属强电解质
D、HgCl2溶液中不存在电离平衡
10、常温下,将10克下列固体与90克水充分混合,所得溶液溶质质量分数最小的是[ ]
A、氧化钙 B、氧化钠 C、硝酸钾 D、胆矾
11、下列离子在溶液中因发生氧化还原反应而不能大量共存的是[ ]
A、K+、Fe2+、NO3-、I- B、H3O+、K+、S2-、ClO-
C、NH4+、K+、S2-、SO42- D、Mg2+、Fe3+、Br-、Cl-
12、最近科学家冶炼出了纯度高达99.9999%的铁,你估计它不会具有的性质是[ ]
A、硬度比生铁低 B、在潮湿的空气中不易生锈
C、与4摩尔/升盐酸的反应速率比生铁快
D、在冷的浓硫酸中可钝化
13、在C3H9N中,N原子以三个单键与其他原子相连接,它具有的同分异构体数目为[ ]
A、1 B、2 C、3 D、4
14、在一定条件下,RO3n-和I-发生反应的离子方程式为:
RO3n- +6 I- +6H+ → R- +3I2 +3H2O
则RO3n-中R元素的化合价与R元素原子最外层电子数分别为[ ]
A、+5、5 B、+5、7 C、+7、7 D、+6、6
15、化学实验室中常将溶液或试剂进行酸化,下列酸化处理的措施中正确的是[ ]
A、为提高高锰酸钾溶液的氧化能力,用盐酸将高锰酸钾酸化
B、检验溶液中是否含有Fe2+时,用硝酸酸化
C、检验溶液中是否含有SO42-时,在无其他阳离子干扰的条件下,所加的氯化钡溶液用盐酸酸化、
D、定性检验SO32-,将氯化钡溶液用硝酸酸化
16、在密闭容器中有可逆反应:nA (g) + mB(g) ![]() pC(g) – Q处于平衡状态(已知n+m>p,Q>0),则下列说法正确的是[ ]
pC(g) – Q处于平衡状态(已知n+m>p,Q>0),则下列说法正确的是[ ]
①升温,c(B)/c(C)的比值变小
②降温时体系内混合气体平均相对分子质量变小
③增加B的物质的量,A的转化率增大
④加入催化剂,气体的总的物质的量不变
⑤加压使容器体积减小,A或B的浓度一定降低
⑥若A的反应速率为VA,则B的反应速率为VAn/m
A、①②③⑤ B、①②③④ C、①②⑤⑥ D、③④⑤⑥
17、A和B为同温度下的两种稀氨水。A溶液的浓度为c mol/L、电离度为α1,B 溶液中[NH4+]为c mol/L、电离度为α2,则下列判断中错误的是[ ]
A、A溶液中OH-的浓度为B中OH-的浓度的α1倍
B、α1 > α2
C、B溶液中物质的量浓度可表示为c/α2 mol/L
D、 [OH-]A > [OH-]B
三、选择题(本题共20分,每小题4分,每小题有一个或两个正确答案。多选不得分,选对一个得2分,选错一个该小题不得分)
18、常温下将稀NaOH溶液与稀CH3COOH溶液混合,不可能出现的结果是[ ]
A.pH>7,且 c(OH—) > c(Na+) > c(H+) > c(CH3COO—)
B.pH>7,且 c(Na+) + c(H+) = c(CH3COO—) + c(OH—)
C.pH<7,且c(CH3COO—) > c(H+) >c(Na+)> c(OH—)
D.pH=7,且c(CH3COO—) > c(Na+) >c(H+) = c(OH—)
19、A、B、C、D四种短周期元素的原子半径依次减小,A与C的核电荷数之比为3∶4,D能分别与A、B、C形成电子总数相等的分子X、Y、Z。下列叙述正确的是[ ]
A、X、Y、Z的稳定性逐渐减弱
B、A、B、C、D只能形成5种单质
C、X、Y、Z三种化合物的熔沸点逐渐升高
D、自然界中存在多种由A、B、C、D四种元素组成的化合物
20、已知Co2O3在酸性溶液中易被还原成Co2+,Co2O3、Cl2、FeCl3、I2氧化性依次减弱。下列反应在水溶液中不可能发生的是[ ]
A.3 Cl2 + 6 FeI2 →2FeCl3 + 4 FeI3 B.Cl2 + FeI2 →FeCl2 + I2
C.Co2O3 + 6 HCl →2CoCl2 + Cl2↑+ 3H2O
D.2Fe3+ + 2I— →2Fe2+ + I2
21、用NA表示阿伏加德罗常数,下列叙述正确的是[ ]
A、常温常压下,16gO2和O3的混合物所含分子数为0.5NA
B、1mol CH3+(碳正离子)中含有电子数为8NA
C、常温常压下,31g白磷与红磷混合物,含有NA个磷原子
D、1L 0.1mol·L-1的FeCl3溶液中含Fe3+为0.1NA
22、下列各图中,纵坐标表示能量,横坐标表示反应过程,均从反应物开始,则表示正反应是吸热反应的是[ ]
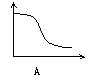
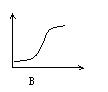
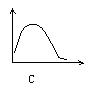
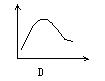
第Ⅱ卷(共84分)
四、(本题共45分)
23、智利硝石矿层中含有碘酸钠,可用亚硫酸氢钠与其反应来制备单质碘。
(1)配平该反应的化学方程式,并用短线标出电子转移方向及总数。
NaIO3 + NaHSO3 → NaHSO4 + Na2SO4 + I2 + H2O
(2)已知含氧酸盐的氧化作用随着溶液酸性的增强而增强。在制备实验时,
定时取样,并用酸化的氯化钡来检测SO42-离子生成的量,发现开始阶段,
反应速率呈递增趋势,可能的原因 __________
________________________________________________________________
反应进行一段时间后,反应速率又呈递减趋势,可能的原因
是 __________________________________ 。
24、t℃时,将3摩尔A和1摩尔B气体通入体积为2L的密闭容器中(容积不变),发生如下反应:3A(g)+B(g)![]() xC(g),2min时反应时反应达到平衡状态(温度不变),剩余了0.8molB,并测得C的浓度为0.4mol/L。请填写:
xC(g),2min时反应时反应达到平衡状态(温度不变),剩余了0.8molB,并测得C的浓度为0.4mol/L。请填写:
(1)从开始反应至达到平衡状态,生成C的平均反应速率为_________。
(2)X=_________________
(3)该反应化学平衡常数表达式为K=___________________________。
(4)若继续向原平衡混合物的容器中通入少量氦气后,化学平衡[ ]
A、向正反应方向移动 B、向逆反应方向移动 C、不移动
25、人们对酸碱的认识,已有几百年的历史,经历了一个由浅入深、由低级到高级的认识过程。
(1)目前中学课本中的酸碱理论是1887年阿仑尼乌斯提出的电离理论。试用电离方程式表示氨的水溶液呈弱碱性的原因
_________________________________________ 。
(2)1923年丹麦化学家布朗斯特和英国化学家劳莱提出了质子理论。凡是能够释放质子(![]() )的任何含氢原子的分子或离子都是酸;凡是能与质子(
)的任何含氢原子的分子或离子都是酸;凡是能与质子(![]() )结合的分子或离子都是碱。按质子理论,下列粒子在水中既可看作酸又可看作碱的是
(填写序号)。
)结合的分子或离子都是碱。按质子理论,下列粒子在水中既可看作酸又可看作碱的是
(填写序号)。
A、CH3COO— B、NH3 C、H2O D、HSO3- E、OH- F、NO3-
(3)1923年路易斯提出了广义的酸碱理论。凡是能给出电子对用来形成化学键的物质都是碱;凡是能和电子对结合的物质都是酸。因此酸又称为电子对接受体,碱是电子对的给予体。
试指出下列两个反应中的酸或碱:
①![]()
![]()
![]() ,该反应中的碱是 _____ (填“
,该反应中的碱是 _____ (填“![]() ”或“
”或“![]() ”)。②
”)。②![]()
![]()
![]() ,该反应中的酸是 ___
(填“
,该反应中的酸是 ___
(填“![]() ”或“
”或“![]() ”)
”)
26、某些金属氧化物跟熔融烧碱反应可生成盐。一些单质及其化合物的相互转化关系如下图。根据以下框图填空:
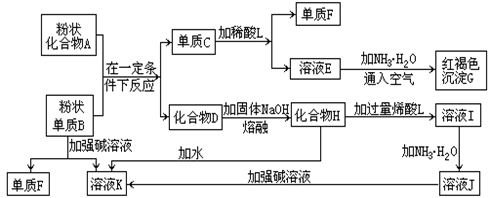
(1)单质F是 _____ (填化学式)。
(2)写出由E生成G的离子反应方程式 。
(3)溶液I中所含金属阳离子是 。
(4)稀酸L若改用浓酸,则不能选用的浓酸是 。
27、已知X元素的原子K层比M层多1个电子,Y元素的原子最外层电子数比内层电子总数少3个,Z元素原子最外层电子排布式为3sn3pn-1。
(1)这三种元素的元素符号是:X_________Y_________Z_________
(2)X、Y所形成的化合物的电子式____________________。
(3)检验某化合物是否含有X元素所采用的实验方法称为
_____________________。
(4)Y和Z形成的化合物的化学式____________。实验测得,当此化合物在液态或固态时不导电,溶于水时能导电,由此判断该化合物具有
____________键。
五、(本题共22分)
28、在某浓度的NaOH溶液中滴加几滴酚酞试液,溶液立即呈红色,再向其中逐滴加入新制的饱和氯水,当滴到最后一滴时,红色突然褪去。回答下列问题:
(1)产生该现象的原因可能有:
①
②
(2)简述怎样用实验证明红色褪去的原因是①或者是②:
29、有一瓶澄清的溶液,其中可能含有NH4+ 、 K+ 、 Na+ 、 Mg2+、 Ba2+ 、 Al3+ 、Fe3+、Cl-、I-、 NO3-、CO32 -、S2- 、SO42- 、AlO2- 、SO32-、MnO4- , 取该溶液进行以下实验:
(1)、取PH试纸检验,溶液呈强酸性,可以排除 离子的存在。
(2)、取出部分溶液,加入少量CCl4及数滴新制氯水,经振荡后CCl4
层呈紫红色,可以排除 离子的存在。
(3)、另取出部分溶液逐渐加入NaOH溶液,使溶液从酸性逐渐变为碱性,在滴加过程中和滴加完毕后,溶液均无沉淀产生,则又可以排除
离子的存在。
(4)、取出部分上述碱性溶液加Na2CO3溶液后,有白色沉淀生成,证明
_______________ 离子存在,又可排除 __ 离子的存在。
(5)、将(3)得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
根据上述实验事实确定:该溶液中肯定存在的离子是
肯定不存在的离子是
还不能确定是否存在的离子是
六、(本题共17分)
30、Cu、Cu2O和CuO组成的混合物,加入100mL 0.6mol/L硝酸恰好使混合物溶解,同时收到224mLNO气体(标准状况下)。
(1)Cu2O与稀硝酸反应的化学方程式为
__________________________________________________
(2)产物中硝酸铜的物质的量为____________。
(3)如混合物中含0.01mol Cu,则其中Cu2O和CuO的物质的量各为多少?
31、现有铁、铜组成的合金,其中铁、铜的总物质的量为a摩尔,铜所占的物质的量分数为x;研成粉末后,全部投入含b摩尔溶质的硝酸中,微热使其充分反应,且硝酸的还原产物只有NO,试回答:
(1)用微粒符号填写下列空白
| ① | ② | ③ | ④ | ⑤ | ⑥ | |
| 残留固体成分 | ||||||
| 溶液中的金属离子 |
(2)当溶液中金属离子只有Fe2+、Cu2+时,则b的取值范围是(用a 、
x表示________________________________________________。
(3)当x=0.5时,溶液中Fe2+和Fe3+的物质的量相等时,在标准状况共产生672mL气体,求a、b的值
答案
| 1 D | 2 B | 3 C | 4 A | 5 B | |
| 6 C | 7 D | 8 B | 9 A | 10 A | 11 B |
| 12 C | 13 D | 14 B | 15 C | 16 B | 17 D |
| 18 AD | 19 CD | 20 A | 21 BC | 22 BD |
23、
24、(1)0.2摩尔/升·分(2)4(3)略(4)C
25、(1)略(2)CD(3)F- 、H3BO3
26、(!)氢气(2)略(3)钠离子和铝离子(4)浓硫酸或浓硝酸
27、(1)钠、氯、铝(2)略(3)焰色反应(4)氯化铝、共价
28、(1)①氯水与NaOH反应,![]() 浓度降低而褪色. ②氯水中产生HClO漂白酚酞
浓度降低而褪色. ②氯水中产生HClO漂白酚酞
(2)继续加入NaOH溶液红色再现则证明①正确,反之②正确
29、(1). CO32 -、S2- 、AlO2- 、SO32-
(2). Fe3+、NO3-、MnO4-
(3) . Mg2+、Al3+
(4) . Ba2+ ; SO42-
(5) .I- 、NH4+ 、Ba2+; Mg2+、Al3+ 、Fe3+、NO3-、CO32 -、S2- 、SO42- 、AlO2- 、SO32-、MnO4-; K+ 、Na+、Cl-
30、(1)略(2)0.025mol(3)0.005mol 0.005mol
31、(1)略(2)0.12mol