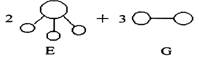高三化学第一学期期中考试试卷
考试时间为100分钟 满分为120分。
可能用到的相对原子质量:H:1 C: 12 O:16 Na: 23 S:32 Cl:35.5 K:39 Ca:40 Ba:137 I:127 Cu:64 Cr:52 N:14 As:75
第Ⅰ卷 (选择题 共54分)
一、选择题(本题包括10小题,每小题3分,共30分。每小题只有一个选项符合题意)
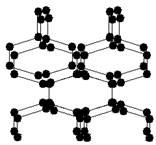 1.2004年7月德俄两国化学家共同宣布,在高压下氮气会发生聚合得到高聚氮,这种高聚氮的N-N键的键能为160kJ/mol(N2的键能为942kJ/mol),晶体片段结构如右图所示。又发现从N2可制取出N5、N3。含N5+离子的化合物及N60、N5极不稳定。则下列说法错误的是
1.2004年7月德俄两国化学家共同宣布,在高压下氮气会发生聚合得到高聚氮,这种高聚氮的N-N键的键能为160kJ/mol(N2的键能为942kJ/mol),晶体片段结构如右图所示。又发现从N2可制取出N5、N3。含N5+离子的化合物及N60、N5极不稳定。则下列说法错误的是
A、按键型分类,该晶体中含有非极性共价键
B、含N5+离子的化合物中既有离子键又有共价键
C、高聚氮与N2、N3、N5、N5+、N60互为同素异形体
D、这种固体的可能潜在应用是烈性炸药或高能材料
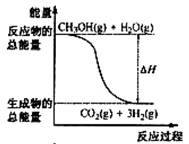 2.甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
2.甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g); △H= + 49.0 kJ·mol-1
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g);△H=-192.9 kJ·mol-1下列说法正确的是
A.CH3OH的燃烧热为192.9 kJ·mol-1
B.反应①中的能量变化如右图所示
C.CH3OH转变成H2的过程一定要吸收能量
D.根据②推知反应: CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g)的△H>-192.9kJ·mol-1
3.已知三角锥形分子E和直线形分子G反应,生成两种直线形分子L和M(组成E、G、L、M分子的元素原子序数均小于10)如下图,则下列判断错误的是
|
| ||||
A.G是最活泼的非金属单质 B.L是极性分子
C.E能使紫色石蕊试液变蓝色 D.M化学性质活泼
4.下列物质之间的转化符合“甲![]() 乙
乙![]() 丙
丙![]() 丁”的组合是
丁”的组合是
① Na→NaOH;② Cu→Cu(OH)2;③ S→H2SO3;④ CH3OH→HCOOCH3。
A.①③ B.②④ C.①②④ D.①③④
5.下列指定实验的装置图完全正确的是
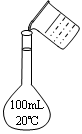
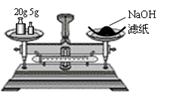
A.称量氢氧化钠固体 B.配制150mL0.10mol/L盐酸
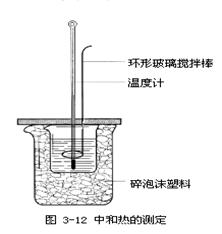
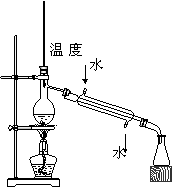 | |||
| | |||
C.测定中和热 D.分离苯和甲苯
6.在浓盐酸中H3AsO3与SnCl2反应的离子方程式为:3SnCl2+12Cl-+2H3AsO3+6H+=2As+3SnCl62-+6M。关于该反应的说法中正确的组合是
① 氧化剂是H3AsO3;② 还原性:Cl->As;③ 每生成7.5gAs,还原剂失去的电子为0.3 mol;④ M为OH-;⑤ SnCl62-是氧化产物。
A.①③⑤ B.①②④⑤
C.①②③④ D.只有①③
7.20世纪80年代后,人们发现和证实了碳的另一类单质,它们是由一系列偶数个碳原子组成的分子,其中C60(足球烯,分子中含有30个双键)最具代表性。下图所示为n个C60连接而成的物质X。下列有关说法不正确的是
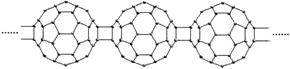
A.X难溶于水 B.一定条件下X可与H2发生加成反应
C.X是碳的一种同素异形体 D.X的摩尔质量为720n
8.请你运用所学的化学知识判断,下列有关化学观念的叙述错误的是
A 几千万年前地球上一条恐龙体内的某个原子可能在你的身体里
B 用斧头将木块一劈为二,在这个过程中个别原子恰好分成更小微粒
C 一定条件下,金属钠可以成为绝缘体
D 一定条件下,水在20℃时能凝固成固体
9.下列无色澄清的溶液中,可能大量共存的离子组是
A.[Ag(NH3)2]+、K+、OH-、NO3- B.Fe3+、NH4+、Cl-、I-
C.H+、Al3+、SO42-、F- D.ClO-、Na+、AlO2-、S2-
10.下列反应最终无沉淀产生的是
① 过量的CO2通入Na2SiO3溶液中 ② 向AgNO3溶液中滴加稀氨水至过量
③ 少量的SO2通入BaCl2溶液中 ④ 向MgCl2溶液中滴加NaOH溶液至过量
A.①② B.②④ C.②③ D.①④
二、选择题(本题包括8小题,每小题3分,共24分。每小题有一个或两个选项符合题意)
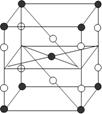 11、F2和Xe在一定条件下可生成XeF2、XeF4和XeF6三种氟化氙,它们都是极强的氧化剂(其氧化性依次递增),都极易水解,其中:
11、F2和Xe在一定条件下可生成XeF2、XeF4和XeF6三种氟化氙,它们都是极强的氧化剂(其氧化性依次递增),都极易水解,其中:
6XeF4+12H2O==2XeO3+4Xe↑ +24HF+3O2↑ 下列推测正确的是
A、XeF2分子中各原子均达到八电子结构
B、某种氟化氙的晶体结构单元如右图,可推知其化学式为XeF6
C、XeF4按已知方式水解,每生成4molXe,转移16mol电子
D、XeF2加入水中,在水分子作用下将重新生成Xe和F2
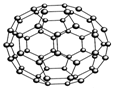 12 设NA表示阿伏加德罗常数,下列说法正确的是
12 设NA表示阿伏加德罗常数,下列说法正确的是
A. 在含有NA个CH3COO-的醋酸溶液中, H+ 数目略大于NA
B. N60结构如右图,28gN60单质中含有的N-N键个数为NA
C. 2.9g 熟石膏(2 CaSO4·H2O)含有的结晶水分子数为0.02NA
D. 在标准状况下,2.24L的CCl4中含有C—Cl键的数目约为0.4NA
13、两种短周期元素组成的化合物中原子数比为1:3,若两种元素的原子序数分别是a和b,则a和b的关系可能是① a=b+5 ② a+b=8 ③ a+b=30 ④ a=b+8
A、①②③④ B、②③④ C、②③ D、③④
14.下列离子方程式正确的是
A.碳酸氢钠溶液与足量氢氧化钡溶液混合:HCO3-+Ba2++OH-→BaCO3↓+H2O
B.亚硫酸氢铵和氢氧化钠的反应:NH4++OH-=NH3↑+H2O
C.足量的溴化亚铁和少量的氯气反应:2Fe2++4Br-+3Cl2=3Fe3++2Br2+6Cl-
D.碳酸氢镁溶液中加入足量的澄清石灰水:
Mg2++2HCO3-+2Ca2++4OH-=Mg(OH)2↓+2CaCO3↓+2H2O
15.已知反应![]() 能完全进行,则下列推断中,正确的是
能完全进行,则下列推断中,正确的是
A. ![]() 溶液的pH<7,将其蒸干并灼烧后,得到的残留物可能为BeO
溶液的pH<7,将其蒸干并灼烧后,得到的残留物可能为BeO
B. ![]() 溶液的pH>7,将其蒸干并灼烧后,得到的残留物可能为BeO
溶液的pH>7,将其蒸干并灼烧后,得到的残留物可能为BeO
C. ![]() 既能溶于盐酸又能溶于烧碱溶液
既能溶于盐酸又能溶于烧碱溶液
D. ![]() 水溶液的导电性强,因此
水溶液的导电性强,因此![]() 一定是离子化合物
一定是离子化合物
16.类推是化学学习和研究中常用的思维方法。下列类推正确的是
A.Mg可由电解熔融MgCl2制取,Al也可由电解熔融AlCl3制取
B.金属Na着火不能用干冰灭火,金属K着火也不能用干冰灭火
C.SO2能使品红溶液褪色,CO2也能使品红溶液褪色
D.F2、Cl2、Br2、I2的熔点依次升高,N2、P4、As、Sb、Bi的熔点也依次升高
17.两种硫酸盐按一定比例混合后共熔,可制得化合物X,X溶于水能电离出K+、Cr3+、SO42-,若将2.83 g X中的Cr3+全部氧化为Cr2O72-后,溶液中的Cr2O72-可和过量KI溶液反应,得到3.81gI2,反应的离子方程式为:Cr2O72-+6I-+14H+=2 Cr3++3I2+7H2O 。若向溶有2.83 gX的溶液中,加入过量的BaCl2溶液,可得到4.66 g白色沉淀.由此可推断出X的化学式为
A.![]() B.
B.![]()
C.![]() D.
D.![]()
18.将一定体积的CO2通入V L NaOH溶液中,已知NaOH完全反应,若在反应后的溶液中加入足量石灰水,得到Ag沉淀;若在反应后的溶液中加入足量CaCl2溶液,得到Bg沉淀,则下列说法正确的是
A.标准状况下,参加反应的CO2体积为0.224AL
B.用上述数据不能确定NaOH溶液的物质的量浓度
C.若A=B,则CO2与NaOH溶液反应的产物只有Na2CO3
D.B可能等于A、小于A或大于A
第Ⅱ卷 (非选择题 共66分)
19.(12分)某校化学研究性学习小组的同学在学习了金属的知识后,为了解Cu的常见化合物性质,运用类比学习的思想提出如下的问题,进行探究。请你协助该小组的同学完成下列研究。
【提出问题】
① Cu的金属活泼性小于Al,Al(OH)3具有两性,Cu(OH)2也具有两性吗?
② 通常情况下,+2价Fe的稳定性小于+3价Fe,+1价Cu的稳定性也小于+2价Cu吗?
③ CuO能被H2、CO等还原,也能被NH3还原吗?
【实验方案】
⑴ 解决问题①需用到的药品有CuSO4溶液、 (填试剂),同时进行进行相关实验。
⑵ 解决问题②的实验步骤和现象如下:取98gCu(OH)2固体,加热至80℃~100℃时,得到黑色固体粉末,继续加热到1000℃以上,黑色粉末全部变成红色粉末A。冷却后称量,A的质量为72g。向A中加入适量的稀硫酸,得到蓝色溶液,同时观察到容器中还有红色固体存在。据此可推得,A的化学式为 。
⑶ 为解决问题③,设计的实验装置为(夹持及尾气处理装置装置未画出):
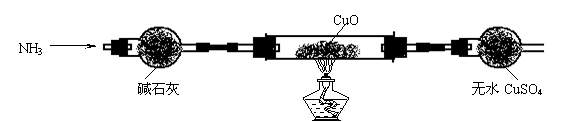
实验中观察到CuO变为红色物质,无水CuSO4变蓝色。同时生成一种无污染的气体。
【实验结论】
⑴Cu(OH)2具有两性。证明Cu(OH)2具有两性的实验现象
是 。
⑵ 根据“实验方案⑵”,得出的+1价Cu和+2价Cu稳定性大小的结论
是 ; 。
⑶ CuO能被NH3还原。该反应的化学方程式为 。
【问题讨论】
⑴ 有同学认为NH3与CuO反应中生成的红色物质是Cu,也有同学认为NH3与CuO反应中生成的红色物质是Cu和A的混合物。请你设计一个简单的实验检验NH3与CuO反应中生成的红色物质中是否含有A 。
20(7分)现有部分短周期元素的性质或原子结构如下表:
| 元素编号 | 元素性质或原子结构 |
| T | M层上有2对成对电子 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
(1)元素T的原子最外层共有 种不同运动状态的电子。元素T的外围轨道表示式为 。
(2)元素Y与氢元素形成一种离子YH4+ ,写出该微粒的电子式 (用元素符号表示)
(3)元素Z与元素T相比,非金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是___________。
a.常温下Z的单质和T的单质状态不同 b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
 (4)探寻物质的性质差异性是学习的重要方法之一。T、X、Y、Z四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种酸的是
,理由是
。
(4)探寻物质的性质差异性是学习的重要方法之一。T、X、Y、Z四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种酸的是
,理由是
。
21、(12分)碳是形成化合物最多的元素,其单质与化合物广布于自然界。
⑴ 碳原子的核外电子排布式为 。与碳同周期的非金属元素N的第一电离能大于O的第一电离能,原因是 ;
⑵ CS2是一种重要的有机溶剂,CS2分子的空间构型为 ;写出一种与CS2互为等电子体的物质的化学式 ;
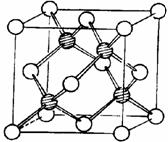
⑶ 冰晶胞中水分子的空间排列方式与金刚石晶胞(其晶胞结构如右图,
其中空心球所示原子位于立方体的顶点或面心,实心球所示原子位于立
方体内)类似。每个冰晶胞平均占有 个水分子,冰晶胞与金刚
石晶胞微粒排列方式相同的原因是 。
22. (10分)已知甲和I、L、M均为常见的单质,I在常温下为气体,L、M为金属;气体K的水溶液显碱性;A是由前20号元素组成的阴阳离子个数比为1:1的离子化合物,且阴离子含有14个电子;乙是一种红棕色的粉未,G为白色胶状沉淀,D在常温下是无色液体,C的溶液常用于在实验室检验E。各物质之间的转化关系如下图所示(部分物质在图中没有列出)。
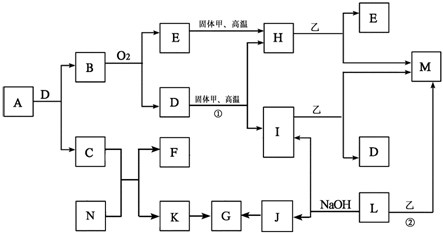
请根据要求填空:
(1)A的化学式 ,E的电子式 。
(2)反应 ① 的化学方程式 。
(3) 反应 ② 的化学方程式 。
(4) J→G的离子方程式 。
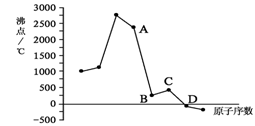 23、(8分)某同一短周期元素的常见单质的 沸点数据如右图所示。据此回答下列问题:
23、(8分)某同一短周期元素的常见单质的 沸点数据如右图所示。据此回答下列问题:
⑴单质D的分子式为 。与元素C
同主族的元素N和氢能构成18e-的分子,
其化学式为 。
⑵短周期元素M与元素A同主族,M的
最简单氢化物(R)1g完全燃烧生成液态水时,放出55.65 kJ的热量,则R的燃烧热为 kJ/mol,该反应的热化学方程式为 。
24、(8分)⑴甲酸在浓硫酸作用下脱水可制得CO,碳酸可分解为H2O和CO2,目前已有文献报道,碳还能形成其他一些氧化物,如:丙二酸在减压下用P4O10于140℃脱水可制得C3O2,它的熔点—120℃,沸点6.7℃,室温下聚合成黄色液体。
根据以上信息可推知:C3O2的结构简式为 ,C3O2是 分子(填“极性”或“非极性”)
②苯六甲酸(即苯分子中每个氢原子被羧基取代生成的物质)完全脱水后的产物也是一种碳的氧化物,它的结构式为: 。
⑵①第四周期元素电子排布的能级能量由低到高依次为4s、3d、4p,第六周期元素电子排布的能级能量由低到高依次为: 。
②若某元素价电子为3d74s2,则该元素位于元素周期表的第 周期, 族,原子序数为 ,其原子的核外电子中成单电子有 个。
25.(9分)3.2g Cu与过量硝酸(a mol·L-1,30mL)充分反应。硝酸的还原产物只有NO2、NO。反应后溶液中含H+为0.1mol。
(1)此时溶液中所含NO3-为 mol。
(2)求生成的气体中NO2和NO的物质的量(用含有a的式子表示)。
(3)用NaOH溶液吸收产生的气体,原理为:2NO2+2NaOH==NaNO3+NaNO2+H2O,
NO2+NO+2NaOH==2NaNO2+H2O。
若生成的混合气体能被NaOH完全吸收,试讨论a的取值范围。
 高三化学答案卷
高三化学答案卷
一、选择题(本题包括10小题,每小题3分,共30分。每小题只有一个选项符合题意)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
二、选择题(本题包括8小题,每小题4分,共32分。每小题有一个或两个选项符合题意)
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 |
|
|
|
|
|
|
|
|
三、19【实验方案】
⑴ ______________________ 。
⑵ A的化学式为 。
【实验结论】
⑴_______________________________ 。
⑵ ______________________________________________ ;
_________________________________________________ 。
⑶ 化学方程式为 。
【问题讨论】
⑴ ________________ ________ _____________________________________
________________________ ;
20、(1) 种 , 。
(2)
(3) , ___________。
(4) ,理由是 _______________ 。
21、⑴ 。 ;
⑵ ; ;
⑶ , 。
22. (1)A的化学式 ,E的电子式 。
(2)反应 ① 的化学方程式 。
(3) 反应 ② 的化学方程式 。
(4) J→G的离子方程式 。
23、
⑴ 。 。
⑵ kJ/mol,
该反应的热化学方程式为 。
24、⑴① C3O2的结构简式为 ,C3O2是 分子
② 它的结构式为: 。
⑵① 。
②第 周期, 族,原子序数为 ,
其原子的核外电子中成单电子有 个。
25.
⑴ mol;
⑵
⑶
高三化学参考答案及评分标准
一、选择题(本题包括10小题,每小题3分,共30分。每小题只有一个选项符合题意)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | C | D | D | A | C | A | D | B | A | C |
二、选择题(本题包括8小题,每小题4分,共32分。每小题有一个或两个选项符合题意)
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | C | A | A | AD | AC | B | C | AC |
19.(12分)【实验方案】⑴ HCl溶液、NaOH溶液 ⑵ Cu2O
【实验结论】
⑴ Cu(OH)2既能溶于盐酸,又能溶于NaOH溶液
⑵ 在高于1000℃时,+1价Cu比+2价Cu稳定;在溶液中+2价Cu比+1价Cu稳定(各1分)
⑶ 3CuO+2NH3![]() 3Cu+N2+3H2O
3Cu+N2+3H2O
【问题讨论】
⑴ 取NH3与CuO反应中生成的红色物质少许,加入稀H2SO4,若溶液出现蓝色,说明红色物质中含有A,反之则无
(本题共12分,除标注为1分的外,
20、(7分)(1)6; 。 (2) 。
(3)Cl; b。 (4)H2CO3; 弱酸性或非氧化性酸(合理即给分)。
21.12分
⑴ 1s22s22p2 N原子2p轨道半充满,能量低
⑵ 直线形 CO2
⑶ 8 氢键具有方向性,每个水分子与相邻的4个水分子形成氢键
22. (10分)⑴ CaC2 ![]()
![]()
⑵![]() ⑶
⑶![]()
⑷ CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-(其它合理答案均可)
23. (8分)⑴ Cl2 H2O2
⑵ 890.4 CH4(g)+2O2(g)=CO2(g)+2H2O(l);ΔH=-890.4 kJ/mol
24、(8分)
⑴①O=C=C=C=O(1分),非极性(1分)
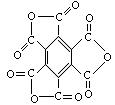
②(1分)
⑵①6s4f5d6p(1分)
②四(1分),Ⅷ(1分),27(1分),3(1分)
25.(共9分)
(1)利用溶液中电荷守恒:n(NO3-)×1=n(Cu2+)×2+n(H+)×1,
所以:n(NO3-)=0.2
(2)设生成气体中NO2、NO的物质的量分别为X、Y
由得失电子守恒: X+3Y=0.1mol
由“N”元素守恒: X+Y=(0.03a-0.2)mol
X=(0.045a-0.35) mol ; Y=(0.15-0.015a)mol 。
(3)根据题给信息,完全吸收的条件是n(NO2)≥n(NO)时,才可能被完全吸收。
所以,首先是要保证产生NO、NO2,则列式为①②式:
X>0得:a> 7.8 ①
Y>0得:a<10 ②
再由必须完全吸收的条件列③式:
X≥Y得:a≥8.3 ③
所以,三式联立解不等式组,得到a的取值范围为:8.3≤a<10