高三化学九月月考试题
学号 姓名 成绩
第一卷 选择题 共72分
一、单项选择题 (每小题只有1个正确选项,4分×8=32分)
1、一定条件下,可逆反应C(s) + CO2(g)![]() 2CO(g);△H>0,达到平衡状态,现进行如下操作:①升高反应体系的温度; ②增加反应物C的用量; ③缩小反应体系的体积; ④减少体系中CO的量。上述措施中一定能使反应的正反应速率显著加快的是
2CO(g);△H>0,达到平衡状态,现进行如下操作:①升高反应体系的温度; ②增加反应物C的用量; ③缩小反应体系的体积; ④减少体系中CO的量。上述措施中一定能使反应的正反应速率显著加快的是
A、①②③④ B、①③ C、①② D、①③④
2、用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得溶液中加入一定量下列物质,溶液恰好恢复到电解前状态。则该物质为
A.CuSO4 B.Cu(OH)2 C.CuO D.Cu
3、在蒸发皿中加热蒸干并灼热(低于400℃)下列物质的溶液,可以得到该物质固体的是
A、氯化铝 B、高锰酸钾 C、碳酸镁 D、碳酸钠
4、25℃时,pH为9的Na2CO3溶液和pH为5的FeCl3溶液中,水的电离程度的大小关系是
A.两者相等 B.前者大 C.后者大 D.无法确定
5、物质的量浓度均为0.01mol·L-1的HA和MOH溶液,pH分别为3和12,将两溶液等体积混合后,所得溶液的pH为
A.≥7 B.一定>7 C.≤7 D.可能=7
6、下列说法或表示法正确的是
A、等量的硫蒸气和硫固体分别完全燃烧,前者放出热量多
B、由C(石墨)→C(金刚石):ΔH = +119 kJ· mol—1可知,金刚石比石墨稳定
C、在稀溶液中:H++OH-===H2O;ΔH = -57.3 kJ· mol—1,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量等于57.3 kJ
D、在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)===2H2O(l);ΔH=+285.8 kJ· mol—1
7、纳米材料的表面微粒数占微粒总数的比例极大,这是它有许多特殊性质的
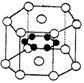 原因,假设某纳米颗粒中粒子分布类似于硼镁化合物,其结构如图所示,
原因,假设某纳米颗粒中粒子分布类似于硼镁化合物,其结构如图所示,
则这种纳米颗粒的分子式为
A、MgB B、Mg3B6 C、Mg5B12 D、Mg14B6
( 镁原子○位于顶点和上下两个面心,硼原子●位于内部 )
8.在高压下氮气会聚合生成高聚氮,这种高聚氮的晶体中每个氮原子都通过三个单键与其它氮原子结合并向空间发展构成立体网状结构。已知晶体中N-N键的键能为160 kJ·mol-1,而N≡N的键能为942 kJ·mol-1。则下列有关说法不正确的是
A.键能越大说明化学键越牢固,所构成物质越稳定 B.高聚氮晶体属于原子晶体
C.高聚氮晶体中n(N)∶n(N-N)=1∶3 D.用作炸药可能是高聚氮潜在的应用
二、不定项选择题 (每小题只有1~2个正确选项,4分×10=40分)
9.若某装置中发生如下反应:Cu+2H+=Cu2++H2↑,关于该装置的有关说法不正确的是 A、该装置一定为原电池 B、该装置一定为电解池
C、金属铜为电解池的阳极 D、电解质溶液可能是硫酸溶液
10. 恒温恒压下,在容积可变的器皿中,反应2NO2(g)![]() N2O4(g)达到平衡后,再向容器内通入一定量NO2,又达到平衡时,N2O4的体积分数
N2O4(g)达到平衡后,再向容器内通入一定量NO2,又达到平衡时,N2O4的体积分数
![]()
 A. 减少 B. 不变 C. 增大
D. 无法判断
A. 减少 B. 不变 C. 增大
D. 无法判断
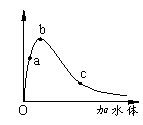
11.一定温度下,将一定质量的冰醋酸加水稀释过程中,
溶液的导电能力变化如右图所示,下列说法正确的是
A.a、b、c三点溶液的pH:c<a<b
B.a、b、c三点醋酸的电离程度:a<b<c
C.用湿润的pH试纸测量a处溶液的pH,测量结果偏小
D.a、b、c三点溶液用1mol/L氢氧化钠溶液中和,消耗氢氧化钠溶液体积:c<a<b
12、常温下,将pH=5的硫酸溶液稀释500倍,则稀释后溶液中C(SO42—)与C(H+)之比约为
A、1:1 B、1:2 C、1:10 D、10:1
13.臭氧分子的结构与SO2(极性分子)相似,可读做二氧化氧,在臭氧层中含量达0.2 ppm(ppm表示百万分之一)。臭氧是氧气吸收了太阳的波长小于242 nm的紫外线形成的,不过当波长在220 nm~320 nm的紫外线照射臭氧时,又会使其分解。下列说法中正确的是
A.打雷时也能产生臭氧,臭氧分子是直线型分子
B.臭氧转化为氧气和氧气转化为臭氧均须吸收能量
C.臭氧和氧气的相互转化能保持大气中臭氧的含量基本稳定
D.向大气中排放氮的氧化物和氟氯代烃均能加快臭氧的分解
14. 下列说法中,不正确的是
A. 室温下,CH3COOH分子可能存在于pH=8的碱性溶液中
B. 在0.1mol·L-1的氢溴酸中加入适量的蒸馏水,溶液的c(H+)减少
C. 在c(H+)=c(OH-)的溶液中,AlO2-不可能大量存在
D. 由水电离出的c(OH-)=1×10-12mol·L-1的溶液中,Al3+不可能大量存在
15.A、B、C为三种短周期元素,A、B在同周期, A、C的最低价离子分别为A2-和C-,B2+和C-具有相同的电子层结构。下列说法中正确的是
A.原子序数:A>B>C B.原子半径:A>B>C
C.离子半径:A2->C->B2+ D.原子核外最外层电子数:A>C>B
16、镓是1871年俄国化学家门捷列夫在编制元素周期表时曾预言的“类铝”元素。镓的原子序数为31,属IIIA族。镓的熔点为29.78℃,沸点高达2403℃。镓有过冷现象(即冷至熔点下不凝固),它可过冷到-120℃。由此判断下列有关镓的性质及其用途的叙述不正确的是
A、镓是制造高温温度计的上佳材料 B、 镓能溶于强酸和强碱中
C、镓与锌、锡、铟等金属制成的合金,可用在自动救火的水龙头中
D、 近年来镓成为电子工业的新宠,其主要用途是制造半导体材料,被誉为“半导体材料的新粮食”,这是利用了镓的导电性介于导体和绝缘体之间的性质
17、两个硫酸分子可以脱去一分子水生成焦硫酸(H2S2O7)。已知硫酸的分子中有4个硫氧键,则焦硫酸分子中硫氧键的数目是
A、 4 B、 6 C 、 7 D、 8
18、下列溶液,不一定呈中性的是
A.C(H+)=1×10— 7mol·L-1的溶液 B.pH=14—pOH的溶液
C.C(H+)=C(OH—)=1×10—6mol·L-1的溶液 D.pH= pOH的溶液
将选择题答案填入下表:
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | |||||||||
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 |
三、填空题 (本题包括3个小题,共16分)
19.(4分)有两个起始体积相同的密闭容器A和B,A容器中有一个可自由移动的活塞,能使该容器内始终保持恒压,B容器为固定体积的容器。起始时向这两个容器内分别充入等量的体积比为2 :1的SO2和O2的混合气体,并使A、B两容器的体积相等。在保持400℃的合成条件下,使如下反应:2SO2+O2![]() 2SO3达到平衡。请回答:
2SO3达到平衡。请回答:
(1)达到平衡所用的时间A容器比B容器 ,两容器中SO2的转化率A比B ___ 。
(2)达到(1)所述的平衡后,若向两容器内通入等量的原反应混合气,则重新达到平衡后,A容器中SO3的百分含量 ;B容器中SO3的百分含量 (增大、减小、不变)。
20、(12分)一定温度下,发生反应:N2(g)+3H2(g)![]() 2NH3(g)△H<0
2NH3(g)△H<0
(1)若在相同温度下,1mol N2和3mol H2 分别在恒压密闭容器A中和恒容密闭容器B中反应,开始时A、B的体积相同。则 容器中先达到平衡; 容器中的N2的转化率高
(2)当A中已达到平衡时,再加入1摩Ar,则N2的转化率 ;正反应速率会
(3)若B中反应达到平衡时,平衡混和物中N2、H2、NH3的物质的量分别为a、b、c摩。仍维持原温度,用x、y、z分别表示开始时N2、H2、NH3的加入量(mol),使达到平衡后N2、H2、NH3的物质的量也为a、b、c摩。则应满足的条件是:
①若x=0,y=0,则z=
②若x=0.75,则y应为 mol、z应为 mol。
③x、y、z应满足的一般条件是
四、实验题 (本题包括2个小题,共27分)
21、(12分)设计证明CH3COOH为弱酸的实验方案。(可不填满,若不够时可自行添加)
| 序号 | 实验原理 | 实验操作 | 实验结论 |
| 方 案 1 | |||
| 方 案 2 | |||
| 方 案 3 | |||
| 方 案 4 |
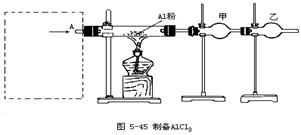 22、(15分)无水氯化铝是白色晶体,易吸收水分,在178℃升华,装有无水氯化铝试剂瓶久置潮湿空气中,会自动爆炸产生大量白雾,氯化铝常作为有机合成和石油工业的催化剂等。
22、(15分)无水氯化铝是白色晶体,易吸收水分,在178℃升华,装有无水氯化铝试剂瓶久置潮湿空气中,会自动爆炸产生大量白雾,氯化铝常作为有机合成和石油工业的催化剂等。
图5-45是实验室制取少量无水氯化铝装置的一部分,在方框中安装某些仪器,便是该装置的另一部分,从A口通入某种气体,即可制取无水氯化铝。现提供的试剂除装置中已有的铝粉和碱石灰外,还有NaCl固体、MnO2、浓H2SO4和水,而提供的安装方框中装置的仪器不限,用上述方法制取无水氯化铝,请回答下列问题:
(1)利用上述条件,可制取的气体有(填化学式) ____ __;
(2)若要安全、顺利地制取无水氯化铝,通入A口的气体应是 ______;
(3)用中学化学实验室常用的方法制取通入A口的气体的反应方程式是___ ___
(4)用(3)的方法制得的气体中可能还含有的气体有 ___ ___,通入A口前是否有必要除去,不必除去或必须除去的原因是____ __;
(5)按(3)的方法安装方框图中的装置,所需要的玻璃仪器(同一种仪器,数量在2件或2件以上的要写明件数)有_____ _;
(6)装置图中甲、乙两支干燥管中需要填充碱石灰的是(填甲或乙或甲、乙)______,甲的作用是____ __,乙的作用是___ ___。
五、推断题 (本题包括2个小题,共20分)
23、(12分)同周期中A、B、C、D、E、F为原子序数依次增大的短周期元素。已知A、C、F三种原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水。请回答下列问题:
(1)根据以上条件判断出符合题意的元素,请写出相应的元素名称:
A________、B_______、C______、D_______、E_______、F______。
⑵画出B的原子结构示意图:________ ___。(3)写出C单质与A的最高价氧化物的水化物的水溶液反应的离子方程式:
(4)若1 mol F单质与C的单质恰好完全反应,则等物质的量的C的最高价氧化物与A的最高价氧化物的水化物反应,消耗_________ mol A的最高价氧化物的水化物。
24、(8分)根据下表数据,请回答下列问题:
| 化学键 | Si—O | Si—Cl | H—H | H—Cl | Si—Si | Si—C |
| 键能/ KJ·mol—1 | 460 | 360 | 436 | 431 | 176 | 347 |
⑴ 比较下列两组物质的熔点高低 (填>或<= SiC______ Si; SiCl4 ______ SiO2
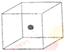 ⑵ 右图立方体中心的“●”表示硅晶体中的一个原子,
⑵ 右图立方体中心的“●”表示硅晶体中的一个原子,
请在立方体的顶点用“●”表示出与之紧邻的硅原子。
⑶ 工业上高纯硅可通过下列反应制取:
SiCl4 (g) + 2H2(g) ![]() Si(s) +
4HCl(g) 该反应的反应热△H = _________ KJ/mol
Si(s) +
4HCl(g) 该反应的反应热△H = _________ KJ/mol
六、计算题 (本题包括1个小题,共10分)
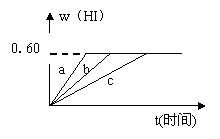 25、将1 mol I2(g)和2 mol H2置于某2 L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)
25、将1 mol I2(g)和2 mol H2置于某2 L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)![]() 2HI(g);ΔH>0,并达平衡。
2HI(g);ΔH>0,并达平衡。
HI的体积分数w(HI)随时间变化如图曲线b所示:
(1)达平衡时,I2(g)的物质的量浓度为___________。
(2)若改变反应条件,
在甲条件下,w(HI)的变化如图曲线a所示,
在乙条件下,w(HI)的变化如图曲线c所示。
则甲条件可能是__________;乙条件可能是___________。(填入下列序号)
①恒容条件下,升高温度 ②恒容条件下,降低温度 ③恒温条件下,缩小反应容器体积 ④恒温条件下,扩大反应容器体积 ⑤恒温恒容条件下,加入适当催化剂
(3)若保持温度不变,在另一相同的2 L密闭容器中加入a mol I2(g)、b mol H2和c mol HI(a、b、c均大于0),发生反应,达平衡时,HI的体积分数仍为0.60,则a、b、c的关系是________ ___。
参考答案
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | B | C | D | A | B | A | D | C | A |
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | B | B | C | CD | D | AC | C | D | AB |
19、短;大;不变;增大。
20.A;A;减小;减小;2mol;2.25;0.5;x+0.5z=1和y+3/2z=3。
21略
22.(1)Cl2,HCl,H2,O2 (2)Cl2
(3)4NaCl+MnO2+4H2SO4(浓) ![]() MnCl2+4NaHSO4+Cl2↑+2H2O,
MnCl2+4NaHSO4+Cl2↑+2H2O,
或:4NaCl+MnO2+2H2SO4(浓) ![]() MnCl2+2Na2SO4+Cl2↑+2H2O,
MnCl2+2Na2SO4+Cl2↑+2H2O,
或:NaCl+H2SO4(浓) ![]() NaHSO4+HCl↑
NaHSO4+HCl↑
![]()
MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
或:2NaCl+MnO2+3H2SO4(浓) ![]() MnSO4+2NaHSO4+Cl2↑+2H2O
MnSO4+2NaHSO4+Cl2↑+2H2O
(4)HCl,H2O(气)必须除去,因为HCl和H2O(气)进入反应器,与Al反应产生H2,H2与Cl2混合会发生爆炸反应;而无水AlCl3遇H2O会发生水解反应。
(5)分液漏斗、圆底烧瓶(或烧瓶、蒸馏烧瓶)、广口瓶、酒精灯、玻璃导管(数支)
(6)乙,收集无水AlCl3,吸收未反应的Cl2,防止空气中的水蒸气进入甲
23.钠、镁、铝、硅、硫、氯;2Al+2OH-+2H2O=2AlO2-+3H2 ;4/3。
24.>;<;图略;+236。
25.答案:(1)0.05 mol·L-1(1分)
(2)③⑤(1分) ④(1分)
(3)4a+c=2b(2分)