高三化学十月份教学质量检测试题
化 学 试 题
本试卷分第一卷和第二卷两部分,共150分。考试时间120分钟。
可能用到的相对原子量:H 1 He 4 C 12 O 16 Na23 S 32 Ag 108 Ba 137
第一卷(选择题,共72分)
一、选择题(本题包括8小题,每题4分共32分。每小题只有一个选项符合题意。)
1、2006年8月12日,成功登陆“土卫六”的“惠更斯”号探测器发回了大量照片和数据。数据分
析表明,土卫六“酷似地球经常下雨”,不过“雨”的成份是液态甲烷。下列关于土卫六的说法中,
不正确的是
A.“土卫六”的地表温度极高
B.“土卫六”上存在有机分子
C.该卫星的地貌形成与液态甲烷冲刷有关
D.该卫星上可能形成了甲烷的气液循环系统
 2、如右图所示,U型管中装入含有紫色石蕊的
2、如右图所示,U型管中装入含有紫色石蕊的![]()
试液,通直流电,一段时间后U型管内会形成一个倒立的
三色“彩虹”,它从左到右颜色的次序是:
A.蓝、紫、红 B.红、蓝、紫
C.红、紫、蓝 D.蓝、红、紫
3、某些不合格的建筑装饰材料,会缓慢释放出浓度过高、影响人们身体健康的气体,在这些气体中最常见的是:
A.二氧化氮 B.甲醛和甲苯等有机物蒸气
C.一氧化碳 D.二氧化硫
4、下列氧化还原反应中,水作氧化剂的是:
A.2Na2O2+2H2O=4NaOH+O2↑ B.2F2+2H2O=4HF+O2
C.CO+H2O=CO2+H2 D.3NO2+H2O=2HNO3+NO
5、用特殊方法把固体物质加工到纳米级(1~100nm。1nm=10-9m)的超细粉末粒子,然后制得纳米材料。下列分散系中的分散质的微粒直径与这种粒子具有相同数量级的是
A.胶体 B.悬浊液
C.溶液 D.乳浊液
6、下列变化过程属化学变化的是
A.![]() C+
C+![]() H→
H→![]() N+γ B.石墨
N+γ B.石墨![]() 金刚石
金刚石
C.原油![]() 汽油+…… D.碘的升华
汽油+…… D.碘的升华
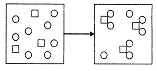 7、物质X(□)和物质Y(〇)的反应如下图所示,对该反应的描述,下列反应方程式正确的是
7、物质X(□)和物质Y(〇)的反应如下图所示,对该反应的描述,下列反应方程式正确的是
A.3X+8Y=X3Y8 B.3X十8Y=3XY2十2Y
C.3X+6Y=X3Y6 D.X+2Y=XY2
8、下列各组液体混合物,能用分液漏斗分离的是
A.CCl4和水 B.溴苯和溴
C.苯和硝基苯 D.乙醇和水
二、选择题(本题包括10小题,每题4分共40分。每小题有1~2个选项符合题意。)
9、设NA为阿伏加德罗常数,下列说法不正确的是:
A.0.1molNa2CO3固体中,含Na+0.2 NA个,CO32-0.1 NA个
B.足量Na2O2和11.2LCO2反应,转移电子数目为NA
C.含1mol碳原子的金刚石中,C-C共价键数为3NA个
D.1Llmol·L-1的醋酸钠溶液中含CH3COOH、CH3COO-共NA个
10、下列实验中,最后得到透明溶液的是:
A.将金属钾投入硫酸铜溶液中
B.将少量钠投入NaHCO3溶液中
C.将CaO2粉末投入到氯化镁溶液中
D.往少量的澄清石灰水中通入过量CO2
11、在由水电离产生的c(H+)=10-12 mol/L的溶液中,一定能大量共存的离子组是:
A.Cl-、SO42-、Na+、K+ B.NH4+、Mg2+、Cl-、HCO3-
C.SO42-、NO3-、Fe2+、Ba2+ D.Na+、K+、ClO-、I-
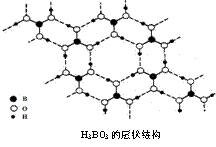 12、正硼酸(H3BO3)是一种片层状结构白色晶体,层内的H3BO3分子通过氢键相连(如下图)。
12、正硼酸(H3BO3)是一种片层状结构白色晶体,层内的H3BO3分子通过氢键相连(如下图)。
下列有关说法正确的是:
A.正硼酸晶体属于原子晶体
B.H3BO3分子的稳定性与氢键有关
C.分子中硼原子最外层为8e-稳定结构
D.含1molH3BO3的晶体中有3mol氢键
13、现有两种不含结晶水的盐,它们在不同温度下的溶解度分别是:
20℃ 50℃
A的溶解度 35.7g 46.4g
B的溶解度 31.6g 108g
下列说法中正确的是:
A.提纯A物质最好可采用重结晶的方法
B.若把108gB的饱和溶液从50℃降到20℃,析出的B是76.4g
C.提纯B物质最好可采用重结晶的方法
D.两种盐在某一温度下可能具有相同的溶解度
14、往含0.2mol NaOH和0.1mol Ca(OH)2的溶液中持续稳定地通入CO2气体,当通入气体的体积为6.72L
(标准状况)时立即停止,则在这一过程中,溶液中离子数目和通入CO2气体的体积关系图象正确的
是(气体的溶解忽略不计):
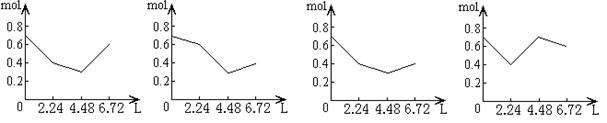 A.
B.
C.
D.
A.
B.
C.
D.
15、充分燃烧某液态芳香烃X,并收集产生的全部水,恢复到室温时,若得到水的质量跟原芳香烃X的质量相等,则X的分子式是:
A.C10H16 B.C12H18
C.C11H14 D.C13H20
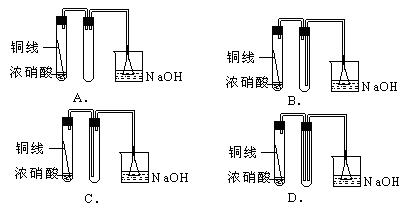
16、下列装置中间的试管收集浓硝酸和铜反应所生成的气体,则最终可使收到的气体中空气的含量最少是:(C)
17、将amol氢气和bmol乙烯混合,在一定条件下使它们部分反应生成cmol乙烷,将反应后的混合气体完全燃烧,消耗氧气的物质的量为:
A.(3b+0.5a)mol B.(4b+0.5a)mol
C.(3b+1.5a)mol D.无法判断
18、在标准状况下,将CO2和CO混合气体(密度为10/7g·L-1)充满一盛有足量Na2O2的密
闭容器中(容积为22.4L,固体体积忽略不计),用间断的点火花引发至充分反应,下列
对反应完全后容器里残留物的叙述正确的是:
A.有0.125molO2
B.有1molNa2CO3
C.有0. 5moCO
D.有0.25molNa2CO3
化 学 答 题 卷
请将第一卷选择题的正确答案填写在下列表格中:(共72分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| A | C | B | C | A | B | D | A | BC |
| 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| BD | A | D | CD | C | B | C | A | AB |
第二卷(非选择题,共78分)
三、(本题共16分)
19、(1)有下列操作,其中设计和推理均正确的是 BC (选错倒扣分)。
A、用托盘天平称取10.32g干燥的NaCl固体
B、用10mL的量筒量取6.5mL浓盐酸
C、测溶液pH的方法是:取一小片广泛pH试纸置于玻璃片或表面皿上,再用干燥、洁净的玻璃棒蘸取溶液,点在pH试纸中部,然后跟标准比色卡比较
D、测定结晶水时,将灼烧硫酸铜晶体的坩埚放在空气中冷却,然后称量其质量
(2)工业上可以用S2Cl2作为橡胶的硫化剂,它不仅改变了橡胶热变粘、冷变硬的不良性能,还增加了橡胶的弹性。已知:S2Cl2是一种金黄色易挥发的液体(熔点:-76℃,沸点:+138℃),具有强烈的窒息性,且易与水发生反应生成HCl、SO 2、H2SO4等物质。在熔融的硫中通以氯气即可生成S2Cl2。下图是实验室用S和Cl2制备S2Cl2的装置 (夹持装置、加热装置均已略去)。
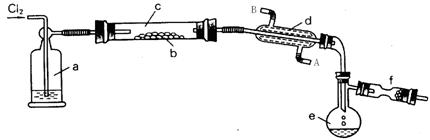
(1)装置a中应放的干燥剂为 浓硫酸 ,装置c为何要水平放置? 防止熔融的S堵塞导管 。
(2)装置d的作用是 冷凝S2Cl2 ,其中水的流动方向为 A进B出 。
(3)装置f中应放的试剂为 碱石灰 ,其作用是 除尾气、防止空气中的H2O和CO2进入e 。
(4)已知S2Cl2的分子结构与H2O2相似,请写出其结构式 Cl-S-S- Cl 。
四、(本题包括3小题,共24分)
20、A、B、C、D、E都是元素周期表中前20号元素,原子序数依次增大。A是非金属性最强的元素且A、D同主族;B、C、D同周期, B、C、D的最高价氧化物的水化物两两混合均能发生反应生成盐和水;E是第四周期主族元素。试回答:
(1)A和D氢化物中,沸点较低的是 D (选填“A”或“D”);A和B的离子中,半径较大的是 F- (填写离子符号)。
(2)元素C在元素周期表中的位置是:第 3 周期, ⅢA 族。
(3)A和E可组成离子化合物,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如下图所示,阳离子(用“●”表示)位于该正方体的顶点或面心;阴离子(用“○”表示)均位于小正方体中心。该化合物的是 CaF2 (填写化学式)。
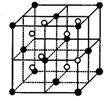
![]()
晶胞 晶胞的1/8
21、过氧化氢(H2O2)俗名双氧水,一定条件下可以显示氧化性、还原性、酸性、漂白性等性质,医疗上可它用作外科消毒剂。根据信息回答:
![]()
(1)H2O2的电子式为 固态时H2O2属于 分子晶体。
(2)双氧水加入酸性高锰酸钾溶液中,溶液的紫红色消褪。此时双氧水表现还原性。
(3)向含有酚酞的Na2CO3溶液中滴入足量的双氧水,溶液由红色褪至无色,再向该溶液中加入足量0.1mol/LNaOH溶液,溶液始终不再显红色,说明双氧水有氧化性(漂白性)性。
(4)经测定H2O2为二元酸,其酸性比碳酸弱。试写出H2O2在水溶液中的电离方程式 H2O2![]() H++HO2- 、 HO2-
H++HO2- 、 HO2-![]() H++
O2- 。
H++
O2- 。
22、化学家泽维尔在用激光研究化学物质的结构方面有过突出贡献。他曾经用四氟化二碘做了下面实验:
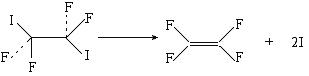
发现两个完全相同的C-I键是一先一后断裂的。则关于上述反应类型的判断中,正确的是 C 。
A. 取代反应 B. 加成反应 C. 消去反应 D. 加聚反应
五、(本题包括2小题,共18分)
23、已知:J是一种日常生活中最常见的盐,D是淡黄色类粉末,H是常见轻金属单质,可用于飞机制造业,E是著名的“侯德榜工业制碱”的主要产品。它们的关系如下图,试回答问题:
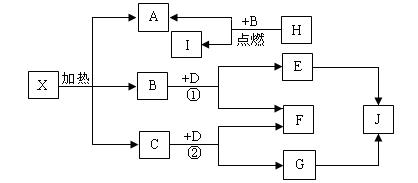
(1)J的化学式: NaCl 。
(2)写化学方程式① 2Na2O2+2CO2= 2Na2CO3+O2 、②2Na2O2+2H2O= 4NaOH+ O2↑ 。
(3)X在医药上用作解酸剂,与盐酸作用时,若生成B的物质的量与消耗盐酸的物质的量之比为
3∶8,则X的化学式为: Mg4H2C3O11 (Mg(OH)2 .3MgCO3 。
24、法国化学家伊夫·肖万获2005年诺贝尔化学奖。他发现了烯烃里的碳-碳双键会被拆散、重组,形成新分子,该过程被命名为烯烃复分解反应 。烯烃复分解反应可形象描述为交换舞伴。(如图)
烯烃复分解反应中的催化剂是金属卡宾(如CH2==M),金属卡宾与烯烃分子相遇后
两对舞伴会暂时组合起来,手拉手跳起四人舞蹈。随后它们“交换舞伴”,组合成两个
新分子,其中一个是新的烯烃分子,另一个是金属原子和它的新舞伴。后者会继续寻
找下一个烯烃分子,再次“交换舞伴”。 例如:烯烃复分解反应如下所示:
![]()
即从总效果看,是双键断裂后部分重新组合。
(1)C6H5CH2CH==CH2与CH2==M一定条件下反应,下列产物不可能存在的是 A 。
A. C6H5CH2CH==M B. CH2= CH2
C. C6H5CH2 CH2 C6H5 D. C6H5CH2CH==CH CH2 C6H5
![]() (2)炔烃也能发生此类反应,写出自身发生复分解反应的化学方程式:
(2)炔烃也能发生此类反应,写出自身发生复分解反应的化学方程式:
2CH3 ≡CH→CH3≡CH3+ CH≡CH 。
(3)烯烃复分解反应可以合成其他反应难以合成的物质,写出用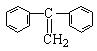 制取
制取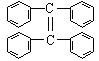 的化学方程式: 2
的化学方程式: 2 →
→ +CH2=CH2 。
+CH2=CH2 。
六、(本题包括2小题,共20分)
25(6分)、在40mL0.10mol/LBaCl2溶液中,加入过量0.10mol/LH2SO4溶液,使沉淀完全。将反应后的混合物过滤,取滤液的一半,在滤液中加入25mL0.22mol/LNaOH溶液至恰好呈中性。试计算加入H2SO4溶液的体积。(55ml)
26(14分)、已知:Pb的化合价只有+2、+4,且+4价的Pb具有强氧化性,常温下能氧化浓HCl生成Cl2;PbO2不稳定,随温度升高按下列顺序逐步分解:PbO2→Pb2O3→Pb3O4→PbO。
现将a mol PbO2加热分解,收集产生的O2;向加热后所得固体中加入足量的浓盐酸,收集产生的Cl2。加热反应后所得固体中,Pb2+占Pb元素的物质的量分数为x;两步反应中收集的O2和Cl2的物质的量之和为y mol。
(1)试写出Pb2O3与浓盐酸反应的化学方程式 Pb2O3+ 6HCl=2 PbCl2+ Cl2↑+3H2O 。
(2)通过计算确定y与a、x的函数关系式为 y=a-ax/2 。
(3)若两步反应中O2和Cl2的物质的量之比为5∶3,则此时剩余固体中含有的物质为
(写化学式) Pb3O4、 PbO ,其物质的量之比为 3:4 。