高三化学反应及其能量变化单元测试
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,满分150分.考试时间:100分钟.
可能用到的原子量: H:1 C:12 O:16 S:32 N:14 Cu:64 Fe:56 Ag:108
第Ⅰ卷(选择题,共64分)
一、选择题(每小题只有一个选项符合题意,每小题4分,共8题)
1.从海水中提取溴有如下反应:5NaBr+NaBrO3+3H2SO4=3Br2+3Na2SO4+3H2O,与该反应在氧化还原反应原理上最相似的是
A.2NaBr+Cl2=2NaCl+Br2 B.AlCl3+3NaAlO2+6H2O=4Al(OH)3↓+3NaCl
C.3S+6KOH=2K2S+K2SO3+3H2O D.NH4Cl+NaNO2=NaCl+N2↑+2H2O
2.要配制下列含有较多量不同阴、阳离子的四种溶液,其中能配制成功的是
A.K+、Al3+、Cl-、CO32- B.H +、Zn2+、S2O32-、Cl-
C.H +、SO32-、S2-、Cl- D.Mg2+、SO42-、NH4+、Cl-
3.下列反应中,Na2O2既不是氧化剂又不是还原剂的是
A.2Na2O2+2H2O=4NaOH+O2↑ B.2Na2O2+2CO2=2Na2CO3+O2↑
C.Na2O2+H2SO4=Na2SO4+H2O2 D.3Na2O2(熔融)+Fe2O3=2Na2FeO4+Na2O
4.化学反应可视为旧健断裂和新键形成的过程,化学键的键能是形成(或拆开)1mol
|
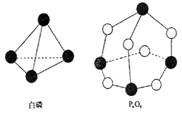
分子结构如右图所示,现提供以下化学键的键能(kJ·mol-1)
P—P:198 , P—O:360 , O2分子:498 。则反应
P4(白磷)+3O2→P4O6的反应热△H为
A.-1638kJ/mol B.+1638kJ/mol
C.-126kJ/mol D.+126kJ/mol
5.已知H2O(g)=H2O(l);△H1=-Q1 kJ/mol C2H5OH(g)=C2H5OH(l);△H2=-Q2 kJ/mol C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g);△H3=-Q3 kJ/mol
若使23 g酒精液体完全燃烧,最后恢复到室温,则放出的热量为
A.Q1+Q2+Q3 B.0.5(Q1+Q2+Q3) C.1.5Q1+0.5Q2+0.5Q3
D.1.5Q1-0.5Q2+0.5Q3
6.实验室用白磷(P4)和四碘化二磷(P2I4)与水共同反应来制备碘化鏻(PH4I)。同时还生成磷酸,下面叙述正确的是
A.方程式中P2I4和PH4I的系数比为1:4 B.水在反应中为氧化剂
C.生成的磷酸是还原产物 D.反应过程中无电子得失和偏移
7.K35ClO3晶体与H37Cl溶液反应生成氯气、氯化钾和水,此反应生成的氯气的相对分子质量为
A.73.3 B.73 C.74 D.70.6
8.铜和镁的合金4.6g完全溶于浓硝酸,若反应中硝酸被还原只产生4480mL的NO2气体和336mL的N2O4气体(都已折算到标准状况),在反应后的溶液中,加入足量的氢氧化钠溶液,生成沉淀的质量为
A.9.02g B.8.51g C.8.26g D.7.04g
二、选择题(每小题有一个或二个选项符合题意,每小题4分,共8题)
9.下列离子方程式书写正确的是
A.FeSO4溶液(已硫酸酸化)中加入H2O2溶液 Fe2++2H2O2+4H+====Fe3++4H2O
B.向碳酸氢钾溶液中滴入过量澄清石灰水
2HCO3-+Ca2++2OH-=CO32-+2H2O+CaCO3↓
C.向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全
Ba2++OH—+H++SO42—====BaSO4↓+H2O
D.硫酸铜和氢氧化钡溶液混合 Cu2++SO42-+Ba2++2OH-=Cu(OH)2↓+BaSO4↓
10.已知酸性条件下有反应:2Cu+ == Cu2+ + Cu 。氢气还原氧化铜试验由于反应温度不同,可能产生Cu或Cu2O,两者都是红色固体。某同学对某次氢气还原氧化铜试验的红色固体产物作了如下实验,实验操作和实验现象列表如下:
| 加入试剂 | 稀硫酸 | 浓硫酸并加热 | 稀硝酸 | 浓硝酸 |
| 实验现象 | 红色固体 蓝色溶液 | 无色气体 | 无色气体 蓝色溶液 | 红棕色气体 蓝色溶液 |
由此推出本次氢气还原氧化铜实验的产物:
A.是Cu B.是Cu2O C.一定有Cu,一定有Cu2O D.一定有Cu2O,可能有Cu
11.下列各种溶液中,一定能大量共存的离子组是:
A.pH=0的溶液中:Fe3+、Br-、SO42-、Fe2+
B.由水电离的c(H+)=10-5mol·L-1 的溶液中:Na+、Al3+、I-、SO42-
C.含有大量Fe3+的溶液中:Mg2+、Al3+、Cu2+、CO32-
D.使紫色石蕊试液变红色的溶液中:K+、Na+、Ca2+、HCO3-
12.将一定量的锌与100mL18.5mol/L的浓硫酸充分反应后,锌完全溶解,同样生成气体A 33.6L(标准状况),将反应后的溶液稀释至1L,测得溶液中c(H+)=0.1mol•L—1,则下列叙述中错误的是
A.气体A为SO2和H2的混合物 B.气体A中SO2与H2的体积比为4:1
C.反应中共消耗Zn97.5g D.反应中共转移电子4 mol
13.向含0.78mol的FeCl2溶液中通人0.09molCl2,再加入含0.1mol X2O72-的酸性溶液,使溶液中Fe2+全部恰好氧化,而X2O72-变成Xn+,则下列说法正确的是
A.n的值是4 B.Xn+是还原产物 C.n的值是3 D.Fe3+是还原产物
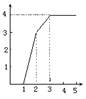 14.某稀溶液中含有Fe(NO3)3、Cu(NO3)3、HNO3,向其中逐渐加入铁粉,溶液中Fe2+的浓度(纵坐标/mol·L-1)和加入铁粉的物质的量(横坐标/mol)之间的关系如图所示。则溶液中Fe(NO3)3、Cu(NO3)3、HNO3物质的量浓度之比为
14.某稀溶液中含有Fe(NO3)3、Cu(NO3)3、HNO3,向其中逐渐加入铁粉,溶液中Fe2+的浓度(纵坐标/mol·L-1)和加入铁粉的物质的量(横坐标/mol)之间的关系如图所示。则溶液中Fe(NO3)3、Cu(NO3)3、HNO3物质的量浓度之比为
A.1∶1∶1 B.1∶3∶1 C.3∶3∶8 D.1∶1∶4
15、下列离子方程式书写正确的是
A.碳酸氢镁溶液中加入过量的澄清石灰水
| |
B.过量CO2气体通入Ca(ClO)2溶液中:CO2+H2O+ClO- HClO+HCO3-
C.少量SO2气体通入NaClO溶液中:SO2+H2O+2ClO- 2HClO+SO32-
D.FeCl3溶液中通入H2S气体:2Fe3++S2-==2Fe2++S↓
16.在一定条件下化学反应:2SO2(g)+O2(g)![]() 2SO3(g);△H=-197 kJ/mol 现有容积相同的甲、乙、丙三个容器,在上述条件下分别充入的气体和反应放出的热量(Q)如下表所列:
2SO3(g);△H=-197 kJ/mol 现有容积相同的甲、乙、丙三个容器,在上述条件下分别充入的气体和反应放出的热量(Q)如下表所列:
| 容器 | SO2(mol) | O2(mol) | N2(mol) | Q(kJ) |
| 甲 | 2 | 1 | 0 | Q1 |
| 乙 | 1 | 0.5 | 0 | Q2 |
| 丙 | 1 | 0.5 | 1 | Q3 |
根据以上数据,下列叙述不正确的是
A.在上述条件下反应生成1 molSO3气体放热98.5 kJ
B.在上述条件下每摩该反应进行到底时放出的热量为197 kJ
C.Q1=2Q2=2Q3=197 D.2Q2=2Q3<Q1<197 kJ
第II卷(非选择题,共76分)
17.(10分)在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂H2O2,当它们混合时,即产生大量氮气和水蒸气,并放出大量热。已知0.4mol液态肼和足量液态H2O2反应,生成氮气和水蒸气,放出256.65kJ的热量。又知:肼中所有化学键都是单键。
(1)写出肼和过氧化氢的电子式:肼: 过氧化氢 。
(2)写出热化学方程式: 。
(3)已知:H2O(l)=H2O(g);△H=+44kJ.mol-1,则16g液态肼与足量H2O2反应,生成氮气和液态水,放出的热量是 。
(4)上述反应用于火箭推进器,除释放出大量热和快速产生大量气体外,还有一个很突出的优点 。
18.(8分 )配平下列离子方程式,并回答问题:
(1) Fe(OH)3+ +ClO-+ OH-= FeO4n-+ Cl-+ H2O
(2)若有3.21gFe(OH)3参加反应,共转移了5.418×1022个电子,则n= ,FeO4n-中铁的化合价为 。
(3)试推测FeO4n-能与下列哪些物质反应(填序号) 。
A.Cl2 B.SO2 C.H2S D.O2
19. (12分)在含有1 mol FeBr2的溶液中,通入Cl2的物质的量为x mol。当x为不同值时,有不同的反应和不同的产物。试根据要求填写下表的空格:
| x的取值范围 | 离子反应方程式 | 产物的化学式 |
| 2 Fe2+ + Cl2 == 2 Fe3+ + 2 Cl- | ||
| FeCl3 Br2 | ||
| X = 1 mol |
20.(4分)某溶液中可能含有NH4+、Ba2+ 、Fe2+、Ag+ 、OH-、SO42-、CO32-中的某几种。现用该溶液做以下实验:
(1)取此溶液少许,加足量盐酸无明显现象;
(2)另取少许加入足量浓NaOH溶液,有沉淀生成;
(3)将(2)中沉淀过滤,取滤液微热,有无色刺激气体放出,该气体能使湿润红色石蕊试纸变蓝。
由此推断,该溶液中肯定有 离子,肯定无 离子。
21、(6分)(1)向NaHSO4溶液中,逐渐加入Ba(OH)2,溶液至中性,写出反应的离子方程式: ;
(2)在以上中性溶液中,继续滴加Ba(OH)2溶液,写出反应的离子方程式
。
(3)已知硫酸铅难溶于水,也难溶于硝酸,却可溶于醋酸铵溶液中,形成无色的溶液,其化学方程式是:PbSO4+2NH4Ac=Pb(Ac)2+(NH4)2SO4。当在Pb(Ac)2(醋酸铅)溶液中通入H2S时,有黑色沉淀PbS生成。表示这个反应的有关离子方程式是 。
22.(12分)硫酸锰(MnSO4)和过硫酸钾(K2S208)两种盐溶液在银离子催化下可发生氧化还原反应,生成高锰酸钾,硫酸钾和硫酸。
(1)请写出并配平上述反应的化学方程式,标出电子转移方向以及数目
。
(2)此反应的还原剂是 ,它的氧化产物是 。
(3)此反应的离子反应方程式可表示为: 。
(4)若该反应所用的硫酸锰改为氯化锰,当它跟过量的过硫酸钾反应时,除有高锰酸钾、硫酸钾、硫酸生成外,其他的生成物还有 。
23.(12分)现有SO2气体和H2S气体共1mol,将两种气体混合后所得产物中,若经氧化得到的产物比还原得到的产物多6.4g。
(1)、写出反应的化学方程式,并标明电子转移的方向和数目。
(2)、若以上反应完全进行,试计算H2S和SO2气体的物质的量可能各是多少?
24.(12分)为了测定某铜银合金的组成,将30.0g合金溶于80mL13.5 mol•L—1的浓HNO3中,待合金完全溶解后,收集到气体6.72L(标准状况),并测得溶液的pH=0,假设反应后溶液的体积仍为80mL,试计算:
(1)被还原的硝酸的物质的量
(2)合金中银的质量分数
化学反应及其能量变化单元测试答案2006-10-20
| 一、选择题(16小题,每小题4分)
(2)N2H4(l)+2 H2 O 2(l)=N2(g)+4H2O(g); △H=-641.625 kJ.mol-1 (3)__408.8kJ______________________、 (4)生成氮气和水,对环境无污染。 18.(8分 )(1) 2 Fe(OH)3+ 5-n ClO-+ 2n OH-= 2 FeO4n-+ 5-n Cl-+ n+3 H2O (2)__2______;_+6___________ (3)___ B C______ 19. (12分)
20.(4分) NH4+ Fe2+ SO42-; Ba2+ 、Ag+ 、OH-、CO32- 21.(6分)(1)2 H+ + SO42-+ Ba2+ +2 OH- = BaSO4↓+2 H2O (2)SO42-+ Ba2+ = BaSO4↓ (3)Pb(Ac)2+H2S=PbS↓+2HAc 22.(12分)(1)2 MnSO4+5K2S2O8 +8H2O = 2KMnO4+ 4K2SO4+8H2SO4 (2)MnSO4;KMnO4 (3)2 Mn2++5S2O82- +8H2O = 2MnO4- +10SO42-+16H+ (4)Cl2 (HClO 或 HClO3) 23.(12分) (1) 2H2S + SO2 =3S+ 2H2O (2) n(H2S)=0.8mol, n(SO2)= 0.2mol或n(H2S)=0.4mol, n(SO2)= 0.6mol 24..(12分) (1) 0.3mol (2) 36% |
化学反应及其能量变化单元测试答题卷
班级 ___________ 姓名_______________
| 一、选择题(16小题,每小题4分)
|
| 17、(10分 )(1)_______________________;______________________________。 (2)__________________________________________________。 (3)________________________ (4)________________________________。 18.(8分 )(1) Fe(OH)3+ +ClO-+ OH-= FeO4n-+ Cl-+ H2O (2)________;______________ (3)_________ 19. (12分)
20.(4分)_____________;______________ 21.(6分)(1) (2) __ (3) 22.(12分)(1)
(2)____________;________________ (3) (4)_________ 23.(12分) (1)
(2) 24 |