高三化学反应及其能量的变化质量检测1
——(请把答案写在答题纸上)
一、选择题(每题仅有一个答案,共有8题,每题4分共32分)
1.(06上海)下列物质能通过化合反应直接制得的是 ①FeCl2 ②H2SO4 ③NH4NO3 ④HCl
A.只有①②③ B.只有②③ C. 只有①③④ D.全部
2.在防止禽流感疫情时,防疫部门大量使用了含氯类消毒剂,其中的氯胺是一种长效缓释有机氯消毒剂,有强氧化性,其杀菌能力是一般含氯消毒剂的4~5倍,下列有关氯胺(NH2Cl)的说法一定不正确的是:
A、氯胺水解产物最初为NH2OH和HCl B、氯胺一定条件下可与乙烯加成H2NCH2CH2Cl
C、氯胺的消毒原理与漂白粉相似
D、氯胺的电子式为: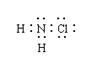
3.(06江苏)下列各组热化学方程式中,化学反应的△H前者大于后者的是
①C(s)+O2(g)===CO2(g);△H1 C(s)+O2(g)===CO(g);△H2
②S(s)+O2(g)===SO2(g);△H3 S(g)+O2(g)===SO2(g);△H4
③H2(g)+O2(g)===H2O(l);△H5 2H2(g)+O2(g)===2H2O(l);△H6
④CaCO3(s)===CaO(s)+CO2(g);△H7 CaO(s)+H2O(l)===Ca(OH)2(s);△H8
A.① B.④ C.②③④ D.①②③
4.同位素示踪法可用于反应机理的研究,下列反应或转化中同位素示踪表示正确的是
A.2Na218O2+2H2O=4Nal8OH+O2↑ B.2KMnO4+5H218O2+3H2SO4=K2SO4+2MnSO4+518O2↑+8H2O
C.NH4Cl+2H2O![]() NH3·2H2O+HCl D.K37ClO3+6HCl=K37Cl+3Cl2↑+3H2O
NH3·2H2O+HCl D.K37ClO3+6HCl=K37Cl+3Cl2↑+3H2O
5. (06全国理综)已知下列分子或离子在酸性条件下都能氧化KI,自身发生如下变化:
H2O2 → H2O IO3- → I2 MnO4- → Mn2+ HNO3 → NO
如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是:
A. H2O2 B. IO3- C. MnO4- D. HNO3
6.(06江苏)下列反应的离子方程式正确的是
A.向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2OFe(OH)3↓+3H+
B.用小苏打治疗胃酸过多:HCO3-+H+===CO2↑+H2O
C.实验室用浓盐酸与MnO2反应制Cl2:MnO2+2H++2Cl-Cl2↑+Mn2++H2O
D.用FeCl3溶液腐蚀印刷电路板:Fe3++Cu===Fe2++Cu2+
7.(06上海)已知某溶液中存在较多的H+、SO42-、NO3-,则溶液中还可能大量存在的离子组是
A.A13+、CH3COO—、C1— B.Na+、NH4+、C1—
C.Mg2+、C1—、Fe2+ D. Mg2+、Ba2+、Br—
8.(06全国理综)下列反应的离子方程式书写正确的是:
A. 氯化铝溶液中加入过量氨水:Al3+ + 4NH3•H2O
AlO2- + 4NH4+
+ 2H2O
B. 澄清石灰水与少量苏打溶液混合:Ca2+ + OH- + HCO3- CaCO3↓ + H2O
C. 碳酸钙溶于醋酸CaCO3 + 2H+ Ca2+ + CO2↑ +
H2O
D. 氯化亚铁溶液中通入氯气:2Fe2+ + Cl2 2Fe3+ + 2Cl-
二、不定项选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。)
9.(06广东)下列实验中,溶液颜色有明显变化的是
A.少量明矾溶液加入到过量NaOH溶液中
B.往FeCl3溶液中滴入KI溶液,再滴入淀粉溶液
C.少量Na2O2固体加入到过量NaHSO3溶液中
D.往酸性高锰酸钾溶液中滴入少量Fe2(SO4)3稀溶液
10.(06江苏)一定能在下列溶液中大量共存的离子组是
A.含有大量Al3+的溶液:Na+、NH4+、SO42-、Cl-
B.c(H+)=1×10-13mol·L-1的溶液:Na+、Ca2+、SO42-、CO32-
C.含有大量Fe3+的溶液:Na+、Mg2+、NO3-、SCN-
D.含有大量NO3-的溶液:H+、Fe2+、SO42-、Cl-
11.(06四川)室温下,在强酸性和强碱性溶液中都不能大量共存的离子组是:
A.NH4+、Cu2+、Cl-、NO3- B.K+、Na+、SO32-、S2-
C.K+、Na+、AlO2-、SO42- D.Ba2+、Fe2+、NO3-、Br-
12.离子反应为aMnO4 - + bI-+ H+→ Mn2++ cI2 + dIO3- + H2O;根据该离子方程式,下列说法正确的是
A. 氧化性MnO4 ->IO3- B、c=d=5,则该反应转移电子数为30e-
C. a、b、c、d之间的关系是:5a=2c +6d;b=2c+d
D.当反应物的相对量或浓度发生改变时,化学计量数一定有c=d
13.(06上海)下列离子方程式中正确的是
A.H2SO4与Ba(OH)2溶液反应:Ba2++2OH—+2H+十SO42- =BaSO4↓+2H2O
B.Ca(HCO3)2与过量Ca(OH)2溶液反应:Ca2++HCO3-+2OH-=CaCO3↓+ CO32-+2H2O
C.Na2CO3溶液中通入少量CO2: CO32-+ CO2+ H2O =2HCO3-
D.CH3COOH溶液与NaOH溶液反应: H++ OH— =H2O
14.(06上海)为确定某溶液的离子组成,进行如下实验:
①测定溶液的pH,溶液显强碱性。②取少量溶液加入稀盐酸至溶液呈酸性,产生无刺激性、能使澄清石灰水变浑浊的气体。③在上述溶液中再滴加Ba(NO3)2溶液,产生白色沉淀。
④取上层清液继续滴加Ba(NO3)2溶液至无沉淀时,再滴加Ag NO3溶液,产生白色沉淀。
根据实验以下推测正确的是
A.一定有SO32-离子 B.一定有CO32-离子
C.不能确定C1—离子是否存在 D.不能确定HCO3-离子是否存在
15.(06北京理综)已知:①向KMnO4固体滴加浓盐酸,产生黄绿色气体; ②向FeCl2溶液中通入少量实验①产生的气体,溶液变黄色; ③取实验②生成的溶液滴在淀粉KI试纸变蓝。下列判断正确的是
A.上述实验证明氧化性:MnO4_ > Cl2 > Fe3+ > I2
B.上述实验中,共有两个氧化还原反应 C.实验②证明Fe2+既有氧化性又有还原性
D.实验①生成的气体不能使湿润的淀粉KI试纸变蓝
16.(06广东)下列离子方程式正确的是
A.Cl2与NaOH溶液反应:Cl2+2OH-==Cl-+ClO-+H2O
B.F2与NaOH溶液反应:F2+4OH-==2F-+O2+2H2O
C.AgNO3溶液中加入过量氨水:Ag++2NH3·H2O==Ag(NH3)2++2H2O
D.Fe3O4与稀HNO3反应:Fe3O4+8H+==Fe2++2Fe3++4H2O
17.(06广东)下列反应中,氧化剂与还原剂物质的量的关系为1∶2的是
A.O3+2KI+H2O==2KOH+I2+O2 B.2CH3COOH+Ca(ClO)2==2HClO+Ca(CH3COO)2
C.I2+2NaClO3==2NaIO3+Cl2 D.4HCl+MnO2==MnCl2+Cl2↑+2H2O
18.下列离子方程式中正确的是
A、等体积等物质的量浓度的NaHCO3溶液和Ba(OH)2溶液混合:
2HCO3- + Ba2+ + 2OH- = BaCO3↓ + CO32- + 2H2O
B、过氧化钠投入重水中:2Na2O2 + 2D2O = 4Na+ + O2↑+ 4OD-
C、石灰水中通入过量的氟化氢:Ca2+ + 2OH- + 2HF = CaF2↓+ 2H2O
![]() D、电解饱和氯化镁溶液:2Cl-
+ 2H2O
2OH- + H2↑+ Cl2↑
D、电解饱和氯化镁溶液:2Cl-
+ 2H2O
2OH- + H2↑+ Cl2↑
19.(06上海,8分)(1)请将5种物质:N2O、FeSO4、Fe(NO3)3、HNO3和Fe2(SO4)3分别填入下面对应的横线上,组成一个未配平的化学方程式。
_________ +__________ →__________+__________+__________+H2O
(2)反应物中发生氧化反应的物质__________,被还原的元素是_________。
(3)反应中1 mol氧化剂_______(填“得到”或“失去”)___________ mol电子。
(4)请将反应物的化学式及配平后的系数填入下列相应的位置中:
| |
| |
20.(06广东,12分)氧化铜有多种用途,如用作玻璃着色剂、油类脱硫剂等。为获得纯净的氧化铜以探究其性质,某同学用工业硫酸铜(含硫酸亚铁等杂质)进行如下实验:
|
|
|
![]()
![]()
![]()
![]()
![]() 工业CuSO4
CuSO4溶液 CuSO4·5H2O …… CuO
工业CuSO4
CuSO4溶液 CuSO4·5H2O …… CuO
①步骤I的目的是除不溶性杂质。操作是 。
②步骤Ⅱ的目的是除铁。操作是:滴加H2O2溶液,稍加热;当Fe2+转化完全后,慢慢加入Cu2(OH)2CO3粉末,搅拌,以控制溶液pH=3.5;加热煮沸一段时间,过滤,用稀硫酸酸化滤液至pH=1。控制溶液pH=3.5的原因是 。
③步骤Ⅲ的目的是得到CuSO4·5H2O晶体。操作是 ,过滤,水浴加热烘干。水浴加热的特点是 。
⑵探究氧化铜的性质
①取A、B两支试管,往A中先加入适量CuO粉末,再分别向A 和B中加入等体积的3%H2O2溶液,只观察到A中有大量气泡。结论是 。
②为探究试管A中反应的速率,收集气体并测定其体积必需的实验仪器有:
。
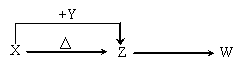 21.(06北京理综14分)X、Y、Z、W四种化合物均由短周期元素组成,其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体。这四种化合物具有下列转化关系(部分反应物、产物及反应条件已略去)。
21.(06北京理综14分)X、Y、Z、W四种化合物均由短周期元素组成,其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体。这四种化合物具有下列转化关系(部分反应物、产物及反应条件已略去)。
请回答:
(1)W的电子式是 。
(2)X与Y在溶液中反应的离子方程式是 。
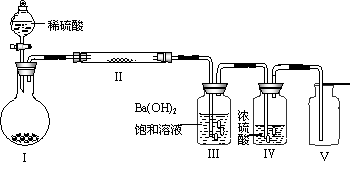 (3)X含有的四种元素之间(二种、三种或四种)可组成多种化合物,选用其中某些化合物,利用下图装置(夹持固定装置已略去)进行实验,装置Ⅲ中产生白色沉淀,装置V中可收集到一种无色气体。
(3)X含有的四种元素之间(二种、三种或四种)可组成多种化合物,选用其中某些化合物,利用下图装置(夹持固定装置已略去)进行实验,装置Ⅲ中产生白色沉淀,装置V中可收集到一种无色气体。
①装置Ⅰ中反应的化学方程式是 。
装置Ⅱ中物质的化学式是 。
②用Ⅹ含有的四种元素中的两种组成的某化合物,在催化剂存在下制备并收集纯净干燥的装置Ⅴ中气体,该化合物的化学式是 ,所需仪器装置是 (从上图选择必要的装置,填写编号)。
(4)向Z溶液中通入氯气,可制得某种生产和生活中常用的漂白、消毒的物质,同时有X生成,该反应的化学方程式是 。
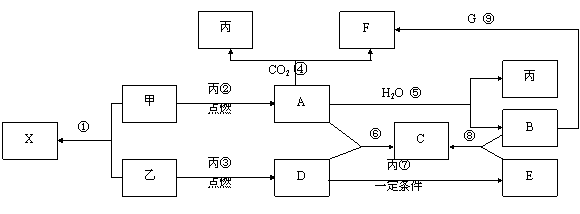 22、(12分)甲、乙、丙为常见单质,乙、丙两元素在周期表中位于同一主族。X、A、B、C、D、E、F、G均为常见的化合物,其中A和X的摩尔质量相同,A、G的焰色反应为黄色。在一定条件下,各物质相互转化关系如下图。
22、(12分)甲、乙、丙为常见单质,乙、丙两元素在周期表中位于同一主族。X、A、B、C、D、E、F、G均为常见的化合物,其中A和X的摩尔质量相同,A、G的焰色反应为黄色。在一定条件下,各物质相互转化关系如下图。
请回答:
(1) 写化学式:丙_________ ,E________ 。
(2)X的电子式为_______________
(3) 写出A与H2O反应的化学反应方程式:__________________________ 。
(4) 写出B与G溶液反应生成F的离子方程式:________________________。
(5) 在上图的反应中,不属于氧化还原反应的是(填序号)______________。
23.(06天津12分)中学化学中几种常见物质的转化关系如下:
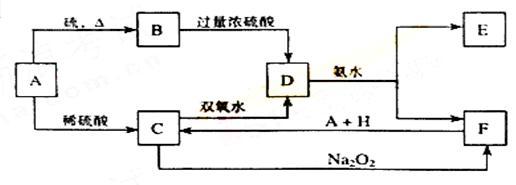
将D溶液滴入沸水中可得到以F为分散质的红褐色胶体。请回答下列问题:
(1)红褐色胶体E粒子直径大小的范围: 。
(2)A、B、H的化学式:A ,B ,H 。
(3)①H2O2分子的电子式:
②写出C的酸性溶液与双氧水反应的离子方程式: 。
(4)写出鉴定E中阳离子的实验方法和现象:
(5)在C溶液中加入与C等物质的量的Na2O2,恰好使C转化为F,写出该反应的离子方程式: 。
——化学反应及其能量的变化(请把答案写在答题纸上)
班级-------- 姓名 --------学号 --------(上交)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
19.
(1)_________ +__________ →__________+__________+__________+H2O
(2) __________ ,_________。
(3) _______(填“得到”或“失去”)___________ mol电子。
(4)
| |
| |
20.(1)
①是
②是
③操作是 ,
特点是 。
(2)
①结论是
②有:
。
21.
(1)是
(2)
(3)
① 。
。
② ,是
(4)是
22、
(1)丙 _________ ,E ________
(2)为_______________
(3):__________________________
(4):________________________
(5) ______________
23.
(1) 。
(2):A ,B ,H 。
(3)①:
②:
(4):
(5): 。
24.(06天津10分)2gCu2S和CuS的混合物在酸性溶液中用400mL0.075mol/LKMnO4溶液处理,发生反应如下:
8MnO4-+5Cu2S+44H+=10Cu2++5SO2+8Mn2++22H2O
6MnO4-+5CuS+28H+=5Cu2++5SO2+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与350mL0.1mol/L(NH4)2Fe(SO4)2溶液完全反应。
(1)配平KMnO4与(NH4)2Fe(SO4)2反应的离子方程式:
| |
| |
| |
| |
| |
| |
(2)KMnO4溶液与混合物反应后,剩余KMnO4的物质的量为 mol。
(3)欲配制500mL0.1mol/LFe2+溶液,需称取(NH4)2Fe(SO4)2·6H2O(M=392g/mol)的质量为 g。
(4)混合物中Cu2S的质量分数为 。
25.(06广东10分) 钴(Co)化合物对化学键的研究起着重要的作用。为测定某钴化合物[Co(NH3)xCly]Clz的组成,进行如下实验:
①称取样品0.5010g,加入过量的NaOH溶液,煮沸,蒸出所有的氨,冷却,得到A。产生的氨用50.00mL0.5000mol·L-1的盐酸完全吸收并用蒸馏水定容至100mL,得溶液B。取B溶液20.00mL, 用0.1000mol·L-1NaOH滴定,消耗NaOH溶液30.00mL。
②向A中加入过量KI固体,振荡,盐酸酸化后置于暗处,发生反应:
Com++I-→Co2++I2 (未配平)
反应完成后,蒸馏水稀释,用Na2S2O3溶液滴定析出的I2,消耗0.1000mol·L-1Na2S2O3溶液20.00mL。反应方程式为:I2+2Na2S2O3==2NaI+Na2S4O6
③另称取该物质样品0.2505g,溶于水,以0.1000mol·L-1AgNO3溶液滴定至恰好反应完全,消耗AgNO3溶液20.00mL。相应反应式为:
[Co(NH3)xCly]Clz+zAgNO3==[Co(NH3)xCly](NO3)z+zAgCl↓
通过计算求:
⑴[Co(NH3)xCly]Clz中氮元素的质量分数。
⑵该钴化合物的化学式。
19.(本题共8分)
(1) FeSO4+HNO3→Fe(NO3)3+Fe2(SO4)3+N2O+H2O
(2) FeSO4 +5N (3)得到 4 (4)3FeSO4+30HNO3→
20.⑴①
答案:加适量水溶解,搅拌,过滤
②答案:使Fe3+可全部转化为Fe(OH)3沉淀,而Cu2+不会转化为Cu (OH)2沉淀。
③
答案:将CuSO4·5H2O溶液加热蒸发至有晶膜出现时 ,停止加热。
受热均匀,温度易于控制在1000C以下。
⑵①
答案:CuO可加快H2O2分解的反应速率,是H2O2分解反应的催化剂。
②
答案:秒表、橡皮塞、导管、集气瓶、量筒。
21、(14分)
![]()
⑵ HCO— 3 + OH— = CO2—3 + H2O
⑶ ①Na2CO3 + H2SO4 = Na 2SO4 + CO2↑ + 2H2O
或2NaHCO3 + H2SO4 = Na 2SO4 + 2CO2↑ + 2H2O
Na2O2
② H2O2
Ⅰ、Ⅳ、Ⅴ
⑷ 2Na2CO3 + Cl2 + H2O = Na ClO +Na Cl + 2NaHCO3
![]() 22、(1) O2 SO3 (2)
22、(1) O2 SO3 (2)
(3) 2Na2O2 + 2H2O
4NaOH + O2↑
(4) HCO3- + OH- CO32- + H2O (5)
⑧⑨
23.(14分) (1)1nm---100nm
(2)Fe 、FeS、 H2SO4
(3)双氧水的电子式、 2Fe2+ + H2O + 2H+ = 2Fe3+ + 2H2O
(4) 取少量的E于试管中用滴管加入氢氧化钠溶液,加热,可使湿润的红色石蕊试纸变蓝色
(5)4 Fe2+ + 4 Na2O2 + 6H2O = 4Fe(OH)3↓+ O2 ↑ + 8Na+
24.(1)1、5、8、1、5、4
(2)0.007 (3)19。6 (4)40%
25.答案:
解:⑴NaOH+HCl=NaCl+H2O NH3+HCl=NH4Cl
20.00mLB溶液消耗0.1000mol·L-1NaOH 30.00mL。
20.00mLB溶液中过量的HCl:n(HCl)=0.003000mol ,
100mLB溶液中过量的HCl:n(HCl)=0.01500mol那么与NH3反应的n(HCl)=0.01000mol
故0.5010g样品中 n(NH3)=0.01000mol n(N)=0.01000mol
[Co(NH3)xCly]Clz中氮元素的质量分数
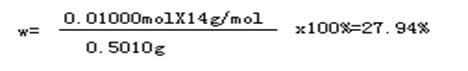
⑵ I2+2Na2S2O3==2NaI+Na2S4O6
因反应用去0.1000mol·L-1Na2S2O3溶液20.00mL,推算出:n(I2)=0.001000mol
Co与Fe同一族,Com+具有强氧化性,故设m=3
则有:2Co3++2I-==2Co2++I2 n(Co3+)=0.002000mol
0.5010g样品中Cl的总质量为:
m(Cl)=0.5010g-0.002000molx59g·mol -1-0.01000molx17g ·mol -1=0.2130g
n(Cl)=0.006000mol
又有:[Co(NH3)xCly]Clz+zAgNO3==[Co(NH3)xCly](NO3)z+zAgCl↓
0.2505g样品扩大一倍来算(即用0.5010g)推算出:
反应消耗AgNO3:n(AgNO3)=0.1000mol·L-1x40.00mL=0.004000mol
即发生上述反应的Cl-为:n(Cl-) =0.004000mol
则有 y:z=(0.006000mol-0.004000 mol): 0.004000mol=1:2
同时还有:1:x:(y+z)= 0.002000: 0.01000: 0.006000=1:5:3
解得:x=5 y=1 z=2
带入[Co(NH3)xCly]Clz中,求得Co化合价为:+3 假设成立
该钴化合物的化学式为:[Co(NH3)5Cl]Cl2
答:⑴[Co(NH3)xCly]Clz中氮元素的质量分数为27.94%
⑵该钴化合物的化学式为:[Co(NH3)5Cl]Cl2