高三化学上学期第一次诊断性测试
化 学
可能用到的相对原子质量 H — 1 O — 16 Na — 23 S — 32 K — 39
第Ⅰ卷(选择题 54 分)
一、选择题(每小题只有1个选项符合题意,请将正确答案的序号填涂在答题卡上。每小题3分,共54分)
1.1998年诺贝尔化学奖授予科恩(美)和波普尔(英),以表彰他们在理论化学领域作出的重大贡献。他们的工作使实验和理论能够共同协力探讨分子体系的性质,引起整个化学领域正在经历一场革命性的变化。下列说法正确的是 ( )
A.化学不再是纯实验科学 B.化学不再需要实验
C.化学不做实验,就什么都不知道 D.未来化学的方向还是经验化
2.从硫元素的化合价态上判断,下列物质中的硫元素不能表现氧化性的是 ( )
A.Na2S B. S C. SO2 D. H2SO4
3.FeCl3溶液、Fe(OH)3 胶体共同具备的性质是 ( )
A.加入饱和MgSO4溶液都发生聚沉
B.分散质的粒子都不能通过半透膜
C.都比较稳定,密封保存一段时间都不会产生沉淀
D.加入硫酸先产生沉淀,后沉淀溶解
4.下列各物质中,所有原子都满足最外层为8电子结构的是 ( )
A.BeCl2 B.PCl3 C.PCl5 D.NH3
5.根据磷元素的原子结构示意图![]() ,做出如下推理,其中与事实不符的是 ( )
,做出如下推理,其中与事实不符的是 ( )
A.磷元素位于元素周期表的第三周期、第VA族
B.磷原子不如氮原子和硫原子的得电子能力强
C.磷单质不如氮气和硫单质活泼
D.磷的氢化物(PH3)受热时不如氮的氢化物(NH3)和硫的氢化物(H2S)稳定
6.最近我国某近代物理研究所取得重大科研成果,研制出首批氧-18气体(18O2),氧-18是一种稳定的氧的同位素,称为重氧。下列有关说法正确的是 ( )
A.1.8g氧-18气体(18O2)的物质的量是0.1mol
B.0.1mol重氧水H218O所含的中子数为6.02×1023
C.0.2mol氧-18气体(18O2)的体积约为4.48L
D.氧-18气体的摩尔质量是36g
7.下列离子反应方程式正确的是 ( )
A.铜和硫酸锌溶液:Cu + Zn2+= Cu2++ Zn
B.澄清的石灰水中加入少量NaHCO3溶液:Ca2++2OH-+2HCO3- = CaCO3↓+2H2O+CO32-
C.少量的盐酸逐滴滴入碳酸钠溶液:CO32-+2H+=CO2↑+H2O
D.溴化亚铁溶液中通入少量氯气:2Fe2++Cl2=2Fe3++2Cl-
8.用惰性电极电解100mL浓度为0.05mol/L的CuSO4溶液,通电一段时间,Cu2+恰好反应完全,若溶液体积仍为100mL,此时溶液的pH为 ( )
A.1 B.2 C.12 D.13
9.在25℃时,将两个惰性电极插入一定量的硫酸钠饱和溶液中进行电解,通电一段时间后,阴极上逸出a mol气体,同时有w g Na2SO4 ·10 H2O晶体析出,若温度不变,则剩余溶液中溶质的质量分数为 ( )
A.![]() × 100% B.
× 100% B.![]() × 100%
× 100%
C.![]() × 100% D.
× 100% D.![]() × 100%
× 100%
10.在给定的四种溶液中,加入以下各种离子,各离子能在原溶液中大量共存的有( )
A.滴加石蕊试液显红色的溶液:Fe3+ 、NH![]() 、Cl- 、SCN-
、Cl- 、SCN-
B.pH值为1的溶液:Cu2+、Na+ 、Al3+、NO![]()
C.水电离出来的c(H+)=10-13mol/L的溶液:K+、HCO![]() 、Br-、Ba2+
、Br-、Ba2+
D.所含溶质为Na2SO4的溶液:K+ 、CO![]() 、NO
、NO![]() 、 Mg2+
、 Mg2+
11.把Ba(OH)2溶液逐滴滴入明矾溶液中,使SO42ˉ全部转化成BaSO4沉淀,此时铝元素的主要存在形式是 ( )
A.Al3+ B.Al(OH)3
C.AlO2ˉ 或 [Al(OH)4]- D.Al3+和Al(OH)3
12.我国发射“神五”所用的“长征2号”火箭的主要燃料是偏二甲肼(C2H8N2),氧化剂是N2O4,燃烧的产物若只有N2、CO2和H2O。有的国家用肼(N2H4)作为火箭发动机的燃料,NO2为氧化剂,反应生成N2和水蒸气。已知:N2(g)+2O2(g)=2NO2(g);△H= + 67.7 kJ·mol-1,
N2H4(g)+O2(g)=N2(g)+2H2O(g);△H= - 534 kJ·mol-1下列关于肼和NO2反应的热化学方程式中,正确的是 ( )
A.2N2H4(g)+2NO2(g)=3N2(g)+4H2O(l);△H= -1135.7 kJ·mol-1
B.2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g);△H= +1135.7 kJ·mol-1
C.N2H4(g)+NO2(g)=3/2 N2(g)+2H2O(g);△H= -1135.7 kJ·mol-1
D.2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g);△H= -1135.7 kJ·mol-1
13.下列物质中能够与酸反应生成盐和水,但不属于碱性氧化物的是 ( )
A.Na2O B.Na2O2 C. Na D.CuO
14.某体积可变的密闭容器,盛有适量的A和B的混合气体,在一定条件下发生反应:
![]() ,若维持温度和压强不变,英才当到达平衡时,容器的体积为VL,其中C气体的体积占10%,下列推断正确的是 ( )
,若维持温度和压强不变,英才当到达平衡时,容器的体积为VL,其中C气体的体积占10%,下列推断正确的是 ( )
①原混合气体体积为1.2VL; ②原混合气体的体积为1.1VL;
③反应达平衡时气体A消耗0.05VL; ④反应达平衡时气体B消耗掉0.05VL。
A.②③ B.②④ C.①③ D.②①
![]() 15.某可逆反应:mA(气)+nB(气) pC(气)(焓变为
15.某可逆反应:mA(气)+nB(气) pC(气)(焓变为![]() H),其温度T、时间t与生成物C的体积百分数C%、平衡混合气体的平均相对分子质量M的关系如下图所示,下列结论正确的是 ( )
H),其温度T、时间t与生成物C的体积百分数C%、平衡混合气体的平均相对分子质量M的关系如下图所示,下列结论正确的是 ( )
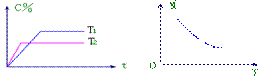 A.m+n>p
A.m+n>p ![]() H>0
H>0
B.m+n>p ![]() H<0
H<0
C.m+n<p ![]() H>0
H>0
D.m+n<p ![]() H<0
H<0
16.在恒温恒容的密闭容器中放入一定量的NO2,发生反应 2NO2(g)![]() N2O4(g);
N2O4(g);![]() H<0,达到平衡后,若分别单独改变下列条件,重新达到平衡后,能使该反应的平衡混合气体平均相对分子质量减小的是 ( )
H<0,达到平衡后,若分别单独改变下列条件,重新达到平衡后,能使该反应的平衡混合气体平均相对分子质量减小的是 ( )
A.降低温度 B.通入NO2 C.通入N2O4 D.升高温度
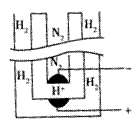 17.1998年两位希腊化学家在《科学》杂志上发表论文,称他
17.1998年两位希腊化学家在《科学》杂志上发表论文,称他
们在常压 下把氢气和用氦气稀释的氮气分别通入一个加热
到570℃的电解池(如右图)中,氢气和氮气在电极上合成了
氨气,且转化率达到了78%。用来合成的电解质在电解池中
起传导H+的作用,它是一种固体复合氧化物(缩写为SCY),
电解池的两个电极则是吸附在SCY内外表面上的金属钯多晶薄膜。下列说法中不正确的是 ( )
A.阳极的反应式为 H2-2e - =2H+
B.阴极的反应式为 N2+6e - +6H+=2NH3
C.电解的总反应式 N2+3H2![]() 2NH3
2NH3
D.电解的总反应式 3H++N3-![]() NH3
NH3
18.蓄电池在放电时起原电池的作用,在充电时起电解池的作用。下式是爱迪生蓄电池分别
 |
在充电和放电时发生的反应:Fe+NiO2+2H2O Fe(OH)2+Ni(OH)2
下列有关对爱迪生蓄电池的推断错误的是 ( )
A.放电时,Fe是负极,NiO2是正极
B.充电时,阴极上的电极反应式为Fe(OH)2+2e-=Fe+2OH-
C.放电时电解质溶液中的阴离子是向正极方向移动
D.蓄电池的电极必须浸入碱性电解质溶液中
第Ⅱ卷(非选择题46分)
二、填空题(共46分)
19.(6分)有一质量为Wg,相对分子质量为b的某种碱M(OH)2,在一定温度下完全溶解为Vml的饱和溶液。若溶液的密度为d g/cm3,则溶液的物质的量浓度是 ,溶质的质量分数是 ,该温度下的溶解度是 。
20.(5分)根据氧化还原反应2FeCl3+Fe=3FeCl2,设计一个原电池,用 做负极,电极反应为 ;电解质溶液是 ;用 做正极,电极反应为 。
21.(3分)有两瓶pH=2的酸溶液,一瓶是强酸,一瓶是弱酸。现只有石蕊、酚酞试液、pH试纸和蒸馏水,而没有其它试剂。简述如何用最简便的实验方法来判别哪瓶是强酸。
_____________________________________________________________________________________________________________________________________________________。
22.(10分)短周期的三种元素A、B、C、X、Y、Z,原子序数依次变小,其中X、Y、Z原子核外电子层数之和是5。X元素原子最外电子层上的电子数是Y和Z两元素原子最外电子层上的电子数的总和;Y元素原子的最外电子层上的电子数是它的电子层数的2倍,X和Z可以形成XZ3的化合物;YC与X处于同周期,B+与C2-的核外电子排布相同,A与B处于同周期,且形成BA型化合物。请回答:
(1)Y元素的名称是 ;
(2)XZ3化合物的电子式是 ;
(3)A、B、C的离子半径由大到小的顺序为 (用元素离子符号表示);
(4)化合物XZ4A中所含有的化学键类型为 ;
(5)元素组成为XZ5YC3和BCZ化合物反应的离子方程式为
。
23.(10分)下图中,P为一可自由滑动的活塞,关闭K,分别向容器A、B中各充入2 mol X、2 mol Y,起始时,VA = a
L,VB = 0.8 a L(连通管的体积忽略不计),在相同温度和有催化剂存在的条件下,两容器中各自发生下述反应:3X(g) + 3Y(g) ![]() 2Z(g) + 2W(g),达到平衡时,VB =
0.6 a L。
2Z(g) + 2W(g),达到平衡时,VB =
0.6 a L。
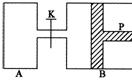
(1)B中X的转化率为_____________。
(2)A、B中X的转化率的关系是A_______B(填“>”或“=”或“<”),其理由是者说______________________________________________________________________。
(3)平衡时A、B中混合气体的平均相对分子质量的关系是:MA______MB(填“>”或“=”或“<”)。
(4)如果要计算出平衡时B中混合气体的密度,则至少还需要知道的数据是_____________(MX、MY、MZ、MW分别表示X、Y、Z、W的摩尔质量)。①MX ②MY③MZ ④MW
A.③和④ B.①和② C.①和③ D.②③④
(5)打开K,一段时间后反应再次达到平衡,则B的体积为________L。
24.(12分)如下图所示:甲、乙为相互串联的两电解池。
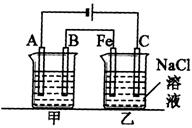
试回答:
(1)乙池中Fe极电极反应式为______________,若在乙池中滴入少量酚酞试液,开始电解一段时间,铁极附近呈______色。
(2)甲池若为用电解原理精炼铜(假设粗铜的组成是均匀的,且比其活泼和不活泼的成分均存在)的装置,则A电极名称为______极,电极反应式为___________________,电解质溶液可以是_____________;通电一段时间后,A极增重12.8 g,则甲池溶液原溶质的浓度 (填“增大”、“减小”、“不变”或“无法确定”),乙池C(石墨)极放出气体在标况下的体积为 ,此时乙池剩余溶液的体积为400 mL,则溶液的pH = ________。
参考答案
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| A | A | C | B | C | B | D | A | D | B | C | D | B | A | B | D | D | C |
![]() 19.(2分×3=6分)
19.(2分×3=6分)
![]()
![]()
20.(1分×5=5分)
铁 Fe-2e- =Fe2+ FeCl3溶液 惰性电极 Fe3++e- = Fe2+
21.(3分)
各取等体积酸液用蒸馏水稀释相同倍数(如100倍),然后用pH试纸分别测其pH值,pH值变化大的是强酸。
22.(10分)
(1)碳 (2分)
(2) ![]() (2分)
(2分)
(3)Cl->O2->Na+ (2分)
(4)离子键和共价键(2分)
(5)NH4++HCO3-+2OH-=NH3·H2O+CO32-+H2O(2分)
23.(2分×5=10分)
(1)75%
(2)A < B B中压强比A中要大,而增大压强,有利于平衡向正反应方向移动,反应物的转化率增大。
(3)MA < MB
(4)A 或B
(5)0.2a L
24.(12分)
(1)2H+ + 2e – H2↑(2分) 红 (1分)
(2)阴
(1分) Cu2+
+ 2e – Cu (2分)
CuSO4溶液或CuCl2溶液 (1分) 减小 (1分)
4.48L(2分) 14(2分)