高三化学上学期第一次阶段考试试题
化学试题
可能用到的相对原子量:
H 1 Li 7 C 12 N 14 O 16 Na 23 Al 27 S 32 Cl 35.5
Fe 56 Cu 64 Zn 65 Br 80 Ag 108 I 127
一、单项选择题(本题包括8小题,每小题4分,共32分。每小题只是一个选项符合题意)
1.下列有关胶体的说法中正确的是
A.胶体都是均匀透明的液体
B.丁达尔现象可以鉴别胶体和溶液
C.电泳现象能证明胶体微粒比溶液中溶质微粒直径大
D.纳米材料的微粒直径一般在几纳米到几十纳米,因此纳米材料是胶体。
2.2000年5月,保利集团在香港拍卖会上花费3000多万港币购回在火烧圆明园时流失的
国宝:铜铸的牛首、猴首和虎首。普通铜器时间稍久容易出现铜绿,其主要成分是
![]() 。这三件1760年铜铸的国宝在240年后看上去仍然熠熠生辉不生锈,下列对其原因的分析,最可能的是
。这三件1760年铜铸的国宝在240年后看上去仍然熠熠生辉不生锈,下列对其原因的分析,最可能的是
A.它们的表面都电镀上一层耐腐蚀的黄金
B.环境污染日趋严重,它们表面的铜绿被酸雨溶解洗去
C.铜的金属活动性比氢小,因此不易被氧化
D.它们是含一定比例金、银、锡、锌的铜合金
3.下列说法正确的是
A.全部由非金属元素形成的化合物中只含有共价键
B.分子晶体的熔点较低,因为分子晶体中有化学键
C.金属在常温下都以晶体形成存在
D.金属晶体中,自由电子几乎均匀分布在整个晶体中,被许多金属离子共用
4.强酸和强碱稀溶液的中和热可表示为:
H+(aq)+ OH-(aq)= H2O(1); ΔH = -57.3KJ·mol-1
已知:CH3COOH(aq)+ NaOH(aq)= CH3COONa(aq)+ H2O(1); ΔH1
1/2 H2SO4(浓)+ NaOH(aq)= 1/2 Na2SO4(aq)+ H2O(1); ΔH2
HNO3(aq)+ KOH(aq)= KNO3(aq)+ H2O(1); ΔH3
上述反应物除已注明的外均为稀溶液,则ΔH 1、ΔH 2、ΔH 3的关系正确的是
A.ΔH 1=ΔH2=ΔH 3 B.ΔH 2 <ΔH 1 <ΔH 3
C.ΔH 2 < ΔH 3 <ΔH1 D.ΔH 2=ΔH 3 <ΔH 1
5.已知Cu+2Fe3+=2Fe2++Cu2+,Zn+2Fe3+=2Fe2++Zn2+.现把等物质的量的CuSO4、FeCl3和Zn置于水中充分反应,反应容器中除SO42-和Cl-外还含有
A.Zn2+、Cu、Fe3+ B.Zn、Cu2+、Fe3+
C.Zn2+、Cu2+、Fe、Fe2+ D.Zn2+、Cu、Cu2+、Fe2+
6.工业上由二氧化锰制备高锰酸钾可分二步进行,第一步将二氧化锰与氢氧化钾共熔并通入氧气:2MnO2 + 4KOH +O2 ![]() 2K2MnO4 +2H2O;第二步:电解锰酸钾溶液:2K2MnO4
+H2O
2K2MnO4 +2H2O;第二步:电解锰酸钾溶液:2K2MnO4
+H2O![]() 2KMnO4 +H2↑ +2 KOH 下列说法叙述正确的是
2KMnO4 +H2↑ +2 KOH 下列说法叙述正确的是
A.在上述相应条件下氧化性:KMnO4 >K2MnO4 >O2
B.根据上述过程,每生成1molKMnO4共转移6mol电子
C.第二步电解时,KMnO4在阳极区生成
D.第二步电解时阴极周围pH减小
7.某金属硝酸盐在受热分解时生成了金属氧化物、二氧化氮与氧气,且产物中NO2与O2的体积比为6∶1(同温同压下测得),试分析该硝酸盐分解时金属化合价的变化情况是
A.升高 B.降低
C.不变 D.不能确定
8.下列离子反应方程式正确的是
A.小苏打溶液中加入过量石灰水2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O
B.氯化铝溶液中加入过量氨水Al3++3NH3·H2O=Al(OH)3↓+3NH4+
C.氯化亚铁溶液中通入氯气Fe2++Cl2=Fe3++2Cl-
D.苛性钾溶液中加入稀醋酸H++OH-=H2O
二、不定项选择题(本题包括8小题,每题4分,共32分。每题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就为0分)
9.有关接触法制硫酸,下列说法中不正确的是
A.用硫和硫铁矿均可为原料
B.SO2转化为SO3需要催化剂和加热条件下进行
C.SO3可用水直接吸收
D.向胶体中加入电解质一定能使胶体聚沉
10.向盛有NaHSO4溶液的烧杯中不断滴加Ba(OH)2溶液,随着Ba(OH)2的不断滴入,溶液中产生的沉淀量与溶液的PH变化情况正确的是
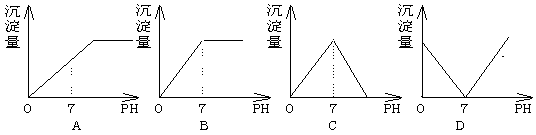
A
11.下列关于铜电极的叙述正确的是:
A.铜锌原电池中铜是正极
B.用电解法精炼粗铜时粗铜作阴极
C.在镀件上电镀铜时可用金属铜作阳极
D.电解稀硫酸制H2、O2时铜作阳极
12.SO42-和 S2O82-结构中,硫原子均位于由氧原子组成的四面体的中心,且所有原子的最外层电子均满足8电子结构。下列说法正确的是
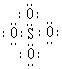
A.SO42-的电子式为
B.S2O82-中没有非极性键
C.S2O82-比SO42- 稳定
D.S2O82-有强氧化性
13.破坏1mol化学键所需要的能量叫键能。下列物质性质的变化规律,与共价键的键能大小有关的是
A.F2、Cl2、Br2、I2的熔沸点逐渐升高
B.HF、HCl、HBr、HI的热稳定性依次减弱
C.金刚石的硬度、熔点、沸点都高于晶体硅
 D.NaF、NaCl、NaBr、NaI的熔点依次降低
D.NaF、NaCl、NaBr、NaI的熔点依次降低
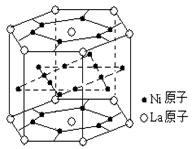
14.氢气是重要而洁净的能源,要利用氢气作能源,必须安全有效地储存氢气。有报道称某种合金材料有较大的储氢容量,其晶体结构的最小单元如右图所示。则这种合金的化学式为
A.LaNi6 B.LaNi3
C.LaNi4 D.LaNi5
15.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:
![]() 3Zn + 2K2FeO4 + 8H2O 3Zn(OH)2 + 2Fe(OH)3
+ 4KOH
3Zn + 2K2FeO4 + 8H2O 3Zn(OH)2 + 2Fe(OH)3
+ 4KOH
下列叙述不正确的是
A.放电时负极反应为:Zn — 2e— + 2OH— == Zn(OH)2
B.充电时阳极反应为:Fe(OH)3 — 3e— + 5OH— == FeO42— + 4H2O
C.放电时每转移3moL电子,正极有1 mol K2FeO4被氧化
D.放电时正极附近溶液的碱性增强
16.用惰性电极和串联电路电解下列物质浓溶液①HCl ②NaNO3 ③CuCl2 ④AgNO3,在相同时间内生成气体总体积(相同状况)在理论上由多到少的顺序是
A.④③②① B.①②③④ C.①③②④ D.③④①②
三、(本题包括2小题,共18分)
17.(10分)(1) 下列有关实验操作或判断不正确的是 _________(填有关序号,选错倒扣分)。
 A.用10 mL量筒量取稀硫酸溶液 8.0 mL
A.用10 mL量筒量取稀硫酸溶液 8.0 mL
B.用干燥的pH试纸测定氯水的pH
C.用碱式滴定管量取KMnO4溶液 19.60 mL
D.使用容量瓶配制溶液时,俯视液面定容后所得溶液的浓度偏大
E.圆底烧瓶、锥形瓶、蒸发皿加热时都应垫在石棉网上
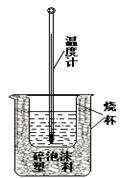
(2)实验室利用如右图装置进行中和热的测定。
回答下列问题:
①该图中有两处未画出,它们是 、 ;
②在操作正确的前提下提高中和热测定的准确性的关键是 ;
③如果用0.5 mol/L的盐酸和氢氧化钠固体进行实验,则实验中所测出的“中和热”将
(填“偏大”、“偏小”或“不变”);
原因是 。
18.(8分)在足量的稀氯化亚铁溶液中,加入1~2滴液溴,振荡后溶液变为黄色。
(1)甲同学认为这不是发生化学反应所致,使溶液变黄色的物质是: (填粒子的化学式,下同);乙同学认为这是发生化学反应所致,使溶液变黄的物质是 。
(2)现提供以下试剂:A.酸性高锰酸钾溶液 B.稀硝酸
C.四氯化碳 D.硫氰化钾溶液
甲和乙推断正确的是 ,用合适的方法加以验证,写出选用的试剂(限上述提供的试剂)及实验中观察到的现象。 。
(3)若选用淀粉碘化钾溶液来判断哪位同学的推断是正确的,你认为是否可行? ,
理由是:
四、(本题包括2小题,共20分)
19.(10分)(1)1mol气态钠离子和1mol气态氯离子结合生成1mol氯化钠晶体释放出的热能为氯化钠晶体的晶格能。
①下列热化学方程中,能直接表示出氯化钠晶体的晶格能的是 。
A.Na+(g)+Cl-(g) NaCl(s);△H B.Na(s)+1/2Cl2(g) NaCl(s); △H1
C.Na(s) Na(g); △H2 D.Na(g)-e- Na+(g); △H3
E.1/2Cl2(g) Cl(g); △H4 F.Cl(g)+e- Cl-(g); △H5
②写出△H与△H1、△H2、△H3、△H4、△H5之间的关系式
。
(2)如右图为氯化钠晶体的结构模型,氧化亚铁晶体结构与氯化钠晶体结构相似,则:
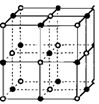 ①氧化亚铁晶体中,跟二价铁离子紧邻且等距的二价铁离子
①氧化亚铁晶体中,跟二价铁离子紧邻且等距的二价铁离子
个数是 。
②设阿伏加德罗常数值为NA,若氧化亚铁的密度为![]() ,
,
则氧化亚铁晶体中二价铁离子与氧离子之间最近距离
是 cm(用代数式表示)
③若氧化亚铁晶体中有3n个二价铁离子被2n个三价铁离子所替代,该晶体中氧
 离子的数目将______ (填“减少”、“增多”或“保持不变”)。
离子的数目将______ (填“减少”、“增多”或“保持不变”)。
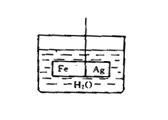
20.(10分)(1)在装有水的烧杯里,用细线挂一个呈水平方向的由Fe和Ag焊接成的圆柱棒,如右图。
①向烧杯中加入CuSO4溶液后,忽略溶液密度的变化,看到的现象是
。
②发生上述变化的电极反应式是 。
(2)已知HCO3-比HBrO更难电离,但HBrO的酸性弱于H2CO3。写出下列反应的离子方程式:①向小苏打溶液中滴加少量溴水: ;
②向苏打溶液中滴加少量溴水: 。
五、(本题包括1小题,共8分)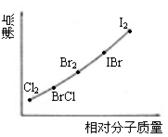
21(8分) 卤素互化物是指不同卤素原子之间以共价键结合形成的化合物,XX’型卤素互化物与卤素单质结构相似、性质相近。试回答下列问题:
⑴卤素互化物BrCl能发生下列反应
H2O+BrCl===HBrO+HCl
KBr+BrCl===KCl+Br2
①写出KI与IBr反应的化学方程式_____________ _。
②取代反应前后各元素的化合价一般不变。试写出苯与(C6H6)与ICl发生取代反应生成一卤代物的化学方程式________________ _。
⑵右上图是部分卤素单质和XX’型卤素互化物的沸点与其相对分子质量的关系图。它们的沸点随着相对分子质量的增大而升高,其原因是_______ _______。
⑶试推测ICl的沸点所处的最小范围______ ________。
六、(本题包括2小题,共20分)
22.(10分)A、B、C、D、E都是短周期元素,原子序数依次增大,B、C同周期,A、D同主族。A、B能形成两种液态无机化合物甲和乙,原子个数比分别为2∶1和1∶1。根据以上信息回答下列问题:
⑴甲、乙两分子中含有非极性共价键的物质的电子式是______________________,
C元素在周期表中的位置是__________________。
⑵C和D的离子中,半径较小的是__________(填离子符号)。
⑶将D的单质投入甲中,待D消失后再向上述溶液中加入E的单质,此时发生反应的化学方程式是______________________________________________________。
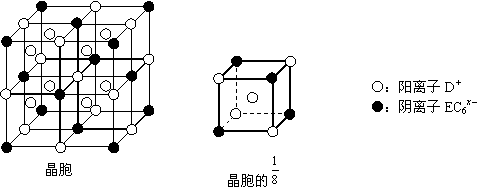
⑷C、D、E可组成离子化合物DxEC6,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如下图所示,阳离子D+(用○表示)位于正方体的棱的中点和正方体内部;阴离子EC6x_(用●表示)位于该正方体的顶点和面心。
该化合物的化学式是____ _____。
 |
23.(10分)已知A、B、C、D、E为中学化学常见物质,A、B、C、D、E中均含有同一种元素,A、C均为气体,E为液体,下图中箭头上的反应物和反应条件均已略去。
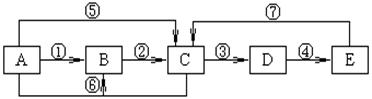
(1)当A与E发生化合反应时,能观察到空气中形成大量的白烟,则A、E共同含有甲元素。由此可知:E的化学式为 。
当小心加热A与E化合时的生成物F时,可得到一种无色无味的气体G(G和CO2具有相同的原子数目和电子数目,即G和CO2互称为等电子体)和一种无色无味的液体H,写出F分解生成G+H的化学方程式 _____ 。
(2)当A与E反应生成B和C时,则A、E共同含有乙元素。生成的C气体易液化。常温常压下D是气体,D被冰水冷却时变成无色晶体,此无色晶体的化学式是 。根据所学的氧化还原反应知识判断:在A~E各物质中,在一定条件下能与D发生氧化还原反应的物质有 (填字母)。D溶于纯净的E时,能按物质的量比1:1化合,生成物的化学式可表示为 (写成化合物、复合物或氧化物形式均可)。
七、(本题包括2小题,共20分)
24.(10分)100.0g无水氢氧化钾溶于100.0g水。在T温度下电解该溶液,电流强度I=6.00A,电解时间10.00h。电解结束温度重新调至T,分离析出的KOH·2H2O固体后,测得剩余溶液的总质量为164.8g。已知不同温度下每100g氢氧化钾饱和溶液中氢氧化钾的质量为:(已知电子的电量为1.6×10-19c)
| 温度/℃ | 0 | 10 | 20 | 30 |
| KOH/g | 49.2 | 50.8 | 52.8 | 55.8 |
(1)被电解的水的物质的量为_ mol.;
(2)计算电解后剩余溶液的质量分数;
(3)温度T为 。(填范围)
25.(10分)将22.4g铜粉与氧化铁混合物粉末加入浓度为1mol/L的硫酸溶液中进行反应。
(1) 若混合粉末恰好全部溶解,消耗硫酸溶液的体积为VL,求V的最小值。
(2) 若硫酸溶液过量,反应后溶液的体积为1L,测得此溶液中Fe2+离子浓度为0.l mol/L。求此混合物中铜粉的质量。
化学试题参考答案
一、二、选择题(共64分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | B | D | D | C | D | C | A | B |
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 | CD | A | AC | D | BC | D | C | B |
三、(本题包括2小题,共18分)
17.(1)BCE (2)① 环形玻璃棒 烧杯上方的泡沫塑料盖或硬纸板盖
② 提高装置的保温效果 ③偏大 固体NaOH溶于水放热
18.(1)Br2;Fe3+ (2)乙正确,在溶液中滴加四氯化碳,振荡,四氯化碳无色(或在溶液中滴加硫氰化钾溶液,溶液变红色)(3)不可行,因为Br2和Fe3+都能把I—氧化成I2
四、(本题包括2小题,共20分)
19、(1)①A或△H ②△H1=△H+△H2+△H3+△H4+△H5
(2)①12
②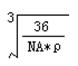 ③保持不变
③保持不变
20.⑴①Fe一端升高,Ag一端降低,同时Fe端逐渐溶解,Ag端有红色物质析出,水溶液颜色逐渐变浅;②Fe-2e-=Fe2+ Cu2++2e-=Cu
(2)① HCO3-+Br2==HBrO+Br-+CO2↑ ;② 2CO32_+Br2+H2O==2HCO3-+Br-+BrO-
五、(本题包括1小题,共8分)
21.(1)①KI+IBr======KBr+I2
②![]()
(2)相对分子质量越大,分子间作用力越强 (3)介于Br2的沸点和IBr的沸点之间
六、(本题包括2小题,共20分)
22.⑴![]() 第二周期、第ⅦA族 ⑵ Na ⑶ 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ ⑷ Na3AlF6
第二周期、第ⅦA族 ⑵ Na ⑶ 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ ⑷ Na3AlF6
23.(1)HNO3,NH4NO3![]() N2O↑+2H2O(2)SO3,A和B,H2S2O7或H2SO4·SO3或2SO3·H2O
N2O↑+2H2O(2)SO3,A和B,H2S2O7或H2SO4·SO3或2SO3·H2O
七、(本题包括2小题,共20分)
24.⑴提供电量Q=2.16×105q,转移电子的物质的量n=![]() =2.24mol,被电解的水的物质的量为1.12mol,即20.1g ;⑵剩余溶液的总质量为164.8g,质量减少35.2g,其中被电解的水20.1g,所以,结晶析出的KOH·2H2O的质量为35.2g-20.1g=15.1g,求得电解后剩余溶液的质量分数为55.1%。⑶剩余溶液的质量分数为55.1%,查表可知,温度范围在20℃——30℃之间。
=2.24mol,被电解的水的物质的量为1.12mol,即20.1g ;⑵剩余溶液的总质量为164.8g,质量减少35.2g,其中被电解的水20.1g,所以,结晶析出的KOH·2H2O的质量为35.2g-20.1g=15.1g,求得电解后剩余溶液的质量分数为55.1%。⑶剩余溶液的质量分数为55.1%,查表可知,温度范围在20℃——30℃之间。
25.⑴ Vmin=0.3L ⑵ 铜完全反应时,m(Cu)=3.2g
当铜有剩余时,m(Cu)=14.4g