高三化学上学期第三次月考试卷
命题人 肖安庆
相对原子质量:H:1 C:12 N:14 O:16 Na:23 Cu:64
一、选择题(每题只有一个正确答案 共48分)
1.下列叙述正确的是 ( A )
A.含金属元素的离子不一定都是阳离子
B.在氧化还原反应中,非金属单质一定是氧化剂
C.某元素从化合态变为游离态时,该元素一定被还原
D.金属阳离子被还原后一定得到金属单质
2.下列有关碱金属元素及其化合物的叙述:①碱金属元素原子的次外层电子数是2或8;②碱金属元素位于元素周期表的第IA族;③碱金属的氯化物都是强电解质;④碱金属最高价氧化物的水化物都是强碱。其中正确的是 ( D )
A、只有② B、只有① C、只有①②④ D、①②③④
3.NA为阿伏加德罗常数的值,下列说法正确的是 ( C )
A. 32g铜作还原剂时失去的电子数为NA
B. 1.7g羟基所含电子数为NA
C.某气体的摩尔质量为M,则M÷NA是这种气体以克为单位的一个分子质量
D.在标准状况下,11.2LNO和11.2LO2 混合,气体分子总数为NA.
4..对于反应:H-+NH3===H2+NH2-,下列说法正确的是 ( D )
A.该反应属于置换反应 B.NH3是还原剂
C. NH2-是还原产物 D.若反应中有1 mol电子转移,必生成2 g H2
5.下列各组离子,在所给条件下能够大量共存的是 ( B )
A.在AlCl3溶液中,Na+、AlO![]() 、SO
、SO![]() 、NO
、NO![]()
B.pH=0的溶液中,Fe3+、Mg2+、Cl-、SO![]()
C.水电离出的c(H+)=1×10-10 mol·L-1的溶液中,K+、HCO![]() 、Cl-、S2-
、Cl-、S2-
D.使pH试纸显深蓝色的溶液中,Cu2+、Fe3+、NO![]() 、SO
、SO![]()
6.下列离子方程式中正确的是 ( C )
A. 漂白粉溶液中通入过量的二氧化碳
Ca2++2ClO-+CO2+H2O====CaCO3↓+2HClO+CO32-
B NH4HCO3溶液与过量NaOH溶液反应:NH4++OH- = NH3↑+H2O
C 苯酚钠溶液中通入少量CO2:![]() -O-+CO2+H2O
→
-O-+CO2+H2O
→ ![]() -OH+HCO3-
-OH+HCO3-
D FeBr2溶液中通入过量Cl2:2Fe2++2Br-+2Cl2 = 2Fe3++Br2+4Cl-
![]() 7.a、b、c、d、e是含有一种相同元素的5种物质,可发生如下转化:其中a是单质,b是气体,c、d是氧化物,e是最高价氧化物对应的水化物。则a不可能是
( D
)
7.a、b、c、d、e是含有一种相同元素的5种物质,可发生如下转化:其中a是单质,b是气体,c、d是氧化物,e是最高价氧化物对应的水化物。则a不可能是
( D
)
A、N2 B、S C、C D、Cl2
8.在化学研究中,溶液组分的表示还有两种方法 ( B )
①质量物质的量浓度=![]() ②物质的量分数=
②物质的量分数=![]()
在某温度范围内,溶液的状态不发生变化。下列溶液组分表示方法中受温度影响的是
A.质量分数 B.物质的量浓度
C.质量物质的量浓度 D.物质的量分数
9.配制一定物质的量浓度的溶液,可能用到的仪器和用品是 ( A )
①天平 ②量筒 ③烧杯 ④玻璃棒 ⑤等同纸 ⑥胶头滴管
⑦容量瓶 ⑧药匙 ⑨烧瓶
A.①②③④⑤⑥⑦⑧ B.全部
C.②③④⑥⑦ D.①③⑤⑦⑨
10.在甲、乙、丙、丁四个烧杯内放入0.1![]() 的钠、氧化钠、过氧化钠和氢氧化钠,然后各加入100
的钠、氧化钠、过氧化钠和氢氧化钠,然后各加入100![]() 水,搅拌,使固体完全溶解,则甲、乙、丙、丁所得溶液里溶质的质量分数大小的顺序是
( B )
水,搅拌,使固体完全溶解,则甲、乙、丙、丁所得溶液里溶质的质量分数大小的顺序是
( B )
A.甲<乙<丙<丁 B. 丁<甲<乙=丙 C. 甲=丁<乙=丙 D.丁<甲<乙<丙
11.下列关于卤素的叙述,正确的是 ( A )
A、单质的颜色随核电荷数的增加逐渐加深
B、氢化物的稳定性随核电荷数的增加逐渐增强
C、单质与水反应均可表示为X2+H2O ====HX+HXO
D、随核电荷数的增加X-的半径递增,还原性递减
12.海带中含碘元素,有人设计如下步骤来提取碘:①通足量氯气 ②将海带烧成灰,向灰中加水搅拌 ③加入CCl4振荡 ④过滤 ⑤用分液漏斗分液。合理的操作顺序为
( A )
A.②一④一①一③一⑤ B.②一①一③一④一⑤
C.①一③一⑤一②一④ D.③一①一②一⑤一④
13.在下列条件下,两种气体的分子数一定相等的是 ( C )
①同质量不同密度的N2和C2H4 ② 同温度同体积的O2和N2
③同体积同密度的CO和C2H4 ④ 同压强同体积的N2和O2
A ①② B ①④ C ①③ D ①②③
14.已知![]() ,
,![]()
![]() ,
,![]()
某![]() 和
和![]() 的混合气体完全燃烧时放出113.74KJ的热量,同时生成3.6g液态水,则原混合气体中
的混合气体完全燃烧时放出113.74KJ的热量,同时生成3.6g液态水,则原混合气体中![]() 和
和![]() 的物质的量之比为
(C )
的物质的量之比为
(C )
A.2:1 B.1:2 C.1:1 D.2:3
15.下列反应过程中,同时有离子键、极性共价键和非极性共价键的断裂和形成的反应(B )
A. NH4Cl![]() NH3+HCl B. 2Na2O2+2CO2=2Na2CO3+O2
NH3+HCl B. 2Na2O2+2CO2=2Na2CO3+O2
C. NH3+CO2+H2O =NH4HCO3 D. 2NaOH+Cl2=NaCl+NaClO+H2O
16.往含0.2 mol NaOH和0.1 mol Ca(OH)2的溶液中持续稳定地通入CO2气体,当通入气体
体积为6.72 L(标准状况)时立即停止,则这一过程中,溶液中离子数目和通入CO2气体的
体积关系正确的图象是(气体的溶解忽略不计) ( C )
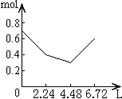
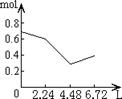
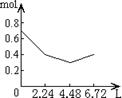
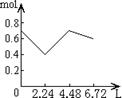
A B C D
二、填空(共31分)
17、(7分) 在新制氯水中的各种微粒中,(1)使氯水呈黄绿色的是 (用化学式或离子符号填写,下同) ;(2)能使AgNO3溶液产生白色沉淀的是 ;(3)能使紫色石蕊试液显红色的是 ;(4)能使红纸褪色的是 ;(5)能使无水CuSO4变蓝的是 ;(6)能与NaHCO3溶液反应放出气体的是 ;(7)能使KI溶液变褐色的是
18、(8分)今有Cl2、Fe、盐酸、Fe(NO3)2溶液,漂白粉固体作反应物,发生氧化—还原反应。请按下列要求写出反应的离子方程式
(1)一种单质氧化一种阳离子 _________________________
(2)一种单质还原一种阳离子 _________________________
(3)一种阴离子氧化一种阳离子 _______________________
(4)一种阴离子氧化一种阴离子生成一种单质气体 _________________________________
19、(6分)将100ml 0.3mol/L的NaHSO4溶液和100ml 0.2mol/L的Ba(OH)2溶液充分混合,写出所发生的离子方程式:
若向反应后的溶液中滴加2~3滴酚酞试液,则溶液的颜色变为 色,若向反应后的溶液中继续滴加0.2mol/L的Ba(OH)2溶液,此时反应的离子方程式为
(若无离子反应发生,此空不填)
20、(10分)A、B、C、D为四种单质,常温时A、B为固体,C、D为气体,E、F、G、H、I为五种化合物,A与B反应产物E不溶于水,C与D反应产物F为气体且极易溶于水得无色溶液,B与C反应产物为H溶于水得黄色溶液,其反应转化关系如图所示
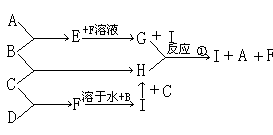 |
(1)根据上述反应及转化关系,判断A、B、C、D四种单质(填化学式)
A _______ B ________ C ________ D ________
(2)反应①的离子方程式 _____________
三、实验题(14分)
21.过氧化钠是一种淡黄色固体,它能与二氧化碳反应生成氧气,在潜水艇中用作制氧剂,供人类呼吸之用.它与二氧化碳反应的化学方程式为: 2Na2O2 + 2CO2=2Na2CO3 + O2 。某学生为了验证这一实验,以足量的大理石、足量的盐酸和1.95克过氧化钠样品为原料,制取O2,设计出如下实验装置:
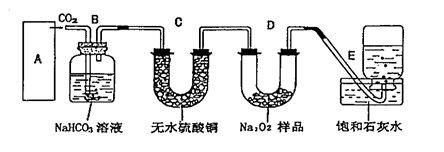
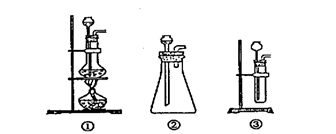 |
(1)(4分)A中制取CO2 的装置,应从下列图①、②、③中选哪一个图:
B装置的作用是吸收A装置中产生的盐酸酸雾,C装置内可能出现什么现象?
。为了检验E中收集到的气体,在取出集气瓶后,用 的木条伸入集气瓶内,木条会出现 。
(2)(2分)若E中石灰水出现轻微白色浑浊,请说明原因: 。
(3)(2分)当D中的1.95克过氧化钠样品接近反应完毕时,你预测E装置内有何现象?
。
(4)(4分)反应完毕时,若测得E中的集气瓶收集到的气体为250毫升,又知氧气的密度为1.43克/升,当装置的气密性良好的情况下,实际收集到的氧气体积比理论计算值 (大或小),(取整数值,所用数据均在标准状况下测定),这是由于
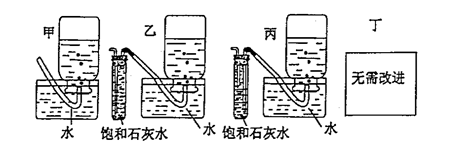 |
(5)(2分)你认为上述A---E的实验装置中,E部分是否安全、合理? ;E是否需要改为下列四项中的哪一项: 。(用甲、乙、丙、丁回答)
四、计算(7分)
22、将amol的H2和C12的混合气体于密闭容器中点燃,充分反应后用足量的NaOH溶液吸收,消耗bmol NaOH。
(1)请填下表:
| H2和C12量的关系 | 生成NaCl的物质的量/mol |
| H2和C12恰好完全反应 | |
| H2的物质的量>C12的物质的量 | |
| H2的物质的量<C12的物质的量 |
答案
17.(7分) (1)C12 (2)Cl一 (3)H+ (4)HCIO (5)H2O (6)H+ (7)Cl2
18、(8分)答案(1)![]() (2)
(2)![]()
(3)![]()
(4)![]()
20(10分)答案、S、Fe、Cl2、H2,![]()
21、(14分)(1)②;白色固体变蓝色;带有余烬;复燃。
(2)未反应的二氧化碳与石灰水反应所致。
(3)由于生成氧气的量减少,E中可能会因二氧化碳与石灰水反应而倒吸。
(4)小;30;Na2O2可能含有其它杂质;D装置可能有氧气未被排出。。。。
(5)不安全,不合理;乙。
22.(7分)分析:有关反应:H2+C12====2HCl
HCl+NaOH==NaCl+H2O 若Cl2有剩余,则还有:
Cl2+2NaOH===NaCl+NaClO+H2O
(1)(2分)若C12、H2恰好完全反应 n(C12)=n(H2)=![]() mol。生成NaCl a rnol或b mol
mol。生成NaCl a rnol或b mol
(2)(2分)若V(Cl2)<V(H2) Cl2最终全部转化为NaCl, n(NaC1)===(NaOH)=b mo1.
(3)(3分)若n(C12)>n(H2) 设H2物质的量为x,则有:
H2+Cl2===2HCl
1 1 2
x x 2x n(HCl)=n(NaCl)=2x mol
C12 + 2NaOH===NaCl+NaClO+H2O
1 1
a-2x n(NaCl) n(NaCl)=( a-2x)mol
共生成,n(NaCl)=2x+( a-2x)=amol