高三化学上学期第三次考试试题
命题人:吴 健
可能用到的相对原子质量:H-1 C-12 O-16 Na-23 Cl-35.5 K-39 Mn-55
第I卷(共80分)
一、选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意。)
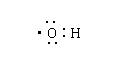
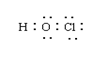 1.下列化学用语表示错误的是
1.下列化学用语表示错误的是
A.次氯酸电子式 B.羟基电子式
![]()
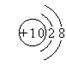
C.镁离子结构示意图 D.氨分子空间结构
2.在下列各说法中,正确的是
A.△H > 0 kJ·mol-1表示放热反应,△H < 0 kJ·mol-1表示吸热反应
B.热化学方程式中的化学计量数表示物质的量,可以是分数
C.1 mol H2SO4与1 molBa(OH)2反应生成BaSO4沉淀时放出的热叫做中和热
D.1 mol H2与0.5 molO2反应放出的热就是H2的燃烧热
3.最近有人用一种称为“超酸”的化合物H(CB11H6Cl6) 和C60反应,使C60获得一个质子,得到一种新型离子化合物[HC60]+[CB11H6Cl6]-。这个反应看起来很陌生,但反应类型上却可以跟下列一个化学反应相似,你认为该反应是
A.NH3 + HCl = NH4Cl B.NaOH + HCl = NaCl + H2O
C.Mg +2HCl = MgCl2 + H2↑
D.H2O
+CH3COOH ![]() H3O+ +CH3COO -
H3O+ +CH3COO -
4.X、Y两种元素形成含氧酸A和B,能说明酸A比酸B的酸性强的是
A.酸A中X的化合价比酸B中Y化合价高
B.酸A中X与酸B中Y在同一周期,且X在Y之后
C.酸A能与酸B的铵盐溶液反应生成酸B
D.酸A具有强氧化性,酸B没有强氧化性
5. 下列有关化学反应速率和化学平衡的说法正确的是
A.用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可以加快产生氢气的速率
B.二氧化硫的催化氧化是一个放热的反应,所以升高温度可以减慢该反应的速率
C.FeCl3溶液和KSCN溶液反应后,加入少量KCl晶体,溶液的血红色深浅不变
D.100mL2mol/L的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变
6.下列说法中,可以证明反应N2+3H2![]() 2NH3已达到平衡状态的是
2NH3已达到平衡状态的是
A.1 个N≡N 键形成的同时,有3 个H-H键形成
B.1 个N≡N 键断裂的同时,有3 个H-H键断裂
C.1 个N≡N 键断裂的同时,有6 个N-H键形成
D.1个N≡N键断裂的同时,有6个N-H键断裂
7.某温度下,C和水在密闭容器中发生下列反应: C(s)+H2O(g) ![]() CO(g)+H2(g),
CO(g)+H2(g),
CO(g) + H2O(g) ![]() CO2(g) + H2(g) 当反应达平衡时,测得c(H2)=1.9mol/L,
c(CO)=
0.1mol/L,则CO2的浓度为
CO2(g) + H2(g) 当反应达平衡时,测得c(H2)=1.9mol/L,
c(CO)=
0.1mol/L,则CO2的浓度为
A.0.1mol/L B. 0.9mol/L C. 1.8mol/L D. 1.9mol/L
8.在密闭容器中,对已达到化学平衡的反应:2A(g) + B(g) ![]() 2C(g);△H<0,其他条件不变,则下列说法中正确的是①升高温度时c(B)/c(C)的比值变小 ②降低温度时,体系内混合气体的平均式量变小 ③加入B后,A的转化率增大 ④加入催化剂,气体总的物质的量不变
2C(g);△H<0,其他条件不变,则下列说法中正确的是①升高温度时c(B)/c(C)的比值变小 ②降低温度时,体系内混合气体的平均式量变小 ③加入B后,A的转化率增大 ④加入催化剂,气体总的物质的量不变
⑤加入C后,则A、B的物质的量均增大
A.②③⑤ B.③④⑤ C.①②③⑤ D.全部
二、选择题(本题包括12小题,每小题4分,共48分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给满分,但只要选错一个该小题就为0分。请将所选答案填入答题卡内)
9.在化学上,常用一条短线表示一个化学键。在如图所示的结构中,直线不表示化学键或不完全表示化学键的是

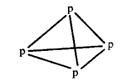
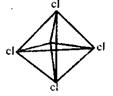
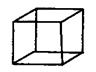
A.石墨 B.白磷 C.CCl4 D.C8H8(立方烷)
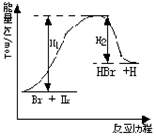 10.参照反应Br + H2
10.参照反应Br + H2![]() HBr +H的能量(kJ/mol)对反应历程的示意图,下列叙述中正确的
HBr +H的能量(kJ/mol)对反应历程的示意图,下列叙述中正确的
A. 正反应为吸热的
B. 加入催化剂,该化学反应的反应热不变
C. H2是含有非极性键的共价化合物
D. Br元素位于元素周期表中第三周期VIIA族
11.做实验时不小心粘了一些高锰酸钾,皮肤上的黑斑很久才能消除,如果用草酸稀溶液洗涤马上可以复原,其离子方程式为:MnO4—+C2O42—+H+→CO2↑+Mn2++![]() 。关于此反应的叙述正确的是
。关于此反应的叙述正确的是
A.该反应的还原剂是C2O42— B.该反应右边方框内的产物是OH—
C.该反应电子转移总数是5e- D.配平该反应后,H+的系数是8
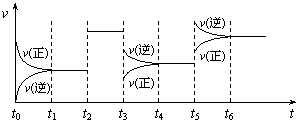 12.某密闭容器中发生如下反应:X(g)+3Y(g)
12.某密闭容器中发生如下反应:X(g)+3Y(g)![]() 2Z(g);ΔH<0右图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是
2Z(g);ΔH<0右图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是
A.t2时加入了催化剂 B.t3时降低了温度
C.t5时增大了压强 D.t4~t5时间内转化率最低
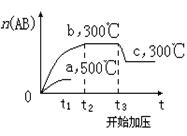 13.可逆反应:A2(?)+B2(?)
13.可逆反应:A2(?)+B2(?)![]() 2AB(?);ΔH=-QkJ/mol,当温度和压强改变时n(AB)的变化如右图(500℃时的变化曲线有部分省略,其走向与300℃时相似),下列叙述正确的是
2AB(?);ΔH=-QkJ/mol,当温度和压强改变时n(AB)的变化如右图(500℃时的变化曲线有部分省略,其走向与300℃时相似),下列叙述正确的是
A.A2、B2及AB均为气体,Q>0
B.AB为气体,A2、B2至少有一种为非气体,Q>0
C.AB为气体,A2、B2有一种为非气体,Q<0
D.AB为固体,A2、B2有一种为非气体,Q>0
14.某无色溶液与NH4HCO3作用能产生气体,此溶液中可能大量共存的离子组是
A.Cl-、Mg2+、H+、Zn2+、SO42- B.Na+、Ba2+、NO3-、OH![]() 、SO42-
、SO42-
C.MnO4-、K+、Cl-、H+、SO42- D.K+、NO3-、SO42-、OH-、Na+
15.下列离子反应方程式正确的是
A.硫代硫酸钠溶液加入硫酸溶液中:S2O32—+2H+ = S↓+SO2↑+H2O
B.二氧化硫气体通入过量Ca(ClO)2溶液中:
SO2+H2O+Ca2++2ClO— = CaSO3↓+2HClO
C.在碳酸氢钠溶液中加入足量澄清石灰水:
2HCO3—+Ca2+ +2OH— = CO32—+CaCO3↓+2H2O
D.KHS的水解:HS—+H2O ![]() H3O+ + S2—
H3O+ + S2—
16.对可逆反应4NH3(g)+ 5O2(g)![]() 4NO(g)+ 6H2O(g),下列叙述正确的是
4NO(g)+ 6H2O(g),下列叙述正确的是
A.化学反应速率关系是:2υ正(NH3)= 3υ正(H2O)
B.若单位时间内生成x mol NO的同时,消耗x mol NH3 ,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减少,逆反应速率增大
D.达到化学平衡时,4υ正(O2)= 5υ逆(NO )
17.某温度下,在一容积可变的密闭容器里,反应2A(g) ![]() B(g) + 2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol、4mol。在保持温度和压强不变的条件下,下列说法正确的是
B(g) + 2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol、4mol。在保持温度和压强不变的条件下,下列说法正确的是
A.充入1mol稀有气体氦(He),平衡将向正反应方向移动
B.充入A、B、C各1mol,平衡将向正反应方向移动
C.将A、B、C各物质的量都减半,C的百分含量不变
D.加入一定量的A气体达平衡后,C的百分含量一定增加
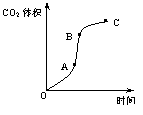 18.某学生用优质大理石与稀盐酸反应制取CO2,实验结果表示如下图,对于图中曲线的叙述中正确的是
18.某学生用优质大理石与稀盐酸反应制取CO2,实验结果表示如下图,对于图中曲线的叙述中正确的是
A.AB段表示反应速率最快,因产物中的CaCl2可能有催化作用,且反应为放热反应
B.BC段表示反应速率最快,在该时间内收集到的气体最多
C.OC段表示随时间增加,反应速率逐渐增大
D.OC段表示反应产物中气体体积随时间的变化关系
19.一定温度下,在恒容密闭容器中发生如下反应:2A(g) + B(g)![]() 3C(g),若反应开始时充入2 mol A和2 mol B,达平衡后A的体积分数为a%。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数小于a%的是
3C(g),若反应开始时充入2 mol A和2 mol B,达平衡后A的体积分数为a%。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数小于a%的是
A.2 mol C B.2 mol A、1 mol B和1 mol He(不参加反应)
C.1 mol B和1 mol C D.2 mol A、3 mol B和3 mol C
20.某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中P表示压强,T表示温度,n表示物质的量):
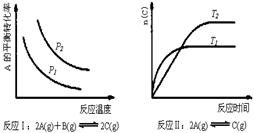
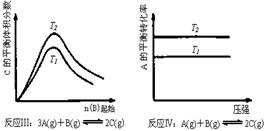
根据以上规律判断,下列结论正确的是(选项中的△H表示正反应的反应热)
A.反应Ⅰ:△H>0,P2>P1
B.反应Ⅱ:△H<0,T1>T2
C.反应Ⅲ:△H>0,T2>T1;或△H<0,T2<T1
D.反应Ⅳ:△H<0,T2>T1
高三化学第三次考试
第II卷(共70分)
三、(本题包括2小题,共22分)
21.(8分)在一个固定体积的密闭容器中,向容器中充入2 mol A和1 mol B,发生如下反应:2A(g) + B(g) ![]() 3C(g) + D(s),反应达到平衡时C的浓度为1.2 mol/L。
3C(g) + D(s),反应达到平衡时C的浓度为1.2 mol/L。
⑴若使容器温度升高,平衡时混合气体的平均相对摩尔质量减小,则正反应为________(填“吸热”或“放热”)反应。
⑵若维持容器体积和温度不变,按下列方法加入起始物质,达到平衡时C的浓度仍为1.2 mol/L的是_________________________(用序号填空)
①4 mol A+2 mol B ②3mol C+1 mol D+l mol B
③3 mol C+2 mol D ④1.6 mol A+0.8 mol B+0.6 mol C
⑶某温度下,向容器中加入3 mol C和0.8 mo1 D,反应达到平衡时C的浓度仍为1.2 mol/L,则容器的容积V应大于_________L,小于________L。
22.(14分)有a、b 两个极易导热的密闭容器,a 保持容积不变,b 中的活塞可上下移动,以保持恒压。在相同条件下将3
mol A、1
mol B 分别同时混合于a、b 两容器中,发生反应:
3A(g)+B(g) ![]() 2C(g)+D(g)
2C(g)+D(g)
⑴达到平衡时,a 中A的浓度为 M mol·L-1,C 的浓度为 N mol·L-1;b 中 A 的浓度为m mol·L-1,C 的浓度为 n mol·L-1。则 M m;N n(填“>”或“<”或“=”)。
⑵保持温度不变,若按下列配比分别充入 a、b 两容器,达到平衡后,使 a 中 C 的浓度为 N mol·L-1的是 ;使 b 中 C 的浓度为 n mol·L-1的是 。
A.6 mol A+2 mol B B.3 mol A+2 mol C C.2 mol C+1 mol B+1 mol D
D.2 mol C+1 mol D E.1.5 mol A+0.5 mol B+1 mol C+0.5 mol D
⑶若将2 mol C和2 mol D充入 a 中,保持温度不变,平衡时A的浓度为 W mol·L-1,C 的浓度为Y mol·L-1,则 W 和M,Y 和 N 之间的关系为W M,Y N(填“>”或“<”或“=”)。
⑷保持温度不变,若将4 mol C和2 mol D充入a中,平衡时A的浓度为R mol·L-1,则 。
A.R=2M B.R<M C.M<R<2M D.R>2M
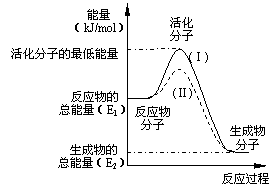 四、(本题包括4小题,共28分)
四、(本题包括4小题,共28分)
23.(10分)在化学反应中,只有极少数
能量比平均能量高得多的反应物分子发生
碰撞时才可能发生化学反应,这些分子称
为活化分子,使普通分子变成活化分子所
需提供的最低限度的能量叫活化能,其单
位通常用kJ/mol表示。请认真观察右图,
然后回答问题。
(1)图中所示反应是_________(填“吸热”或“放热”)反应,该反应________(填“需要”或“不需要”)加热,该反应的△H=___________________kJ/mol(用含E1、E2的代数式表示)。
(2)已知热化学方程式:H2(g)+ 0.5 O2(g)=H2O(g);△H=-241.8 kJ/mol
该反应的活化能为167.2 kJ/mol,则其逆反应的活化能为____________________。
(3)对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能大大降低,活化分子的百分数增多,反应速率加快,你认为最可能的原因是:___________________________。
24.(10分)在 763 K 3.04×104 kPa 时,用CO和H2为原料合成CH3OH,存在下列平衡:
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
当原料中H2和CO的比例不同时,对CO的转化率及平衡混合物中甲醇的体积分数都有影响。
| m | α | y |
| 1 | 0.25 | |
| 2 | 0.45 | |
| 3 | 19.35% |
⑴设H2和CO的起始物质的量之比为m,平衡时CO的转化率为α,平衡混合物中甲醇的体积分数为y,试推断m、α、y三者的相互关系,并以y=f (α,m)的函数表达式表示出来:
____________________________________________。
⑵将右表已知数据代入你导出的表达式中进行计算,把计算结果(保留至小数点后两位)填入右表中有关空格栏中:
⑶根据上表数据,判断用CO和H2合成甲醇时,H2和CO的最佳体积比是 。
25.(8分)向体积不变的密闭容器中充入2 mol N2和6 mol H2,一定条件下发生反应:
N2(气)+ 3 H2(气)![]() 2
NH3(气),平衡时混合气共7
mol.令a、b、c分别代表N2、H2、NH3起始加入的物质的量(mol),维持温度不变,使达到平衡时各成分的百分含量不变。
2
NH3(气),平衡时混合气共7
mol.令a、b、c分别代表N2、H2、NH3起始加入的物质的量(mol),维持温度不变,使达到平衡时各成分的百分含量不变。
(1)若a=0.7,b=2.1,则:
①c= 。
②这时反应向 方向进行(填“正反应”或“逆反应”) 。
③若要维持反应开始向该反应方向进行,c的范围是 。
(2)欲使起始反应维持向与(1)相反的方向进行,则b的范围是 。
五、(本题包括2小题,共20分。第26题必须写出计算过程,第27题不必写出计算过程)
26.(8分)将一定量的氯酸钾和高锰酸钾的固体混合物充分加热,得到1792mL气体(标况)。将剩余的固体分离(不考虑损耗),所得的黑色固体在强酸性条件下正好把分离得到的氯化物全部氧化。问原混合物中氯酸钾和高锰酸钾各多少g?
27.(12分)恒温下,将a mol N2与b
mol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应:N2(g)+3H2(g)![]() 2NH3(g)
已知:某时刻t时,n t(N2)=13
mol,n t(H2)= 7mol;反应达到平衡时,混合气体的体积为716.8L(标准状况下),其中NH3的含量(体积分数)为25% 。则
2NH3(g)
已知:某时刻t时,n t(N2)=13
mol,n t(H2)= 7mol;反应达到平衡时,混合气体的体积为716.8L(标准状况下),其中NH3的含量(体积分数)为25% 。则
(1)a = ___________。
(2)原混合气体的总物质的量与平衡混合气体的总物质的量之比(写出最简整数比,下同)n(始)∶n(平)=__________________。
(3)达到平衡时,N2与H2的转化率之比α(N2) ∶α(H2) = _______________。
(4)平衡混合气体中n(N2)∶ n(H2)∶n(NH3) = _______________________。
高三化学第三次考试
参考答案
一.(各4分)
1.C 2.B 3.A 4.C 5.C 6.D 7.B 8.B
二.(各4分)
9.AC 10.AB 11.A 12.A 13.B 14.AD 15.A 16.D 17.AC 18.AD
19.C 20.BC
三.
21. (8分)⑴吸热 ⑵③ ⑶0.5 2.5
22.(14分)⑴<;< ⑵D、E;A、D、E ⑶>,< ⑷C。
23. (10分)(1)放热 需要 —(E1—E2)kJ/mol
(2)409 kJ/mol (3)使用了催化剂
| m | a | y |
| 1 | 16.67% | |
| 2 | 21.43% | |
| 3 | 0.56 |
24.(10分)⑴![]() ⑵
⑵
⑶2:1。
25.(8分)(1)①2.6 ②逆反应 ③1<c≤4
(2)4.5<b≤6
26.(共8分)设分解的KMnO4的物质的量为x,分解的KClO3的物质的量为y
|
|
2KMnO4 == K2MnO4 + MnO2+ O2 2KClO3 ==2KCl +3O2↑
x 0.5x 0.5x y y 1.5y
|
MnO2 +4H+ +2Cl-===Mn2++ Cl2↑+ 2H2O
0.5x y
![]() 0.5x×2=y
0.5x×2=y
(0.5x+1.5y)×22.4L/mol=1.792L 解得 x=y=0.040mol
m(KMnO4)=6.32g m(KClO3)=4.90g
27.(12分)(1)18 (2)5∶4 (3)11∶27 (4)7∶5∶4