高三化学上学期第二次月考试卷
考生须知:
1.全卷分试卷Ⅰ、Ⅱ和答卷Ⅰ、Ⅱ,试卷共6页,有6大题25小题,满分为100分,考试时间100分钟。
2.本卷答案必须写在答卷Ⅰ、Ⅱ的相应位置上,直接做在试卷上无效。
3.请用钢笔或蓝、黑圆珠笔将班级、姓名、学号、试场号、座位号分别填写在答卷Ⅰ、Ⅱ的相应位置上。考试结束后只需上交答卷Ⅰ、Ⅱ,考试时不能使用计算器。
第Ⅰ卷(选择题,共32分)
一、选择题(每小题只有1个最佳选项符合题意,共16分)
1.近期北京大学的两位教授率先发现人体心肺血管中存在微量硫化氢,它对调节心血管功能具有重要作用。下列叙述正确的是
A.硫化氢分子很稳定,受热难分解
B.硫化氢分子中所有原子的最外电子层都达到8电子结构
C.将硫化氢通入溴水,溴水褪色
D.硫化氢是电解质,其电离方程式是H2S=2H++S 2-
2.氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过如下反应合成:
|
Al2O3 + N2 + 3 C === 2 AlN + 3 CO 下列叙述正确的是
A. 在氮化铝合成反应中,N2是还原剂,Al2O3是氧化剂
B. 氮化铝晶体属于分子晶体
C. 氮化铝中氮元素化合价为—3
D.上述反应中每生成2 mol AlN,N2得到3 mol电子
3.表示下列变化的化学用语正确的是
A.NaHCO3的水解:HCO3-+H2 O ![]() H3O++CO32-
H3O++CO32-
B.金属铝溶于NaOH溶液:Al+2OH- == A1O2-+H2↑
C.钢铁吸氧腐蚀的正极反应:4OH- -4e- == O2↑+2H2O
D.1 L0. 5 mol·L-1稀硫酸与1 L 1 mol·L-1氢氧化钠溶液反应放出57. 3kJ的热量:
H2SO4 (aq) + 2NaOH(aq) == Na2SO4 (aq) + 2H2O(1);△H=-114.6 kJ/mol
4.同位素示踪法可用于反应机理的研究,下列反应或转化中同位素示踪表示正确的是
|
B.2KMnO4 + 5H218O2 + 3H2SO4 == K2SO4 + 2MnSO4 + 518O2↑+ 8H2O
C.NH4Cl
+ 2H2O ![]() NH3·2H2O + HCl
NH3·2H2O + HCl
D.K37ClO3 + 6HCl == K37Cl + 3Cl2↑+ 3H2O
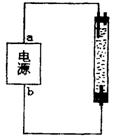
5.某学生想制作一种家用环保消毒液发生器,用石墨作电极电解饱和氯
化钠溶液。通电时,为使氯气被完全吸收制得有强杀菌能力的消毒液,设
计了如右图所示的装置,则对电源电极名称和消毒液的主要成分判断正确
的是
A.a为负极,b为正极;NaClO和NaCl B.a为正极,b为负极;NaClO和NaCl
C.a为阳极,b为阴极;NaClO和NaCl D.a为阴极,b为阳极;NaClO和NaCl
6.两种元素原子的核外电子层数之比与它们的最外层电子数之比相等,在周期表的前10号元素中满足上述关系的元素有
A.1对 B.2对 C.3对 D.4对
7.下列说法正确的是
A.含有离子键的化合物一定是离子化合物 B.共价化合物中只含有极性键
C.含有共价键的化合物一定是共价化合物 D.非极性键只存在于单质分子中
8.NA表示阿伏加德罗常数,下列说法正确的是
A.合成氨反应中,当断裂3NA个H-H共价键的同时生成6NA个N-H共价键,则该反应达到平衡
B.将分子总数为NA的NH3和HCl的混合气体置于标准状况下,其体积为22. 4L
C.在SiO2晶体中,若含有1 mol Si原子,则Si-O键数目为4NA
D.1L lmol·L-1 FeCl3溶液中,含Fe 3+的数目为NA
二、选择题(每小题只有1个最佳选项符合题意,共16分)
|
A.2 Na2O2 + 2 H2 O == 4NaOH + O2↑ B.NH4C l+ NaOH == NaCI + H2O + NH3↑
C.Mg3N2 + 6 H2 O == 3Mg(OH)2↓+2NH3↑ D. CaC2 + 2H2 O→Ca(OH)2 + CH≡CH↑
10.四种主族元素的离子aXm+、bYn+、cZn-和dRm-(a、b、c、d为元素的原子序数),它们具有相同的电子层结构,若m > n,对下列叙述的判断正确的是
① a-b=n-m;② 元素的原子序数a > b > c > d;③ 元素非金属性Z > R;④ 最高价氧化物对应水化物碱性X > Y。
A.②③正确 B.只有③正确 C.①②③④正确 D.①②③正确
11.运用元素周期律分析下面的推断,其中肯定错误的是
A.铍(Be)的氧化物的水化物可能具有两性
B.砹(At)为有色固体;H At不稳定;AgAt感光性很强,且不溶于水也不溶于稀酸。
C.硫酸锶(SrSO4 )是难溶于水的白色固体。
D.硒化氢(H2Se)是无色、有毒、比H2S稳定的气体。
12.下列具有特殊性能的材料中,由主族元素和副族元素形成的是
A.透明陶瓷材料硒化锌 B.吸氢材料镧镍合金
C.半导体材料砷化镓 D.新超导材料K3C60
13、已知25℃、101kPa下,石墨、金刚石燃烧的热化学方程式分别为
C(石墨)+O2(g)=CO2(g) △H= —393.51kJ·mol-1
C(金刚石)+O2(g)=CO2(g) △H= —395.41kJ·mol-1
据此判断,下列说法正确的是
A.由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的低
B.由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的高
C.由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的低
D.由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的高
14、已知:
① 1 molH2分子中化学键断裂时需要吸收436 kJ的能量
② 1 mol Cl2分子中化学键断裂时需要吸收243kJ的能量
③由H原子和Cl原子形成1 mol HCl分子时释放431 kJ的能量
下列叙述正确的是
A、氢气和氯气反应生成氯化氢分子气体的热化学方程式是 H2(g)+Cl2(g)==2HCl(g)
B、氢气和氯气反应生成2 mol氯化氢气体,反应的△H=183kJ/mol
C、氢气和氯气反应生成2 mol氯化氢气体,反应的△H= -183kJ/mol
D、 氢气和氯气反应生成1 mol氯化氢气体,反应的△H= -183kJ/mol
15、在一个6升的密闭容器中,放入3升X(气)和2升Y(气),在一定条件下发生下列反应: 4X(气)+3Y(气)![]() 2Q(气)+nR(气)达到平衡后,容器内温度不变,混和气体的压强比原
2Q(气)+nR(气)达到平衡后,容器内温度不变,混和气体的压强比原
来增加5%,X的浓度减小1/3,则该反应后方程式中的n值是 [ ]
A、3 B、4 C、5 D、6
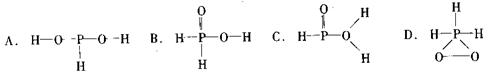 16、已知磷酸分子中的三个氢原子都可以跟重水分子(D2O)中的D原子发生氢交换。又知次磷酸(H3PO2)也可跟D2O进行氢交换,但次磷酸钠(NaH2PO2)却不能跟D2O发生氢交换。由此可推断出H3PO2的分子结构是
16、已知磷酸分子中的三个氢原子都可以跟重水分子(D2O)中的D原子发生氢交换。又知次磷酸(H3PO2)也可跟D2O进行氢交换,但次磷酸钠(NaH2PO2)却不能跟D2O发生氢交换。由此可推断出H3PO2的分子结构是
第Ⅱ卷(非选择题,共68分)
三、填空题(本大题包括3小题,共23分)
17、(6分)
(1)将FeCl3溶液滴入沸水制得红褐色液体,反应的化学方程式为 。
(2)过氧化氢在碱性溶液中把CrO2—氧化成CrO42—,反应的离子方程式为 。
(3)1g固体铝在氧气中完全燃烧,生成固体产物,放出31kJ热量。反应的热化学方程式为 。
18、(9分)
用A+、B-、C2-、D、E、F、G和H分别表示含有18个电子的八种微粒(离子或分子),请回答:
⑴A元素是 、B元素是 、C元素是 (用元素符号表示)
⑵D是由两种元素组成的双原子分子,其分子式是 。
⑶E是所有含18个电子的微粒中氧化能力最强的分子,其化学式是 。
⑷F是由两种元素组成的三原子分子,其分子式是 ,电子式是 。
⑸G分子中含有4个原子,其分子式是 。
⑹H分子中含有8个原子,其分子式是 。
19、(8分)下图中的每一方格表示有关的一种反应物或生成物,其中粗框表示初始反应物(反应时加入或生成的水,以及生成沉淀J时的其他产物均已略去).
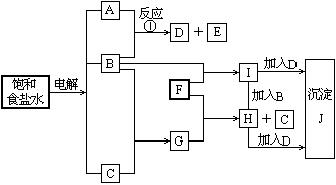 |
请填写下列空白:
(1)物质B是 ,F是 ,J是 .
(2)反应①的离子方程式是____________________________________.
四、实验题(本大题包括2小题共16分)
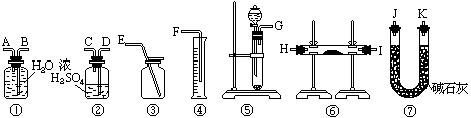 |
20、(6分)现有一定量含有Na2O杂质的Na2O2试样.请从下图中选用适当的实验装置,设计一个最简单的实验,测定Na2O2试样的纯度(可供选用的反应物只有CaCO3固体,6摩尔/升盐酸和蒸馏水).请填写下列空白:
(1)写出实验中Na2O2和Na2O分别发生反应的化学方程式.
(2)应选用的装置是(只要求写出图中装置的标号)
(3)所选用装置的连接顺序应是(填各接口的字母;连接胶管省略).
21、(10分)
现有五种离子化合物,A、B、C、D和E,都是由下表中离子形成的:
| 阳离子 | Ag+ | Ba2+ | Al3+ |
| 阴离子 | OH- | Cl- | SO42- |
为鉴别它们,分别完成以下实验,其结果是:
① B和D都不溶于水,也不溶于酸;
② A溶于水后,与上述某种阳离子反应可生成B,且A溶液与过量氨水反应生成白色沉淀;
③ C溶于水后,与上述某种阳离子反应可生成D,且C溶液与过量氨水反应生成白色沉淀;
④ E溶于水后,与上述某种阴离子反应可生成B;
⑤ A溶液与适量E溶液反应生成沉淀,再加入过量E溶液,沉淀量减少,但不消失。
请根据上述实验结果,填空:
⑴写出化合物的化学式:A ,C ,D ,E 。
⑵A溶液与过量的E溶液反应后,最终得到的沉淀的化学式是 。
五、推断题(本大题包括2小题共16分)
22、(4分)A、B两种有机化合物,分子式都是C9H11O2N。
(1)化合物A是天然蛋白质的水解产物,光谱测定显示,分子结构中不存在甲基(-CH3)。化合物A的结构式是
(2)化合物B是某种分子式为C9H12芳香烃一硝化后的唯一产物(硝基连在芳环上)。化合物B的结构式是 .
23、(12分)根据图示填空
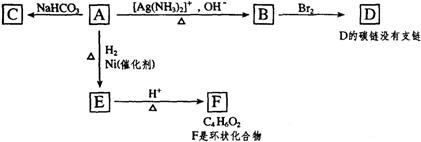
(1)化合物A含有的官能团是 。
(2)1mol A与2mol H2反应生成1molE,其反应方程式是 。
(3)与A具有相同官能团的A的同分异构体的结构简式是 。
(4)B在酸性条件下与Br2反应得到D,D的结构简式是 。
(5)F的结构简式是 。由E生成F的反应类型是 。
六、计算题(本小题包括2小题共13分)
24、(6分)称取0.200克某赤铁矿样品,矿样溶解后,使其中的铁全部转化成Fe2+(所得溶液中不含其他还原性物质)。另称7.90克硫酸铈 2(NH4)2SO4·Ce(SO4)2·2H2O (摩尔质量为632克/摩),溶解后稀释至250毫升。取该溶液30.0毫升恰好与上述Fe2+溶液完全反应。反应的离子方程式为:Ce4++Fe2+=Ce3++Fe3+。请计算该矿样中Fe2O3的质量百分含量。(Fe2O3摩尔质量为160克/摩)。
25、(7分)现有AlCl3和FeCl3混合溶液,其中Al3+和Fe3+的物质的量之和为0.1摩,在此溶液中加入90毫升4摩/升的NaOH溶液,使其充分反应。设Al3+物质的量与总物质的量的比值为x。
(1)根据反应的化学方程式计算x=0.4时,溶液中产生的沉淀是什么?物质的量有多少?
(2)计算沉淀中只有Fe(OH)3的x取值范围.
 |
请在下图中画出沉淀总量(摩)随x(0→1)变化的曲线.