高三化学上学期第二次月考试卷
班级 姓名 学号 成绩
一、选择题:(单选)
1、在水溶液中,YO3n-和S2-发生如下反应:YO3n- + 3S2- +6H+ = Y- + 3S↓+ 3H2O,则YO3n-中Y元素的化合价和原子最外层电子数分别为
A、+4、6 B、+7、7 C、+5、7 D、+5、5
2、在氧化还原反应3S + 6KOH = K2SO3 + 2K2S + 3H2O中,被氧化和被还原的硫原子数之比为
A、1 :2 B、2 :1 C、1 :1 D、3 :2
3、下列离子方程式或化学方程式中正确的是
A、氯气通入水中 Cl2 + H2O = 2H+ + Cl- + ClO-
B、向Fe(OH)3中加入氢溴酸:Fe(OH)3+3H+ = Fe3++3H2O
C、过量铁与稀HNO3反应:3Fe +4H+ + 2NO3- = 3Fe2+ + 2NO↑+ 2H2O
D、向NaHCO3溶液中加入过量的Ba(OH)2溶液:
Ba2++2HCO3-+2OH-= BaCO3↓+CO32-+2H2O
4、下列各组离子,在指定环境中一定能大量共存的是
A、pH=7的溶液中:Al3+、K+、SO42-、HCO3-
B、加入铝粉能放出氢气的溶液中:CO32-、AlO2-、I-、NO3-
C、能使pH试纸变深蓝色的溶液中:S2-、SO32-、S2O32-、SO42-
D、由水电离出的[OH-]=1×10-13mol/L的溶液中:Fe2+、NH4+、ClO-、Cl-
5、下列离子方程式中正确的是
A、向NaHSO4溶液中滴加Ba(OH)2至SO42-沉淀完全:
2H+ + SO42- + Ba2+ + 2OH- = BaSO4↓+ 2H2O
B、碳酸钠溶液与醋酸反应:CO32- + 2H+ = CO2↑+ H2O
C、氢氧化亚铁与硝酸混合:Fe(OH)2 + 2H+ = Fe2+ + 2H2O
D、将1~2mL氯化铁饱和溶液加到20mL沸水中:Fe3+ + 3H2O = Fe(OH)3(胶体) + 3H+
6、下列各组离子在碱性溶液中能大量共存的是
A、K+、Al3+、Cl-、SO42- B、Na+、AlO2-、NO3-、CO32-
C、NH4+、Mg2+、NO3-、SO42- D、Na+、H+、SO42-、Cl-
7、某物质的一定量的溶液,其质量分数为30%,当加入等体积的水稀释后,质量分数大于15%,则原溶液的密度为
A、小于水的密度 B、等于水的密度 C、大于水的密度 D、无法确定
8、常温下,将两个铂电极插入一定量的硫酸钠饱和溶液中进行电解,通过一段时间后,在阳极产生a mol气体,同时有WgNa2SO4·10H2O析出,若温度不变,此时剩余溶液中溶质的质量分数为
| |||||||||
|
|
| |||||||
![]()
![]()
![]()
![]() A、 ×100% B、 % C、 % D、 %
A、 ×100% B、 % C、 % D、 %
9、密度为0.91 g·cm-3的氨水,质量百分比浓度为25%(即质量分数为0.25),该氨水用等体积的水稀释后,所得溶液的质量百分比浓度
A、等于12.5% B、大于12.5% C、小于12.5% D、无法确定
10、下列说法中正确的是
A、需要加热才能发生的反应一定是吸热反应;
B、放热反应在常温下一定很容易发生;
C、反应是放热还是吸热,必须看反应物和生成物所具有的总能量的相对大小;
D、吸热反应一定要加热条件下才能发生。
11、下列说法或表示法正确的是
A、等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B、由C(石墨)→C(金刚石):ΔH = +119 kJ· mol—1可知,金刚石比石墨稳定
C、在稀溶液中:H++OH-===H2O;ΔH=-57.3 kJ· mol—1,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ
D、在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)===2H2O(l);ΔH=+285.8 kJ· mol—1
12、用N0表示阿氏常数,下列说法错误的是
A、1molCl2通入足量的NaOH溶液中充分反应转移的电子数为N0;
B、1molC20H42中含有61 N0个共价键;
C、25℃时1mL水中含10-10 N0个OH-离子;
D、22.4LCH4含有5 N0个原子。
13、在下列条件下,两种气体的分子数一定相等的
A、同质量、不同密度的N2和C2H4; B、同温度、同体积的O2和N2;
C、同体积、不同密度的CO和C2H4; D、同压强、同体积的O2和N2。
14、下列有关气体体积的叙述中,正确的是
A、一定温度和压强下,各种气态物质体积的大小,由构成气体的分子大小决定
B、一定温度和压强下,各种气态物质体积的大小,由构成气体的分子数决定。
C、不同的气体,若体积不同,则它们所含的分子数也不同;
D、气体摩尔体积是指1摩尔任何气体所占的体积约为22.4L
15、将足量的CO2不断通入KOH、Ca(OH)2、KAlO2的混合溶液中,生成沉淀与通入CO2的量的关系可表示为:
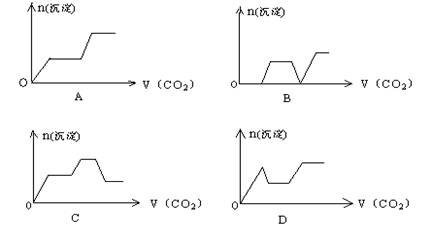 |
16、设NA为阿氏常数,下列叙述正确
A、在100mL0.5mol/LCH3COOH溶液中CH3COOH分子数等于0.05NA;
B、1molD2O所含质子数为12NA;
C、在100mLpH=1的稀硫酸中,水合氢离子数为0.1NA;
D、15.6gNa2O2跟过量CO2反应时,转移电子数为0.2NA。
17、下列说法不正确的是
A、1 mol Na做还原剂时可提供出NA个电子;B、71gCl2变成氯离子时得到的电子数为2NA
C、17gNH3与22.4升CH4所含质子数相等; D、NA个氧分子与NA个氢分子的质量比为16:1
18、现在含硒的保健品已开始进入市场,已知它与氧同主族与钾同周期,则下列有关硒的叙述中错误的是
A、原子序数为24 B、最高价氧化物的化学式为SeO3
C、非金属性比溴弱 D、气态氢化物的化学式为H2Se
19、甲、乙是周期表中相邻两个主族的两种元素,若甲的原子序数为x,则以下有可能是乙的原子序数的是
A、x - 17 B、x - 8 C、x - 6 D、x + 18
20、第二主族中的铍在一定条件下可形成化合物Na2BeO2。下列有关铍及其化合物的叙述错误的是
A、单质铍可溶于烧碱溶液生成H2; B、Na2BeO2溶液呈碱性
C、氢氧化铍易溶于水; D、单质铍不能与冷水反应生成H2
21、X、Y、Z是位于周期表前三周期的相邻的三种元素。X和Y同周期,Y和Z同主族。这三种元素的质子数之和为31,最外层电子总数为17,则X、Y、Z分别是
A、Mg、Al、C B、N、O、S C、C、F、S D、Si、Al、Be
![]()
![]()
![]()
![]()
![]()
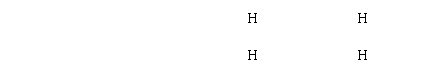 22、下列电子式书写正确的是
22、下列电子式书写正确的是
A、[Na+]: S :2-[Na+] B、H+[: S :]2-H+ C、H:N D、[H : N : H]+[ : Cl :]-
23、关于晶体的下列说法中正确的是
A、在晶体中只要有阴离子就一定有阳离子; B、在晶体中只要有阳离子就一定有阴离子;
C、原子晶体的熔点一定比金属晶体的高; D、分子晶体的熔点一定比金属晶体的低。
24、短周期元素M和N的离子M2+和N2-具有相同电子层结构,则下列说法正确的是
A、M2+的离子半径比N2-小 B、M的原子序数比N小
C、M和N原子的电子层数相等 D、M和N原子最外层电子数相等
25、短周期元素A、B、C原子序数依次递增,它们原子的最外层电子数之和为10,A与C同主族,B原子最外层电子数等于A原子次外层电子数,则下列叙述正确的是
A、原子半径A<B<C B、C的氢化物的稳定性大于A的氢化物;
C、B的氧化物熔点比A的氧化物高; D、A与C可形成离子化合物。
26、有Xn+、Ym+、Zn-,已知它们各自带有的电荷数值m>n,且X、Y、Z三种原子的M电子层中的电子数均为奇数。若按X→Y→Z的顺序,下列说法中正确的是
A、它们的最高价氧化物的相应水化物的碱性依次减弱,酸性依次增强
B、它们的原子半径依次增大;
C、它们的单质在常温、常压下的密度依次减小
D、它们的最高价氧化物的水化物都是强电解质
27、下列关于砷(As)元素的叙述中,正确的是
A、在AsCl3分子中,砷原子最外层电子数为8;
B、Na3AsO4溶液的pH小于7;
C、砷的氢化物的化学式为AsH3,它是一种强氧化剂;
D、砷的相对原子质量为74.92,由此可知砷原子核内有42个中子。
28、有人认为在元素周期表中,位于ⅠA族的氢元素,也可以放在ⅦA族,下列物质能支持这种观点的是
A、HF B、H3+O C、NaH D、H2O2
29、A和M为两种元素,已知A位于短周期,且A2+与M-的电子数之差为8,下列说法错误的是
A、A和M的原子序数之差可能为5; B、A和M原子的最外层电子数之和可能为9;
C、A和M原子最外层电子数之差为7; D、A和M原子的电子总数之和可能为13。
30、已知短周期元素的离子:aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是
A、原子半径 B>A>C>D B、原子序数 d>c>b>a
C、离子半径 D>C>B>A D、单质的还原性 A>B>D>C
二、填空题
31.(8分)周期表前20号元素中有A、B、C、D、E五种元素。已知它们都不是稀有气体元素,且原子半径依次减小,其中A和E同族,A与C、B与E原子的电子层数都相差2,A、B原子最外层电子数之比为1 :4。
(1)写出元素符号:B_________、D___________、E_________。
(2)A和C能以原子数1 :1形成一种化合物,写出该化合物的化学式:_________。
32.(12分)在25℃,101kPa条件下,将15 L O2通入10 L CO和H2的混合气中,使其完全燃烧,干燥后,恢复至原来的温度和压强。
(1)若剩余气体的体积是15L,则原CO和H2的混合气中
V(CO)= L, V(H2)= L。
(2)若剩余气体的体积为a L,则原CO和H2的混合气中
V(CO)︰V(H2)= 。
(3)若剩余气体的体积为aL,则a的取值范围是 。
三、简答题
33、(11分)X、Y、Z、W为按原子序数由小到大排列的四种短周期元素。已知:
① X可分别与Y、W形成X2Y、X2Y2、XW等共价化合物;
② Z可分别与Y、W形成Z2Y、Z2Y2、ZW等离子化合物。
请回答:
(1) Z2Y的化学式是
(2) Z2Y2与X2Y反应的化学方程式是 。
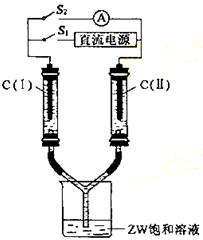 (3)如图所示装置,两玻璃管中盛满滴有酚酞的溶液的ZW饱和溶液,C(Ⅰ)、C(Ⅱ)为多孔石墨电极。接通S1后,C(Ⅰ)附近溶液变红,两玻璃管中有气体生成。一段时间后(两玻璃管中液面未脱离电极),断开S1,接通S2,电流表的指针发生偏转。此时:
(3)如图所示装置,两玻璃管中盛满滴有酚酞的溶液的ZW饱和溶液,C(Ⅰ)、C(Ⅱ)为多孔石墨电极。接通S1后,C(Ⅰ)附近溶液变红,两玻璃管中有气体生成。一段时间后(两玻璃管中液面未脱离电极),断开S1,接通S2,电流表的指针发生偏转。此时:
C(Ⅰ)的电极名称是 (填写正极或负极);
C(Ⅱ)的电极反应式是 。
(3) 铜屑放入稀硫酸不发生反应,若在稀硫酸中加入
X2Y2,铜屑可逐渐溶解,该反应的离子方程式
是: 。
34、该题请直接做到在答题卷上(9分)
 高三化学第二次月考答题卷
高三化学第二次月考答题卷
一、选择题:(单选,每题2分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 |
二、填空题
31.(8分)
(1)元素符号:B_________、D___________、E_________。(2)化学式:_________。
32.(12分)
(1)V(CO)= L, V(H2)= L。(2)V(CO)︰V(H2)= 。
(3)a的取值范围是 。
三、简答题
33、(共11分,第二小题3分,其余每空2分)
(1)Z2Y的化学式
(2)化学方程式是 。
(3)C(Ⅰ)的电极名称是 ;C(Ⅱ)的电极反应式是 。
(4),反应的离子方程式是: 。
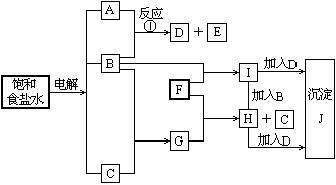 34、( 9 分)右图中的每一方格表示有关的一种反应物或生成物,其中粗框表示初始反应物(反应时加入或生成的水,以及生成沉淀J时的其他产物均已略去).
34、( 9 分)右图中的每一方格表示有关的一种反应物或生成物,其中粗框表示初始反应物(反应时加入或生成的水,以及生成沉淀J时的其他产物均已略去).
请填写下列空白:
(1)物质B是 ,
F是 ,
J是 .
(2)反应①的离子方程式是__________ __________________________.
答案
高三化学第二次月考答题卷
一、选择题:(单选,每题2分)
1-10 CABCD,BCDCC. 11-20 CDABC,DCAAC. 21-30 BDAAC, AACCA
二、填空题
31.(8分)(1)Si F
H (2)![]() (或K2C2)
(或K2C2)
32.(1) 5L 、 5L (2) a-10/20-a (3)10<a<20
三、简答题
33、(12分)⑴ Na2O ⑵ 2Na2O2 +2H2O == 4NaOH + O2↑
⑶ 负极 Cl2 + 2e—== 2Cl—
⑷ Cu + H2O2 + 2H+ == Cu2+ + 2H2O
34、Cl2 Fe Fe(OH)3 Cl2 + 2OH-==Cl- + ClO- +H2O