高三化学上册第一次月考试题
所需原子量度 H-1 C-12 Na-23 O-16 Mg-24 N-14
一、选择题(每小题2分,共20分。每小题只有一个正确答案)
1.下列物质属于弱电解质的是
A.氯化铝 B.铜 C.酒精 D.水
2.下列变化需要加入氧化剂才能实现的是
A.S2-![]() HS- B.HCO
HS- B.HCO![]()
![]() CO2
CO2
C.I-![]() I2 D.Cu2+
I2 D.Cu2+![]() Cu
Cu
3.关于金属锂的叙述中,错误的是
A.跟水的反应比钠还剧烈
B.它的原子半径比钠的原子半径小
C.它的阳离子的氧化性比钠离子的氧化性强
D.它可作还原剂
4.欲除去小苏打溶液中少量的苏打,最好用
A.盐酸 B.苛性钠 C.通CO2 D.石灰水
5.将KMnO4和KClO3的混合物加热,待反应完全后,向残余固体中加入浓盐酸并加热,在整个实验过程中不可能产生的气体是
A.O2 B.Cl2 C.HCl D.H2
6.在标准状况下,将22.4 L氯化氢气体溶于水制成22.4 L稀盐酸,该盐酸溶液的物质的量浓度为
A.![]() mol·L-1 B.
mol·L-1 B.![]() mol·L-1
mol·L-1
C.1 mol·L-1 D.![]() mol·L-1
mol·L-1
7.不能使溴水褪色的是
A.镁粉 B.NaOH溶液 C.氯化钠溶液 D.CCl4
8.下列实验现象描述错误的是
A.氯水、溴水、碘水分别加入淀粉碘化钾溶液都可变蓝
B.将CCl4加入碘水中,CCl4层呈橙红色
C.钠投入足量的CuSO4溶液中,产生气体,同时生成蓝色沉淀
D.Na2O2和盐酸反应,生成的气体能使带火星的木条复燃
9.盛NaOH溶液的试剂瓶,倾倒过溶液后,瓶中残留的液体过一段时间变成白色固体,该物质是
A.NaOH B.Na2O C.Na2CO3 D.NaHCO3
10.同温同压下,3.5 g气体A所占体积和4 g O2所占体积相同,则气体A的相对分子质量为
A.22 B.28 C.33 D.44
二、选择题(每小题3分,共30分。每小题只有一个正确答案)
11.下列离子方程式正确的是
A.石灰石和盐酸反应:CO![]() +2H+====CO2↑+H2O
+2H+====CO2↑+H2O
B.铁粉和稀盐酸反应:2Fe+6H+====2Fe3++3H2↑
C.钠投入水中反应:2Na+2H2O====2Na++2OH-+H2↑
D.硫酸铜溶液与氢氧化钡溶液反应:Ba2++SO![]() ====BaSO4↓
====BaSO4↓
12.相同物质的量浓度的盐酸、硫酸、磷酸分别和同物质的量浓度同体积的氢氧化钾溶液反应生成钾盐,需要三种酸的体积比为
A.1∶1∶1 B.1∶2∶3 C.3∶2∶1 D.6∶3∶2
13.氧化钠和过氧化钠的共同之处是
A.都是淡黄色固体 B.都是碱性氧化物
C.都能与水作用生成碱 D.都能与CO2反应生成盐和氧气
14.下列各组离子在无色透明溶液中能大量共存的是
A.K+、HCO![]() 、I-、Na+ B.H+、Br-、NO
、I-、Na+ B.H+、Br-、NO![]() 、Ag+
、Ag+
C.Na+、MnO![]() 、SO
、SO![]() 、K+ D.Na+、CO
、K+ D.Na+、CO![]() 、Cl-、H+
、Cl-、H+
15.(CN)2、(OCN)2、(SCN)2等的性质与卤素单质相似,而CN-、OCN-、SCN-等的性质与卤离子相似,化学上称之为类卤素或类卤离子,不同的卤素也可生成卤素互化物,如BrF3。下列关于(CN)2的性质中,不像卤素的是
A.在碱溶液中生成CN-和OCN- B.与Cl2反应生成CNCl
C.能在空气中燃烧 D.可与银汞、铅等生成难溶盐
16.为了证明氯酸钾中含有氯元素,选用给出的试剂和操作,其操作顺序正确的是
①滴加AgNO3溶液 ②加水溶解 ③过滤、取滤液 ④与MnO2混合共热 ⑤加稀HNO3 ⑥与浓盐酸反应 ⑦加NaOH溶液加热 ⑧用淀粉碘化钾
A.⑥⑦①⑤ B.⑥⑧ C.④②③①⑤ D.②①⑤
17.在2KMnO4+16 HCl====2MnCl2+5Cl2↑+8H2O的反应中,氧化剂和还原剂的物质的量之比为
A.1∶8 B.8∶1 C.1∶5 D.5∶1
18. 200 mL 0.3 mol·L-1的盐酸和100 mL 0.6 mol·L-1的盐酸混合后,其物质的量浓度约是
A.0.3 mol·L-1 B.0.4 mol·L-1
C.0.5 mol·L-1 D.0.6 mol·L-1
19.在下列反应中
①Cu+2FeCl3====2FeCl2+CaCl2
②2KMnO4+16HCl====2KCl+2MnCl2+5Cl2↑+8H2O
③2FeCl2+Cl2====2FeCl3
各粒子氧化性由强到弱的顺序为
A.KMnO4、FeCl3、Cl2、CuCl2 B.Cl2、FeCl3、KMnO4、CuCl2
C.KMnO4、Cl2、FeCl3、CuCl2 D.FeCl3、KMnO4、Cl2、CuCl2
20.为使人们确知含碘物质的存在,研究性学习小组同学设计了一种简便的检验方法,利用该物质在酸性条件下与KI反应有单质碘生成的性质,选用下列生活常见的物质就可完成。请你从下列物质中选出合适的一组
①自来水 ②食醋 ③淀粉 ④食糖 ⑤碘化钾试纸 ⑥碘酒
A.①③④⑤ B.②③④⑤
C.①③⑤⑥ D.①②③⑤
三、填空题(18分)
21.(3分)A、B两元素可形成AB型离子化合物,且阴、阳离子具有相同的电子数。A、B的单质均能与水发生剧烈反应,反应中A单质作还原剂,B单质作氧化剂,则:
(1)A元素的名称是 ,A与水反应的离子方程式为 。
(2)B元素符号是 ,该单质与水反应的化学方程式为 。
22.(3分)CO和CO2的混合气体18 g,完全燃烧后测得CO2体积为11.2 L(标准状况),则
(1)混合气体中CO的质量是 g;
(2)混合气体中CO2在标准状况下的体积是 L;
(3)混合气体在标准状况下的密度是 g·L-1。
23.(12分)现有x、y、z三种元素:(1)三种元素的单质常温下都是气体。(2)x的单质可以在z的单质中燃烧,生成xz其火焰为苍白色。(3)xz极易溶于水,其溶液可使紫色石蕊试纸变红。(4)x、y的单质化合得到常温下为液态的x2y。(5)z的单质溶于x2y中,所得溶液具有漂白性。根据以上事实推断:
(1)x ,z的单质 ,x2y 。
(2)写出化学方程式
①z的单质与x2y反应: 。
②x的单质在y单质中燃烧: 。
四、实验题(16分)
24.(6分)用37%,密度为1.19 g·cm-3的浓盐酸配制0.1 mol·L-1的稀盐酸500 mL,请回答:
(1)所需浓盐酸的体积为 mL;
(2)此实验配制稀盐酸,除玻璃棒、胶头滴管、试剂瓶外,还需的仪器有 、__________和 。
(3)如果在配制时,第一次加水量太少,搅拌时间较长,对配制溶液的浓度有什么影响?
(“偏高”“偏低”或“无影响“)
25.(10分)无水氯化铝是白色晶体,易吸收水分,在178℃升华,装有无水氯化铝露置于潮湿空气中会爆炸并产生大量白雾,工业上由金属与氯气作用或由无水氯化氢气体与熔融Al作用而制得,某课外活动小组在实验室内通过下列装置(如下图)制取少量纯净的无水氯化铝。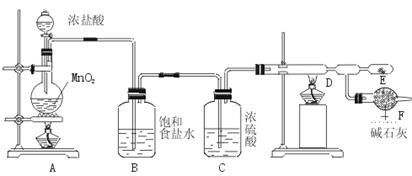
(1)开始实验时,不能先点燃A装置的酒精灯后打开分液漏斗的活塞,将浓盐酸注入烧瓶内,其理由是 。
(2)A装置发生反应的化学方程式: 。
(3)在E处可收集到纯净的氯化铝,原因是 。
(4)若无B、C装置,使A产生的气体直接进入D,实验产生的不良后果是 。
(5)F装置的作用是 。
五、计算题(16分)
26.(8分)化工厂经常用浓氨水检验管道是否漏氯气,其反应为3Cl2+8NH3====6NH4Cl+N2。当有160.5 g NH4Cl产生时,求被氧化的氨气是多少克?
27.(8分)在NaOH、Na2CO3混合液中加入盐酸,若NaOH、Na2CO3、HCl物质的量分别是x、y、z。
(1)计算反应后溶液中NaCl物质的量(A)。
(2)已知Na2CO3跟HCl按下式反应:
Na2CO3+HCl![]() NaHCO3+NaCl
NaHCO3+NaCl
NaHCO3+HCl![]() NaCl+H2CO3
NaCl+H2CO3
计算反应后溶液中CO![]() 的物质的量(B)。
的物质的量(B)。
参考答案
一、1.D 2.C 3.A 4.C 5.D 6.D 7.C 8.B 9.C 10.B
二、11.C 12.D 13.C 14.A 15.C 16.C 17.C 18.B 19.C 20.D
三、21.(1)钠 2Na+2H2O====2OH-+2Na++H2↑
(2)F 2F2+2H2O====4HF+O2
22.(1)7 (2)5.6 (3)1.6
23.(1)H Cl2 H2O
(2)①Cl2+H2O![]() HCl+HClO
HCl+HClO
②2H2+O2![]() 2H2O
2H2O
四、24.(1)4.1
(2)500 mL烧杯 10 mL量筒 500 mL容量瓶
(3)偏低
25.(1)盐酸会大量挥发,且盐酸倒入灼热的烧瓶会使烧瓶炸裂
(2)MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O (3)AlCl3易升华
MnCl2+Cl2↑+2H2O (3)AlCl3易升华
(4)AlCl3与H2O反应而爆炸
(5)吸收多余的Cl2且冷却时吸收回流空气中的水汽
五、26.17 g
27.(1)z≥x+2y时,A=x+2y
z<x+2y时,A=z
(2)0<z≤x B=y;x<z<x+y B=x+y-z;z>x+y B=0