绝密★启用前
高三化学上学期两校联考试题
化学试卷
全卷满分100分,考试时间90分钟。
可能用到的相对原子质量:H—1 C—12 O—16 Na—23
A1—27 Fe—56 K—39 Cl—35.5 Mg—24 S—32 Cu—64
第I卷(选择题,共51分)
一、选择题(每小题只有一个选项符合题意,每小题3分,共51分)
1.据报道,上海某医院正在研究用放射性碘(12553I)治疗肿瘤. 该原子的原子核内的中子数与核外电子数之差为( )
A. 72 B. 19 C. 53 D. 125
2. 碘被称为“智慧元素”,人体缺碘会导致碘缺乏病(IDD)。目前我国含碘食盐中主要加入的是( )
A. I2 B. AgI C. KIO3 D. KI
3.下列物质①Na ②F2 ③Na2O2 ④Na2O ⑤Cl2 能与水发生氧化还原反应,且水在此反应中既不是氧化剂又不是还原剂的是(
)
A.①②
B.②④ C.④⑤ D.③⑤.
4.下列各组物质中,化学键和晶体类型完全相同的是( )
A. HCl和NaCl B. H2SO4和(NH4)2SO4 C. HBr和H2O D. CO2和SiO2
5.以NA表示阿伏加德罗常数,下列说法正确的是 ( )
A.0.1molH3O+中含有1.1NA个电子 B.标准状况下,11.2L臭氧中含有NA个氧原子
C.2g重氧水(H218O)含有NA个中子 D.84gNaHCO3晶体中含有NA个CO32-
6.对已达化学平衡的下列反应
2X(g)+Y(g)![]() 2Z(g)
减小压强时,对反应产生的影响是
2Z(g)
减小压强时,对反应产生的影响是
A 逆反应速率增大,正反应速率减小,平衡向逆反应方向移动
B 逆反应速率减小,正反应速率增大,平衡向正反应方向移动
C 正、逆反应速率都减小,平衡向逆反应方向移动
D 正、逆反应速率都增大,平衡向正反应方向移动
7.下列溶液中:
①石灰水 ②H2S溶液 ③KMnO4溶液 ④溴水
⑤酸化的Ba(NO3)2溶液 ⑥品红溶液,不能区别SO2和CO2气体的是( )
A.只有① B.①⑤ C.①②③⑤ D.②③④⑤
8.X是原子核内无中子的元素,Y是地壳中含量最丰富的元素,Z元素的原子次外层电子数是最外层的2倍,是K层的4倍,W可以形成自然界最硬的原子晶体。下列说法错误的是 ( )
A. WX4是含有极性键的非极性分子 B.液态X2Y中含有氢键
C.Y的气态氢化物比Z的气态氢化物稳定 D.WY2与ZY2的晶体类型相同
9.下列各组离子在碱性条件下可以大量共存,而在强酸性条件下能发生氧化还原反应的是 ( )
A.Ca+、Fe2+、NO3-、Cl- B.K+、Mg2+、HCO3-、PO43-
C.Na+、K+、SO42-、SO32- D.Ba2+、Na+、I-、NO3-
10.下列说法正确的是 ( )
A.任何化学反应都伴随着能量的变化
B.1 mol H2SO4和 1 mol Ba(OH)2完全反应所放出的热量称为中和热
C.在101kPa 时,1 mol 碳燃烧放出的热量就是碳的燃烧热
D.在化学反应中需要加热的反应就是吸热反应
11.在生物体内,由细胞膜内的葡萄糖,细胞膜外的富氧液体及细胞膜构成的生物原电池中,有关判断正确的是 ( )
A.负极的电极反应可能是O2+4e+2H2O==4OH-
B.正极的电极反应可能是O2+4e===2O2-
C.负极反应主要是C6H12O6生成CO2或HCO3-
D.正极反应主要是C6H12O6生成CO2或HCO3-
12.下列物质的保存方法正确的是 ( )
①少量金属钠保存在冷水中
②浓硝酸盛放在无色试剂瓶中
③氢氧化钠溶液盛放在带有橡胶塞的试剂瓶中
④氢氟酸保存在塑料瓶中
⑤氯水存放在带玻璃塞的无色细口瓶中
A.②③④ B.③④ C.③④⑤ D.只有③
13.下列反应的离子方程式正确的是 ( )
A.往AlCl3溶液中滴加过量氨水:Al3++3NH3. H2O==Al(OH)3↓+3NH4+
B.将金属钠加入水中 2Na + 2H2O = Na+ + OH - + H2 ↑
C.向溴化亚铁溶液中通入过量的氯气 2Fe2++Cl2=2Fe3++2Cl-
D.小苏打溶液中加入少量的石灰水:
Ca2+ +OH-+HCO3-=CaCO3↓++2H2O
14.下列实验方案合理的是 ( )
A.配制一定物质的量浓度的NaOH溶液时,将称好的NaOH固体放入50 mL的小烧杯中加水溶解,立即转移到100 mL的容量瓶中
B.往FeCl2溶液中滴入KSCN溶液,检验FeCl2是否已氧化变质
C.用湿润的PH试纸测定盐酸溶液的PH值
D.用氨水洗涤试管内壁上的"银镜"
15.在室温下等体积的酸和碱的溶液,混合后pH值一定小于7的是( )
A.pH=3的硝酸跟pH=11的氢氧化钾溶液
B.pH=3的盐酸跟pH=11的氨水
C.pH=3的硫酸跟pH=11的氢氧化钠溶液
D.pH=.3的醋酸跟pH=11的氢氧化钡溶液
16. 在反应KNO2![]() K2O+NO↑+O2↑(未配平)中,当生成33.6LNO(标准状况)时,被氧化的氧原子的物质的量为
K2O+NO↑+O2↑(未配平)中,当生成33.6LNO(标准状况)时,被氧化的氧原子的物质的量为
A.3mol B.1.5mol C.0.75mol D.0.6mol
17. 在一密闭容器中有如下反应:aX(g)+bY(g)![]() nW(g);ΔH ,某化学兴趣小组的同学根据此反应在不同条件下的实验数据,作出了如下曲线图:
nW(g);ΔH ,某化学兴趣小组的同学根据此反应在不同条件下的实验数据,作出了如下曲线图:
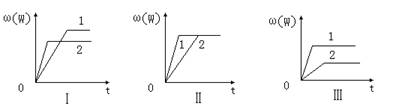
其中,ω(W)表示W在反应混合物中的百分含量,t表示反应时间。当其它条件不变时,下列分析正确的是
A.图Ⅰ可能是不同压强对反应的影响,且P2>P1,a+b>n
B.图II可能是在同温同压下催化剂对反应的影响,且1使用的催化剂效果好
C.图III可能是不同压强对反应的影响,且P1>P2,n>a+b
D.图III可能是不同温度对反应的影响,且T1>T2,ΔH <0
第II卷(非选择题,共49分)
二、填空题(本题共3小题,共28分)
18、(6分) 在淀粉碘化钾溶液中加入少量次氯酸钠溶液,并加入少量的稀硫酸,溶液立即变蓝,有关反应的离子方程式是__________________;在上述溶液中加入足量的亚硫酸钠溶液,蓝色逐渐消失,有关反应的离子方程式是__________________________。从以上事实可知,ClO-、I2.SO42-的氧化性由弱到强的顺序是___________________。
19、(12分)A、B、C、D四种元素都是短周期元素。A元素的离子焰色反应时火焰呈黄色。B元素的离子结构和Ne具有相同的电子层排布;5.8gB的氢氧化物恰好能与100mL 2mol/L盐酸完全反应;B原子核中质子数和中子数相等。H2在C单质中燃烧产生苍白色火焰。D元素原子的电子层结构最外层电子数是次外层电子数的三倍。根据条件,回答:
(1)C元素在元素周期表中的位置是 ,它的最高价氧化物的化学式为 。
(2)C与B元素形成化合物的晶体类型是______________。
(3)A与D形成稳定化合物的电子式为______________,判断该化合物在空气是否变质的简易方法是 。
(4)C元素的单质有毒,可用A的最高价氧化物对应的水化物的溶液吸收,其离子方程式为 。
20、(10分)物质A、D呈黄色,F的水溶液也呈黄色。D是单质,F的溶液遇苯酚显紫色,A是一种重要工业生产中的主要原料。且A、C、D均含有某一非金属元素,C的相对分子质量与过氧化氢的相对分子质量相等。反应过程中生成的水等与转化无关的物质已经略去。这些物质有以下转化关系。试回答以下问题:
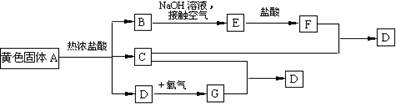
(1)A是 ,F是 (填化学式)。
(2)A与热盐酸反应的离子方程式为
(3)写出该框图中由B→E的化学方程式
三、实验题(本题共1小题,共12分)
21、(12分)利用如图所示的装置和其他必要的仪器用品,完成下列实验。
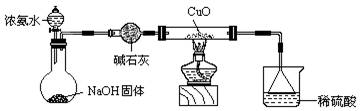 |
(1) 证明氨气具有还原性。写出直形两通管中反应方程式
(2) ① 碱石灰的作用是 稀硫酸的作用是 。
② 浓氨水与固体NaOH接触,为什么会逸出大量氨气?
。
③ 证明NH3具有还原性的实验现象是
。
(3)用吸收了足量氨气的硫酸溶液可以制取少量硫酸亚铁铵晶体。
已知:硫酸亚铁铵是淡蓝绿色晶体,在空气中性质比较稳定。硫酸亚铁铵在水中的溶解度小于硫酸铵、硫酸亚铁。制备硫酸亚铁铵的化学方程式为:
(NH4)2SO4+FeSO4+6H2O===(NH4)2Fe(SO4)2·6H2O。
在烧杯中的溶液中加入稀H2SO4调节溶液至酸性;加入适量的硫酸亚铁浓溶液后,搅拌。为分离出硫酸亚铁铵晶体,还需要进行的实验操作是:
 高三化学上学期两校联考试题
高三化学上学期两校联考试题
化学答题卷
可能用到的相对原子质量:H—1 C—12 O—16 Na—23
A1—27 Fe—56 K—39 Cl—35.5 Mg—24 S—32 Cu—64
一、选择题(每小题只有一个选项符合题意,每小题3分,共51分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 |
|
|
|
|
|
|
|
|
|
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 |
|
| 答案 |
|
|
|
|
|
|
|
|
|
二、填空题(本题共3小题,共28分)
18.(6分)__________________________________________________
______________________________________________ ______________
19.(12分)(1)_____________________ __________________
(2)__________________ (3)______________________________________
________________________________________________________________
(4)_____________________________________________________________
20.(10分)(1)A______________ F______________
(2)______________________________________________________________
(3)_____________________________________________________________
________________________________________________________________
三、实验题(本题共1小题,共12分)
21.(10分)(1)____________________________________________________
(2)①______________________ _________________________
②____________________________________________________________
______________________________________________________________
③_______________________________________________________________
(3)______________________________________________________________
_________________________________________________________________
四、计算题(本题共1小题,共9分)
22、取A、B两份物质的量浓度相等的NaOH溶液,体积均为50mL,分别向其中通入一定量的CO2后,再分别稀释为100mL。
(1)在NaOH溶液中通入一定量的CO2后,溶液中溶质的组成可能是:
_____________‚___________ƒ__________④____________
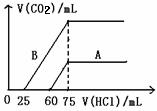 (2)在稀释后的溶液中分别逐滴加入0.1mol/L的盐酸,产生CO2的体积(标准状况)与所加的盐酸的体积关系如图:
(2)在稀释后的溶液中分别逐滴加入0.1mol/L的盐酸,产生CO2的体积(标准状况)与所加的盐酸的体积关系如图:
分别加入足量的盐酸后,溶液中溶质为_____________原NaOH溶液的物质的量浓度___________________。
‚A曲线表明,原溶液通入CO2后,所得溶质与HCl反应产生CO2的最大体积是_________mL(标准状况)
ƒB曲线表明,原溶液通入CO2后,所得溶质的化学式为__________,其物质的量之比为_____________
‚_________mL ƒ______________________, _____________
参考答案
一、选择题(每小题只有一个选项符合题意,每小题3分,共51分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | B | C | D | C | C | C | A | D | D |
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 |
|
| 答案 | A | C | B | A | B | D | C | B |
二、填空题(本题共3小题,共28分)
18.(6分)离子方程式是_ ClO-+2H++2I- = I2 + Cl- + H2O _(2分);
离子方程式是_ I2+ H2O +SO32- = _ SO42- +2H++2I-(2分);
氧化性由弱到强的顺序是_____ SO42- <I2<ClO-_(2分)。
19.(12分)(1)第3周期ⅦA (2分) Cl2O7 (2分) (2)离子晶体(2分)
(3)![]() (2分) 观察该化合物的颜色是否变白(2分)
(2分) 观察该化合物的颜色是否变白(2分)
(4)Cl2+2OH-=Cl-+ClO-+H2O (2分)
20.(10分)(1)A:FeS2 (2分) F.FeCl3(2分)
(2)FeS2+2H+=Fe2++H2S↑+S(2分)
(3)FeCl2+2NaOH=Fe(OH)2↓+2NaCl;
4Fe(OH)2+O2+2H2O=4Fe(OH)3(4分)
三、实验题(本题共1小题,共12分)
21.(10分)(1)NH3+CuO=Cu+N2+H20(2分)
(2)① 吸收水蒸气 吸收氨气,防止污染(各1分)
② NaOH吸收溶液中水分放热,使溶液温度升高,氢氧根离子浓度增大,都有利于氨气的逸出(2分)③ 黑色粉末变为红色,有无色液滴产生 (2分)
(3)加热浓缩 ;冷却结晶 ;过滤 (2分)
四、计算题(本题共1小题,共9分)
22.(1)(2分)NaOH、Na2CO3‚Na2CO3ƒNa2CO3、NaHCO3④NaHCO3
(2)(2分)NaCl 0.15mol/L。
‚33.6mL(2分) ƒNa2CO3和NaHCO3(1分), 1:1(2分)