高三化学上学期周周练试题
1、在常温常压下,24mL H2S和O2的混和气点火燃烧,生成6mL SO2时,则原混和气体中H2S的体积为
A 6mL B 12mL C 15mL D 18mL
2、在常温、常压下将aL SO2和bL H2S混和,当反应后气体体积是反应前气体体积的四分之一时,则a与b之比为
A 1︰1 B 1︰2 C 1︰3 D 2︰1
3、下列关于浓硫酸的叙述正确的是
A 浓硫酸具有吸水性,因而能使蔗糖炭化
B 浓硫酸在常温下可迅速与铜片反应放出二氧化硫气体
C 浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体
D 浓硫酸在常温下能够使铁、铝等金属钝化
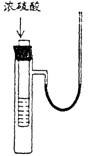 4、右图小试管中盛有几毫升水,与大试管连通的U型细玻管内放有少量的水(已染成红色)。如沿小试管壁小心地慢慢注入3毫升浓硫酸,静置片刻后,U型细玻管中可观察到的液面现象是
4、右图小试管中盛有几毫升水,与大试管连通的U型细玻管内放有少量的水(已染成红色)。如沿小试管壁小心地慢慢注入3毫升浓硫酸,静置片刻后,U型细玻管中可观察到的液面现象是
A 左高右低 B 左低右高
C 左右一样高 D 来回振动
5、下列有关阿佛加德罗常数(NA)的说法正确的有
A 标准状况下,11.2L SO3所含的原子数目为2NA
B 0.1mol H2O2催化分解,转移电子数为0.1 NA
C 0.1mol/L的100mL H2SO3溶液中,含有的离子数约为0.03 NA
D 3.2g Cu与10.0g 98%的H2SO4反应可得0.05NA个SO2气体分子
6、密度为1.45g/cm3的硫酸溶液中,逐滴加入BaCl2溶液,直至沉淀完全为止。已知沉淀物与原溶液的质量相等,则原硫酸溶液的物质的量浓度为
A 29.6% B 42.1% C 14.8mol/L D 6.22mol/L
7、已知在FeSO4和Fe2(SO4)3组成的混和物中,硫元素的质量百分含量为a%,则混和物中铁元素的质量百分含量为
A (100-a)% B (100-2a)% C (100-3a)% D (100-4a)%
8、取100mL 18.3mol/L的H2SO4与Zn反应,当Zn完全溶解时,生成气体在标况下占有的体积为22.4L,将所得的溶液稀释成1L,测得溶液的H+浓度为1mol/L,则所生成的气体中SO2与H2的体积比约为
 A
1︰2 B 2︰1 C 1︰4 D 4︰1
A
1︰2 B 2︰1 C 1︰4 D 4︰1
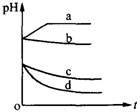
9、向等物质的量浓度和体积的氢硫酸和亚硫酸钠的溶液中,分别通入适量的某气体,溶液的PH与通入气体的量的关系如右图所示,试根据右图写出a、b、c、d能代表pH变化的化学方程式。
10、亚硫酸钠中+4价的硫,它既有氧化性又有还原性,现在有试剂:溴水、硫化钠溶液,NaOH溶液、氯化钡溶液、稀硫酸。
(1)要证明亚硫酸钠具有还原性,除亚硫酸钠外还应选用的试剂有 ,看到的现象是 ,反应的离子方程式 。
(2)要证明亚硫酸钠具有氧化性,除亚硫酸钠外还应选用的试剂有 ,看到的现象是 ,反应的离子方程式 。
11.某课外活动小组的同学,在实验室做锌与浓硫酸反应的实验时,甲同学认为产生的气体是二氧化硫,而乙同学认为除二氧化硫气体外,还可能产生氢气。为了验证甲、乙两位同学的判断是否正确,丙同学设计了如图所示的实验装置(锌与浓硫酸共热时产生的气体为X,且该装置略去):
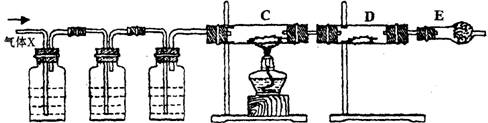
A KMnO4溶液 B
试回答:
(1)上述反应中生成二氧化硫的化学方程式为
(2)乙同学认为还可能产生氢气的化学方程式是
(3)丙同学在安装好装置后,必不可少的一步操作是:
(4)A中加入的试剂可能是 ,作用是
B中加入的试剂可能是 ,作用是
E中加入的试剂可能是 ,作用是
(5)可以证明气体X中含有氢气的实验现象是:
C中: ;D中:
12.白色粉末A由Na2S、Na2SO3、Na2SO3、Na2SO4和NaCl等物质中三种混合而成。取一定量A样品,投入100mL 22mol/L盐酸中,充分反应后过虑,最终得到100mL含[H+]为1mol/L的滤液,若把此滤液蒸干,只得到8.19g纯净物B。
(1)B的化学式 ;
(2)A中是否有NaCl (填有或无)。
(3)若反应后还生成VL气体(标准状况),且该气体不会使品红溶液褪色。则原取的A样品中会有Na2S mol(代数式)。
(4)A中各组成物质、物质的量之比不同时,所产生的沉淀的量亦不同,上述A样品与盐酸反应可生成沉淀量的最大值为 g。
13、.10g含杂质的碳酸钙和足量的盐酸反应,产生标况下2.24升CO2,试推断杂质的组成是
A 碳酸镁和二氧化硅 B 碳酸镁和碳酸氢钾
C 碳酸钾和二氧化硅 D 碳酸氢钾和二氧化硅
14.由两种黑色固体粉末组成的混合物质量为w,在空气中的烧时,发生剧烈燃烧,产物为黑色固体,冷却后称得质量亦为w,则原黑色固体的组成可能为
A 由碳粉与二氧化锰按32︰55的质量比混合而成
B 由碳粉与铁粉按3︰7的质量比混合而成
C 由碳粉与铁粉按8︰21的质量比混合而成
D 由碳粉与铜粉按1︰4的质量比混合而成
15.光纤通信是以光作为信息的载体,让光在光导纤维中传播,制造光导纤维的基本原料是
A 刚玉 B 铜 C 石英砂 D 铝
16.根据C(石墨)=C(金刚石)-1.894kJ,可得出的结论是
A 石墨比金刚稳定
B 金刚石比石墨稳定
C 金刚石转变成石墨时,能量升高
D 相同质量的这两种物质分别在氧气中充分燃烧,放出的热量是金刚石多
17.课题式课堂教学是“研究性学习”的一种方式之一,其基本教学模式为:
提出课题→确定研究方案→解决问题→总结和评价
如下图是关于“一氧化碳的化学性质”的课题式课堂教学中“解决问题”阶段,甲同学设计的证明CO具有还原性的实验装置。
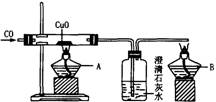
请回答下列问题:
(1)实验时应先点燃 处(填“A”或“B”)的酒精灯;
(2)洗气瓶中的实验现象为 ;
(3)酒精灯B的作用为 ;
(4)乙同学提出甲设计的装置太复杂,可将酒精灯合二为一,去掉B,而将尾气导管口旋转到A的火焰上即可。乙同学的设计是否合理? (填“合理”或“不合理”),理由是
(5)丙同学质疑“CO能否使澄清的石灰水变浑浊?”因此其设计在CO通人CuO之前,应先通过澄清石灰水,以排除CO与澄清石灰水反应。试对此作出评价,你认为丙的设计 (填“必要”或“不必要”),理由是
(6)丁同学认为甲设计的装置中的尾气处理还可以有其他方法,请你为丁同学设计一种合理的尾气处理方法 。
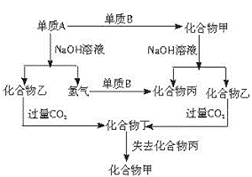 18.以下各单质和化合物之间存在下列转化关系(各单质和化合物中所含元素均为短周期元素):
18.以下各单质和化合物之间存在下列转化关系(各单质和化合物中所含元素均为短周期元素):
(1)试确定单质A和B的化学式:A___________,B___________。
(2)写出化合物甲与NaOH溶液反应的化学方程式
。
(3)写出化合物乙转化为化合物丁的离子方程式
。
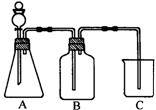 19.为确认CH3COOH、H2CO3和H4SiO4的酸性强弱,有人设计用如右图装置,一次实验即可达到目的(不必再选用其它酸性溶液)。请依据此实验填空:
19.为确认CH3COOH、H2CO3和H4SiO4的酸性强弱,有人设计用如右图装置,一次实验即可达到目的(不必再选用其它酸性溶液)。请依据此实验填空:
(1)锥形瓶内装某可溶性正盐固体,分液漏斗中所盛试剂是 。
(2)装置B所盛的试剂是 ;装置B所盛试剂的作用是 。
(3)装置C中所盛的试剂是 ;出现的现象是 。
20.由铝、硅两种物质组成的试样11g,均匀地分成等质量的两份,一份与足量的盐酸反应可产生气体a升,一份与足量的NaOH溶液反应可产生同种气体b升,合并两次收集的气体共有11.2升(标准状况)。试分析试样的百分组成。
21.已知Si+C![]() SiC,现有石英砂和炭粉的混合物xmol,于高温下在电炉里充分反应后,得残留固体;若石英砂与混和物的物质的量之比n(0<n<1),试讨论n取何值时,残留物的成分及其物质的量。
SiC,现有石英砂和炭粉的混合物xmol,于高温下在电炉里充分反应后,得残留固体;若石英砂与混和物的物质的量之比n(0<n<1),试讨论n取何值时,残留物的成分及其物质的量。
| n | 例︰n=1/3 | ||||
| 残留固体 | Si | ||||
| 物质的量(mol) | x/3(或nx) |
高三化学周周练11、29答案
[1] A、B
2 A、C
3 D
4 B
5 B
6 D
7 C
8 A
9 a.2H2S+O2=2H2O+S↓;b.H2S+Cl2=2HCl+S↓;
c.2H2SO3+O2=2H2SO4;d.H2SO3+Cl2+H2O=H2SO4+2HCl。
10(1)溴水、溴水褪色、Br2+SO32—+H2O=SO42—+2Br—+2H+
(2)硫化钠溶液和稀硫酸、浅黄色沉淀、SO32—+2S2—+6H+=3S↓+3H2O
11 (1)Zn+2H2SO4![]() ZnSO4+SO2↑+H2O
ZnSO4+SO2↑+H2O
(2)Zn+H2SO4![]() ZnSO4+H2↑
ZnSO4+H2↑
(3)检查装置的气密性
(4)品红溶液 检验SO2 浓硫酸 吸收水蒸气 碱石灰 防止空气中的水蒸气进入D装置
(5)黑色的CuO变紫红色 白色的CuSO4变蓝
12 (l)Na (2)有 (3)(V+2.0)/67.2 (4)2.56
13 A
14C
15 C
16 A、D
17 (1)B
(2)澄清石灰水变浑浊
(3)将未反应的CO转化成CO2,防止污染空气
(4)不合理 A、B处并非同时点燃的
(5)不必要 在酒精灯A点燃前,CO已通过了澄清石灰水
(6)在导管末端连接一个气囊(或一个贮气瓶,用[Cu(NH3)2]Ac吸收也可)
18 (1)A:Al B:O2
(2)Al2O3+2NaOH=2NaAlO2+H2O
(3)AlO2-+2H2O+CO2=Al(OH)3↓+HCO3-
或(1)A:Si B:O2
(2)SiO2+2NaOH=Na2SiO3+H2O
(3)SiO32-+H2O+CO2=H2SiO3↓+CO32-
19 (1)醋酸
(2)饱和NaHCO3溶液 除去CO2中含有的杂质醋酸
(3)Na2SiO3溶液 产生白色沉淀
20 铝的质量为2.7g,占49.1%;硅的质量为2.8g,占50.9%
21 n=1/4 SiC SiC=x/4; n<1/4 SiC+C SiC=nx C=x(1-4n);
n>1/3 SiO2+Si SiO2=(3n-1)x/2 Si=(1-n)x/2;
1/4<n<1/3 Si+SiC Si=x(