高三化学上学期四校联考试卷
第Ⅰ卷 (选择题 ,共70分)
本卷可能用到的相对原子质量:
H—1,C—12,N—14,O—16,Ag—108,S—32,Fe—56,Ba—137,Br—80
考试说明: 1.考试时间120分钟,满分150分。
2.试卷分第Ⅰ卷(70分)和第Ⅱ卷(80分)两部分。
3.请将答案写在答题卷上.
一.选择题(本题包括10小题,每题3分,共30分。每小题只有一个选项符合题意)
1.保护环境是每一个公民的责任。下列做法:①推广使用无磷洗涤剂,②城市生活垃圾分类处理,③推广使用一次性木质筷子,④推广使用清洁能源,⑤过量使用化肥、农药,⑥推广使用无氟冰箱。其中有利于保护环境的是:
A.①②④⑤ B.②③④⑥ C.①②④⑥ D.③④⑤⑥
2.氢叠氮酸(HN3)与醋酸性质相似,其盐稳定,但是在受到撞击时发生爆炸生成氮气。有关氢叠氮酸及其盐的叙述不正确的是:
A、NaN3可用于汽车防撞保护囊 B、NaN3的水溶液呈碱性
C、NaN3 的固体属于离子晶体 D、HN3分子中各原子都满足于8个电子稳定结构
3.氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、
陶瓷工业等领域。在一定条件下,氮化铝可通过如下反应合成:
Al2O3 + N2
+ 3C ![]() 2AlN + 3CO。下列叙述正确的是:
2AlN + 3CO。下列叙述正确的是:
A.在氮化铝的合成反应中,N2是还原剂,Al2O3氧化剂
B.上述反应中每生成2molAlN,N2得到3mol电子
C.氮化铝中氮元素的化合价为-3 D.氮化铝晶体属于分子晶体
4.氢气(H2)、一氧化碳(CO)、辛烷(C8H18)、甲烷(CH4)的热化学方程式分别为:
H2 (g) + 1/2O2(g) == H2O (l);△H = -285.8 KJ/mol
CO(g) + 1/2O2(g) == CO2(g) △H = -283 KJ/mol
C8H18 (l) + 25/2O2(g) == 8CO2(g) + 9H2O (l); △H = -5518 KJ/mol
CH4 (g) + 2O2(g) == CO2(g) + 2H2O (l); △H = -890.3 KJ/mol
相同质量的H2、CO、C8H18、CH4完全燃烧时,放出热量最少的是:
A.H2 (g) B.CO(g) C.C8H18 (l) D.CH4 (g)
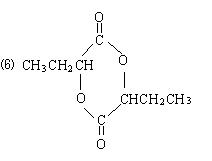
5.下列叙述不正确的是:
A.硝酸银溶液通常保存在棕色试剂瓶中,是因为硝酸银见光易分解
B.氢氧化钠标准溶液滴定未知浓度的醋酸溶液时,应选择酚酞作指示剂
C.AgCl + NaBr == AgBr + NaCl能在水溶液中进行,是因为AgBr比AgCl更难溶于水
D.常温下浓硫酸可贮存在铁制或铝制容器中,说明常温下铁和铝与浓硫酸不反应
6.下列各组离子一定能大量共存的是:
A.含有大量Al3+的溶液中:NH4+、Na+、Cl-、HCO3-
B.在强碱溶液中:Na+、K+、AlO2-、CO32-
C.在c(H+)=10-13mol·L-1的溶液中:NH4+、Mg2+、SO42-、NO3-
D.在pH=1的溶液中:K+、Fe2+、Cl-、NO3-
7.下列各组中,两种气体的分子数一定相等的是:
A.温度相同、体积相同的O2和N2 B.体积相等、密度不等的N2和C2H4
C.体积相等、密度相等的CO和C2H4 D.压力相同、体积相同的N2和O2
8.根据以下实验事实,判断四种微粒在酸性条件下,氧化性由强到弱的顺序是:
①向FeC13溶液中滴加KI溶液,再加入CC14振荡,CCl4层呈紫红色
②向FeC12溶液中加入氯水,再加入KSCN溶液,呈红色
③向KMnO4溶液中加入浓盐酸,振荡后紫色褪去
A.I2>C12>Fe3+>MnO4- B.MnO4->C12>Fe3+>I2
C.Cl2>I2>Fe3+>MnO4- D.Fe3+>MnO4->Cl2>I2
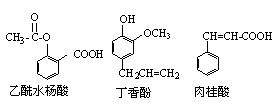 9.可用于鉴别以下三种化合物的一组试剂是:
9.可用于鉴别以下三种化合物的一组试剂是:
①银氨溶液 ②溴的四氯化碳溶液 ③氯化铁溶液 ④氢氧化钠溶液
A.②与③ B.③与④ C.①与④ D.①与②
10.常温下,在一定体积pH =12的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀时,溶液pH =11。若反应后溶液的体积等于Ba(OH)2溶液和NaHSO4溶液体积之和,则Ba(OH)2溶液和NaHSO4溶液体积之比是:
A.1:9 B.1:1 C.1:2 D.1:4
二.选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就为0分)
11. 科学家最近发现2种粒子:第一种是只由四个中子构成的粒子,这种粒子称为“四中子”,也有人称之为“零号元素”;第2种是由四个氧原子构成的分子。下列有关这两种粒子的说法不正确的是:
A、“四中子”不显电性 B、“四中子”的质量数为4
C、第2种粒子是氧元素的另一种同位素 D、第2种粒子的化学式O4
12.下列反应的离子方程式错误的是:
A.向碳酸氢钙溶液中加入过量氢氧化钠
Ca2++2HCO3-+2OH-==CaCO3↓+2H2O+CO32-
B.等体积等物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合
Ba2++2OH-+NH4++HCO3-==BaCO3↓+NH3·H2O+H2O
C.在溴化亚铁溶液中通入过量的氯气:Cl2+2Fe2++2Br-==2Fe2++2Cl-+Br2
D.过量CO2通入氢氧化钠溶液中:CO2+2OH-==CO32-+H2O
13.对反应 4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)(正反应放热),下列有
4NO(g)+6H2O(g)(正反应放热),下列有
关叙述正确的是:
A.对NH3与O2的反应来说,化学反应速率关系是2v(NH3)=3v(H2O)
B.若单位时间内生成X mol NO的同时,消耗X mol NH3,则反应达到平衡状态
C.达到化学平衡时,若扩大容器体积,则正反应速率减小,逆反应速率增大
D.若降低温度,达到新的化学平衡时,NO的体积分数将增大
14.常温下将稀NaOH溶液与稀CH3COOH溶液混合,不可能出现的结果是:
A.pH>7,且 c(OH—) > c(Na+) >c(CH3COO—)>c(H+)
B.pH>7,且 c(Na+) + c(H+) = c(CH3COO—) + c(OH—)
C.pH<7,且c(CH3COO—) > c(H+) >c(Na+)> c(OH—)
D.pH=7,且c(CH3COO—) > c(Na+) >c(H+) = c(OH—)
15.A、B、C、D四种短周期元素的原子半径依次减小,A与C的核电荷数之比为3:4,D能分别与A、B、C形成电子总数相等的分子X、Y、Z.下列叙述正确的是:
A.X、Y、Z的稳定性逐渐减弱 B.A、B、C、D只能形成5种单质
C.X、Y、Z三种化合物的熔沸点逐渐升高
D.自然界中存在多种由A、B、C、D四种元素组成的化合物
16.设NA为阿佛加德罗常数,下列说法不正确的是:
A.标准状况下的22.4L辛烷完全燃烧,生成二氧化碳分子数为8NA
B.18g水中含有的电子数为10NA
C.46g 二氧化氮和46g四氧化二氮含有的原子数均为3NA
D.在1L2mol/L的硝酸镁溶液中含有的硝酸根离子数为4NA
17.常温下,体积相等,pH值都是3的盐酸和醋酸,分别加水稀释到pH等于4,然后用
0.01mol/L的烧碱溶液将酸中和,下列说法中正确的是:
A. 稀释前盐酸和醋酸的物质的量浓度相等 B.稀释后醋酸溶液的体积较大
C. 中和醋酸所用烧碱溶液的体积较大 D. 完全中和后两种溶液的pH值仍然相等
18.KO2的晶体结构和NaCl相似,可以看作是Na+的位置用K+代替,Cl- 的位置用O2-代替,下列对KO2晶体结构的描述正确的是:
A.和K+距离相同且最近的O2- 共有8个 B.和K+ 距离相同且最近的K+共有8个
C.和K+距离相同且最近的O2- 构成的多面体是正八面体
D.和K+距离相同且最近的O2- 构成的多面体是正六面体
19.一种新型燃料电池,一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2- 。下列对该燃料电池说法正确的是:
A. 在熔融电解质中,O2-由负极移向正极
B. 电池的总反应是:2C4H10+13O2=8CO2+10H2O
C.通入空气的一极是正极,电极反应为:O2+4e- =2O2-
D.通入丁烷的一极是正极,电极反应为:C4H10+26e-+13O2- =4CO2+5H2O
20、在恒温时,一固定容积的容器内发生如下反应:2NO2(g) ![]() N2O4(g)
达平衡时,再向容器内通入一定量的NO2(g) ,重新达到平衡后,与第一次平衡时相比,NO2 的体积分数:
N2O4(g)
达平衡时,再向容器内通入一定量的NO2(g) ,重新达到平衡后,与第一次平衡时相比,NO2 的体积分数:
A.不变 B.增大 C.减小 D.无法判断
第Ⅱ卷 (非选择题,共80分)
三.本题包括3小题,共30分
21.(6分)⑴H2O2溶液滴入含有酚酞的NaOH溶液中,红色消失。甲同学认为这是由于H2O2是二元酸(H2O2![]() H++HO2-),消耗了OH-,而使红色褪去。乙同学认为H2O2具有强氧化性,将酚酞氧化,红色消失。试设计一个实验论证甲、乙两位同学的解释中谁正确。
H++HO2-),消耗了OH-,而使红色褪去。乙同学认为H2O2具有强氧化性,将酚酞氧化,红色消失。试设计一个实验论证甲、乙两位同学的解释中谁正确。
(2)甲同学向品红溶液中通入一种气体后,品红褪色。乙同学设计了一个很简单的实验便知甲同学通的是Cl2还是SO2。他的实验方案是
。
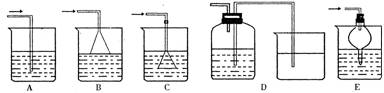
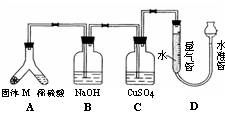 22.(14分)某课外兴趣小组为了探究铁与硫在隔绝空气的条件下反应所得固体M的成分,设计了如右图装置。倾斜A使稀硫酸(足量)与固体M充分反应,待反应停止后,B装置增重,C装置中溶液无变化,反应后进入量气管气体的体积为VmL(已折算成标准状况)
22.(14分)某课外兴趣小组为了探究铁与硫在隔绝空气的条件下反应所得固体M的成分,设计了如右图装置。倾斜A使稀硫酸(足量)与固体M充分反应,待反应停止后,B装置增重,C装置中溶液无变化,反应后进入量气管气体的体积为VmL(已折算成标准状况)
由上述实验事实可知:
⑴①固体M中一定有的物质是_____________(填化学式)
理由是______________________________________________________________________
②其中一种物质的质量可以确定为___________g(用代数式表示)。
⑵B装置的名称是________。
写出B装置中反应的离子方程式_______________________________________。
⑶C装置的作用是_________________________,如果实验中没有B装置,则C装置中产生的现象是_____________________________________________________________。
⑷稀硫酸和固体M反应后溶液中还残留淡黄色固体,该固体是_____________,要分离出该固体,在实验操作中,除烧杯外还需要用到的玻璃仪器是_____________。
⑸通过进一步实验,测得固体M中各种成分的质量之和小于反应前铁粉和硫粉的质量之和,产生这种现象的原因可能是_____________
a.M中有未反应的铁和硫 b.测定气体体积时水准管的水面高于量气管的水面
c.A中留有反应生成的气体 d.气体进入D装置前未用浓硫酸干燥
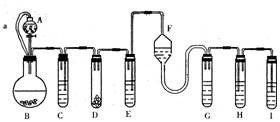 23.(10分)“化学多米诺实验”是利用反应中气体产生的压力和虹吸作用原理,使若干化学实验依次发生,整个过程只需控制第一个反应,就好像多米诺骨牌一样。下面就是一个“化学多米诺实验”。
23.(10分)“化学多米诺实验”是利用反应中气体产生的压力和虹吸作用原理,使若干化学实验依次发生,整个过程只需控制第一个反应,就好像多米诺骨牌一样。下面就是一个“化学多米诺实验”。
各装置中试剂或物质为:A——2mol·L—1H2SO4;B——Zn;C——2mol·L—1 H2SO4+CuSO4;
D——Zn E——CuSO4溶液;F——NH3·H2O;G——30%H2O2;H——H2S溶液;I——NaOH溶液。已知:Cu2++4NH3·H2O=[Cu(NH3)4]2++4H2O,该反应的产物可作H2O2分解的催化剂。
请回答下列问题:
(1)“化学多米诺实验”成功的关键之一是控制好第一个反应,之二是__________________。
(2)B与D两容器中反应速率比较B________D(填>、<、=),原因________________________
(3)H中的现象________________________________
(4)I的作用是(用离子方程式表示)________________________,
(5)A和B之间的导管a的作用是________________________。
(6)在该实验中涉及的反应类型是(填序号) ________。
A.分解反应 B.化合反应 C.置换反应 D.复分解反应
(7)如果从H中导出的气体是极易溶于水的气体,下列哪个装置能代替I? ________
四.本题包括3小题,共30分
24.(8分) 化学中用类比的方法可预测许多物质的性质。
如根据H2+Cl2![]() 2HCl 推测:H2+Br2
2HCl 推测:H2+Br2![]() 2HBr。但类同是相对的,如根据2Na2O2+2CO2
2HBr。但类同是相对的,如根据2Na2O2+2CO2![]() 2Na2CO3+O2 类推:2Na2O2+2SO2
2Na2CO3+O2 类推:2Na2O2+2SO2![]() 2Na2SO3+O2是错误的,应该为:Na2O2+SO2
2Na2SO3+O2是错误的,应该为:Na2O2+SO2![]() Na2SO4。
Na2SO4。
⑴下列各组类比中正确的是 。
A.NH4Cl![]() NH3↑+HCl 推测:NH4I
NH3↑+HCl 推测:NH4I![]() NH3↑+HI↑
NH3↑+HI↑
B.由CO2+Ca(ClO)2+H2O![]() CaCO3↓+2HClO
CaCO3↓+2HClO
推测:SO2+Ca(ClO)2+H2O![]() CaSO3↓+2HClO
CaSO3↓+2HClO
C.由2CO2+Ca(ClO)2+2H2O![]() Ca(HCO)2+2HClO
Ca(HCO)2+2HClO
推测:CO2+NaClO+H2O![]() NaHCO3+HClO
NaHCO3+HClO
D.由Na2SO3+2HCl![]() 2NaCl+H2O+SO2↑
2NaCl+H2O+SO2↑
推测:Na2SO3+2HNO3![]() 2NaNO3+H2O+SO2↑
2NaNO3+H2O+SO2↑
⑵根据2Na + 2 H2O![]() 2 NaOH + H2↑的反应推断Na与液NH3反应的方程式为:
2 NaOH + H2↑的反应推断Na与液NH3反应的方程式为:
________________________________________________________________。
⑶由氢氧化铁与盐酸反应生成氯化铁和水,应用有关化学知识,推断写出氢氧化铁与氢碘酸反应的化学方程式_________________________________________________________。
⑷从2F2+2H2O![]() 4HF+O2反应预测2F2+4NaOH
4HF+O2反应预测2F2+4NaOH![]() 4NaF+2H2O+O2然而经试验,物质的量相等的氟气和氢氧化钠正好完全反应,生成氟化钠、水和放出一种气体,请根据实验结果写出化学反应方程式____________________________________________________。
4NaF+2H2O+O2然而经试验,物质的量相等的氟气和氢氧化钠正好完全反应,生成氟化钠、水和放出一种气体,请根据实验结果写出化学反应方程式____________________________________________________。
25.(10分)某化学兴趣小组,专门研究了氧族元素及其某些化合物的部分性质。所查资料如下:
(1)碲(Te)为固体,H2Te为气体,Te和H2不能直接化合生成H2Te
(2)等物质的量氧气、硫、硒、碲与H2反应的焓变情况如图所示:
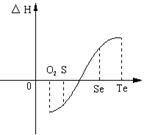
请回答下列问题:
(1)H2与硫化合的反应 热量(填“放出”或“吸收”)。
(2)已知H2Te分解反应的△S>0,请解释为什么Te和H2不能直接化合
。
(3)H2S的水溶液显弱酸性,写出其电离方程式 ;在一定温度下,它的第一级电离常数可用 Ka表示,Ka 值越大,表示_________________,Ka值大小与温度的关系是:温度升高,Ka 值__________(填一定增大、一定减小、或可能增大也可能减小)。
(4)在容积均为1 L(容器体积不可变)的甲、乙两个容器中,分别加入2 mol SO2、
1 mol O2 和4 mol SO2、2 mol O2,在相同温度、催化剂下使其反应。最终达到平衡后,两容器中SO2转化率分别为α甲、α乙,甲容器中平衡常数表达式为 ,此时α甲 α乙(填“大于”、“小于”或“等于”)。
26.(12分)向溴水中加入足量的乙醛溶液,可以看到溴水褪色,对产生该现象的原因有如下三种猜想:①溴水与乙醛发生取代反应;②由于乙醛分子中有不饱和键,溴水与乙醛发生加成反应;③由于乙醛具有还原性,溴水将乙醛氧化为乙酸。为探究哪种猜想正确,一研究性学习小组提出了如下两种实验方案:
方案一:检验褪色后溶液的酸碱性;
方案二:测定反应前溴水中Br2的物质的量和反应后溶液中Br—离子的物质的量。
⑴方案一是否可行 填(“是”或“否”),理由是 。
⑵假设测得反应前溴水中Br2的物质的量为amol,若测得反应后n(Br—)= mol,则说明溴水与乙醛发生取代反应;若测得反应后n(Br—)= mol,则说明溴水与乙醛发生加成反应;若测得反应后n(Br—)= mol,则说明溴水将乙醛氧化为乙酸。
⑶按物质的量之比为1:5配制1000mLKBrO3—KBr溶液,该溶液在酸性条件下完全反应可生成0.5molBr2。 取该溶液10mL加入足量乙醛溶液,使取褪色,然后将所得溶液稀释为100mL,准确量取其中10mL,加入过量的AgNO3溶液,过滤、洗涤、干燥后称量得到固体0.188g。若已知CH3COOAg易溶于水,试通过计算判断溴水与乙醛发生反应的类型为 (选填猜想序号)。①取代反应;②加成反应;③氧化反应
⑷写出上述测定过程中的三个反应的离子方程式:
①KBrO3和KBr在酸性条件下的反应 :_________________________________ ;
②溴水与乙醛的反应:___________________________________________________ ;
③测定Br— 离子含量的反应:_____________________________________________ 。
五.本题包括2小题,共20分
27.(8分)已知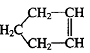 可简写为
可简写为
降冰片烯的分子结构可表示为: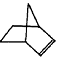
(1)降冰片烯属于__________。
a.环烃 b.不饱和烃 c.烷烃 d.芳香烃
(2)降冰片烯的分子式为__________。
(3)降冰片烯的一种同分异构体(含有一个六元环的单环化合物)的结构简式为__________。
(4)降冰片烯不具有的性质__________。
a.能溶于水 b.能发生氧化反应 c.能发生加成反应 d.常温常压下为气体
28.(12分)已知![]() (注:R,R’为烃基)
(注:R,R’为烃基)
A为有机合成中间体,在一定条件下发生消去反应,可能得到两种互为同分异构体的产物,其中的一种B可用于制取合成树脂、染料等多种化工产品。A能发生如下图所示的变化。
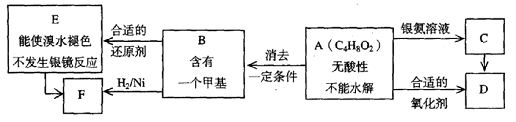
试回答:
(1)写出符合下述条件A的同分异构体结构简式(各任写一种):
a.具有酸性______________________b.能发生水解反应______________________
(2)A分子中的官能团是_____________,D的结构简式是_____________。
(3)C→D的反应类型是___________,E→F的反应类型是___________
a.氧化反应 b.还原反应 c.加成反应 d.取代反应
(4)写出化学方程式:A→B____________________________________________。
(5)写出E生成高聚物的化学方程式:____________________________________________。
(6)C的同分异构体Cl与C有相同官能团,两分子Cl脱去两分子水形成含有六元环的C2,写出C2的结构简式:______________________________
四校联考化学试卷(参考答案)
一、二 选择题(共70分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | C | D | C | B | D | B | C | B | A | D |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | C | CD | D | AD | CD | A | BC | C | BC | C |
三.本题包括3小题,共30分
21.(6分)(1)向褪色后的混合溶液中加入NaOH溶液,若混合液变红,则甲同学正确;若混合液不变红,则乙同学正确。(3分)
⑵将溶液加热,如果溶液变红则说明通入的气体是SO2,
不变红则说明通入的气体是Cl2。(3分)
22.(14分)(1)①FeS、Fe (2分) B装置增重、量气管有气体。(2分)
② V/11200 (2分)
(2)洗气瓶(1分) 2OH-+H2S → 2H2O+S2- (1分)
(3)证明H2S已被完全吸收(1分) 黑色沉淀(1分)
(4)硫 (1分) 漏斗、玻璃棒(1分) (5) b、C (2分)
23.(10分)(1)整个装置气密性良好(1分)
(2) <;(1分)D中构成原电池,加快了反应进行 (1分)
(3)溶液变浑浊(1分)
(4)H2S+2OH—=2H2O + S2— (1分) (5)平衡烧瓶内的气压,使液体易于滴下(1分)
(6)ACD(2分) (7)BDE(2分)
四.本题包括3小题,共30分
24.(8分) (1)C; (2)2Na+2NH3==2NaNH2+H2↑;
(3)2Fe(OH)3+6HI==2FeI2+I2+6H2O; (4)2F2+2NaOH==2NaF+OF2+H2O。
25.(10分)
(1)放出(1分);
(2)题中已知H2Te分解反应的△S>0,那么碲与氢气如果反应则其△S<0(1分);由图可知:H2和Te的反应是一个吸热反应,即△H>0 (1分)。所以该反应不能发生。
![]() (3)
(2分,只写第一步电离也得分);
(3)
(2分,只写第一步电离也得分);
电离程度越大(或酸性越强)(1分);一定增大(1分)。
(4)K = α甲2/(1-α甲)3(2分);小于(1分)
26.(12分) ⑴否(1分),溴水中含有HBr,溶液本身呈酸性(1分);
⑵a 0 2a(各1分) ⑶ ③(2分)
⑷①BrO3-+5Br-+6H+=3Br2+3H2O (2分)
②CH3CHO+Br2+H2O→CH3COOH+2H++2Br- (2分)
③Ag++Br-=AgBr(1分)
五.本题包括2小题,共20分
27.(8分)
(1)b (2)C7H10 (3) ![]() (4)a、d
(4)a、d
28.(12分)
(1)a、CH3CH2CH2COOH b、CH3CH2COOCH3
(2)羟基、醛基 CH3COCH2COOH
(3)a; b、c
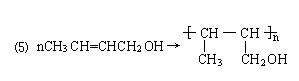 (4)CH3CHOHCH2CHO → CH3CH=CHCHO+H2O
(4)CH3CHOHCH2CHO → CH3CH=CHCHO+H2O