高三化学上学期摸底测试试题
本试卷分选择题和非选择题两部分,共 10页,满分150分,考试用时120分钟。
注意事项:
1.答题前,考生务必将自己的姓名、考号、考试科目用铅笔涂写在答题卡上。
2.每小题选出答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其它答案。答案不能答在试题上。
可能用到的相对原子质量:H-1 C-12 O-16 N-14 Na-23 Cl-35.5
第一部分(选择题 共70 分)
一、选择题(本题包括10小题,每小题3分,共30分。每小题只有一个选项是符合题意。)
1.遇有下列情况,及时处理有误的是( )
A.误食重金属盐,立即喝生牛奶或蛋清
B.皮肤不慎沾有苯酚,立即用酒精擦洗
C.金属钠着火,立刻用砂子覆灭
D.晚间进入厨房,闻有很浓的煤气味,立即开灯检查
2.下列各原子或离子的电子排布式错误的是( )
A.Si 1s22s22p2 B.O2- 1s22s22p6
C.Na+ 1s22s22p6 D.Al 1s22s22p63s23p1
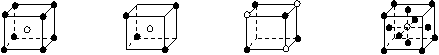 3.有下列离子晶体的空间结构示意图。图中●和化学式中M分别代表阳离子,图中○和化学式中N分别代表阴离子,则化学式为MN2的晶体结构为
3.有下列离子晶体的空间结构示意图。图中●和化学式中M分别代表阳离子,图中○和化学式中N分别代表阴离子,则化学式为MN2的晶体结构为
A B C D
4.氨气分子空间构型是三角锥形,而甲烷是正四面体形,这是因为
A.两种分子的中心原子杂化轨道类型不同,NH3为sp2型杂化,而CH4是sp3型杂化。
B.NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化轨道。
C.NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强。
D.氨气分子是极性分子而甲烷是非极性分子。
5.在密闭容器里,A与B反应生成C,其反应速率分别用![]() 、
、![]() 、
、![]() 表示,已知2
表示,已知2![]() =3
=3![]() 、3
、3![]() =2
=2![]() ,则此反应可表示为
,则此反应可表示为
A、2A+3B=2C B、A+3B=2C C、3A+B=2C D、A+B=C
6.下图各容器中盛有海水,铁在其中被腐蚀时由快到慢的顺序是
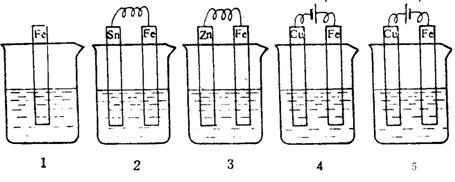
A、 4>2>1>3>5 B、 2>1>5>3>4
C、 5>4>2>3>1 D、 3>5>2>4>1
7.实验室用乙醇和浓硫酸混合加热制得的乙烯气体中含少量SO2(记为混合气体①),碳与浓硫酸共热生成的气体中有CO2和SO2(记为混合气体②)。欲除去这两种混合气体中的SO2,下列说法正确的是:
A、都可通过盛有酸性KMnO4溶液的洗气瓶
B、都可通过盛有NaOH溶液的洗气瓶
C、①可用酸性KMnO4溶液洗气,②可用NaOH溶液洗气
D、①可用NaOH溶液洗气,②可用酸性KMnO4溶液洗气
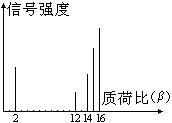 8.2002年诺贝尔化学奖获得者的贡献之一是发明了对有机分子的结构进行分析的质谱法。其方法是让极少量(10-9 g左右)的化合物通过质谱仪的离子化室使样品分子大量离子化,少量分子碎裂成更小的离子。如C2H6离子化后可得到C2H6+、C2H5+、C2H4+、……然后测定其质荷比β。设H+的质荷比为1,某有机物样品的质荷比如下图(假设离子均带一个单位正电荷,信号强度与该离子多少有关),则该有机物可能是:
8.2002年诺贝尔化学奖获得者的贡献之一是发明了对有机分子的结构进行分析的质谱法。其方法是让极少量(10-9 g左右)的化合物通过质谱仪的离子化室使样品分子大量离子化,少量分子碎裂成更小的离子。如C2H6离子化后可得到C2H6+、C2H5+、C2H4+、……然后测定其质荷比β。设H+的质荷比为1,某有机物样品的质荷比如下图(假设离子均带一个单位正电荷,信号强度与该离子多少有关),则该有机物可能是:
A、CH3OH B、C3H8
C、C2H4 D、CH4
![]()
![]() 9.某有机物的分子结构如下表示:CH3-CH-C≡C-CH=CH- -CH3 ,该分子中最多可以有多少个原子共平面:
9.某有机物的分子结构如下表示:CH3-CH-C≡C-CH=CH- -CH3 ,该分子中最多可以有多少个原子共平面:
A、19 B、20 C、21 D、22
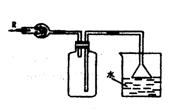 10.在实验室里可按右图所示装置干燥收集气体R,并吸收多余的R气,则R是
10.在实验室里可按右图所示装置干燥收集气体R,并吸收多余的R气,则R是
A.CH4 B.HCl C.Cl2 D.NH3
二、选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。若正确答案只包含一个选项,多选时,该题为零分;若正确答案包含两个选项,只选一个且正确的得2分,选两个且都正确的得4分,但只要选错一个,该小题就为零分)
11、95年美国教授Lagow合成了一种链式炔碳:……—C≡C—C≡C—C≡C—……。该物质的一个分子中含300~500个碳原子,性质很活泼。则下列说法错误的是:
A、该物质的熔点比金刚石低
B、该物质可以使溴水褪色
C、该物质属于炔烃
D、该物质与金刚石互为同素异形体
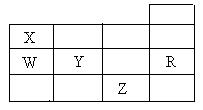 12.右表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是
12.右表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是
A.常压下五种元素的单质中,Z单质的沸点最高
B.Y、Z的阴离子电子层结构都与R原子的相同
C.W的氢化物的沸点比X的氢化物的沸点高
D.Y元素的非金属性比W元素的非金属性强
![]() 13.可以充分说明反应P(g)+Q(g) R(g)+S(g)在恒温下已达到平衡的是
13.可以充分说明反应P(g)+Q(g) R(g)+S(g)在恒温下已达到平衡的是
A.反应容器内的压强不随时间改变
B.反应容器内P、Q、R、S四者共存
C.P的生成速率和S的生成速率相等
D.反应容器内的气体总物质的量不随时间变化
14.已知在1×105Pa、298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是
A、H2O(g)=H2(g)+![]() O2(g);
O2(g);![]() H= +242kJ·mol-1
H= +242kJ·mol-1
B、2H2(g)+O2(g)+2H2O(l);![]() H= -484kJ·mol-1
H= -484kJ·mol-1
C、H2(g)+![]() O2(g)=H2O(g);
O2(g)=H2O(g);![]() H= +242kJ·mol-1
H= +242kJ·mol-1
D、2H2(g)+O2(g)=2H2O(g);![]() H= -484kJ·mol-1
H= -484kJ·mol-1
15.pH值相等的盐酸(甲)和醋酸(乙),分别与锌反应,若最后锌已全部溶解且放出气体一样多,为此下列说法正确的是
A.反应开始时的速率:甲=乙 B.反应所需时间:甲<乙
C.反应开始时,酸的物质的量浓度:甲<乙 D.反应结速时,pH值:甲<乙
![]() 16.某链状有机物分子含n个—CH2—,m个 ,a个—CH3,其余为羟基。则羟基个数为:
16.某链状有机物分子含n个—CH2—,m个 ,a个—CH3,其余为羟基。则羟基个数为:
A、2n+3m-a B、n+m+a C、m+2-a D、m+2n+2-a
17.近几年一种新型的甜味剂——木糖醇悄悄地走入生活,进入人们的视野,因为木糖醇是一种理想的蔗糖代替品,它具有甜味足,溶解性好,防踽齿,适合糖尿病患者的优点。木糖醇是一种白色粉末状的结晶,分子式为C5H12O5,结构简式为:CH2OH(CHOH)3CH2OH,下列有关木糖醇的叙述中不正确的是:
A、木糖醇是一种五元醇
B、木糖醇是一种无糖型植物甜味剂
C、木糖醇跟葡萄糖、果糖一样,属于单糖
D、木糖醇理论上可以分子内脱水生成环醚
18.甲基丙烯酸甲酯是世界上年产量超过100万吨的高分子单体,旧法合成的反应是:
(CH3)2 C=O + HCN —→ (CH3)2 C(OH)CN
(CH3)2C(OH)CN + CH3OH + H2SO4 —→ CH2=C(CH3)COOCH3 + NH4HSO4
![]()
|
与旧法比较,新法的优点是:
A、原料无爆炸危险 B、原料都是无毒物质
C、没有副产物,原料利用率高 D、对设备腐蚀性较小
19.硅橡胶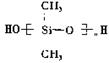 是由二甲基二氯硅烷(
是由二甲基二氯硅烷(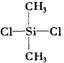 )经两种反应而制得的,这两种反应依次是
)经两种反应而制得的,这两种反应依次是
A.消去、加聚 B.水解、缩聚 C.氧化、缩聚 D.取代、缩聚
20.2005年9月始,“禽流感”在全球部分地区爆发,引起了人们继“非典型性肺炎”之后的世界范围内的恐慌。做好环境消毒是预防“禽流感”的重要措施,常用的消毒剂是ClO2或Cl2等的稀溶液,其中ClO2溶液的消毒效果较好。已知ClO2常温下呈气态,其分子构型与水分子的分子构型相似,在自然环境中ClO2最终变为Cl-,下列有关说法中正确的是( )
A.ClO2的分子结构呈V型,属非极性分子
B.ClO2中氯元素显+4价,具有很强的氧化性,其消毒效率(以1mol物质得电子的数目表示)是Cl2的5倍
C.ClO2、Cl2的稀溶液用于环境消毒,具有广谱高效的特点,对人畜无任何危害
D.常用Na2SO3在H2SO4的酸性条件下,还原NaClO3来制ClO2,这一反应的化学方程式可表示为Na2SO3 + 2NaClO3 + H2SO4 = 2Na2SO4 + 2ClO2↑+ H2O
第二部分(非选择题 共80分)
三、(本题含3小题,共28 分)
21.(10分)Ⅰ.下表中的实线表示元素周期表的部分边界。①-⑤分别表示元素周期表中对应位置的元素。
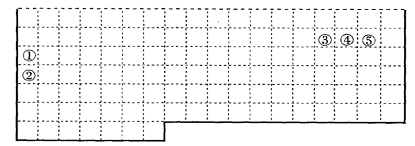
(1)请在上表中用实线补全元素周期表边界。
(2)元素⑤的原子核外p电子数比s电子总数多_______个,元素③氢化物的电子式为_______。
(3)元素④—般在化合物中显_____价,但与_____形成化合物时,所显示的价态则恰好相反。
(4)在元素①的单质、元素②的单质和元素①②形成的合金这三种物质中,熔点最低的是_____。
 a.元素①的单质 b.元素②的单质
a.元素①的单质 b.元素②的单质
c.元素①②形成的合金 d.无法判断
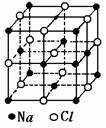
Ⅱ.已知NaCl的摩尔质量为Mg·mol-1,食盐晶体的密度为ρg·cm-3,
若右图中Na+与最邻近的Cl-的核间距离为acm,那么阿伏加德罗常数
的值可表示为
22.(8分)今有①CH3COOH、②HCl、③H2SO4 三种溶液,用序号回答下列问题
(1)当它们pH相同时,其物质的量浓度由大到小排列是__________________。
(2)当它们的物质的量浓度相同时,其pH由大到小排列是_________________。
(3)中和同一烧碱溶液,需同浓度的三种酸溶液的体积关系为 _________________。
(4)体积和浓度相同的①、②、③三溶液,分别与同浓度的烧碱溶液恰好完全反应,所需烧碱溶液的体积关系为_________________。
23.(10分)(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示可逆反应的进行程度越大,K值大小与温度的关系是:温度升高,K值______________ (填一定增大、一定减小、或可能增大也可能减小)。
(2)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:
CO(g)十H2O(g)
![]() CO2(g)十H2 (g)
CO2(g)十H2 (g) ![]() H < 0
H < 0
CO和H2O浓度变化如下图,则 0—4min的平均反应速率v(CO)=______ mol/(L·min)
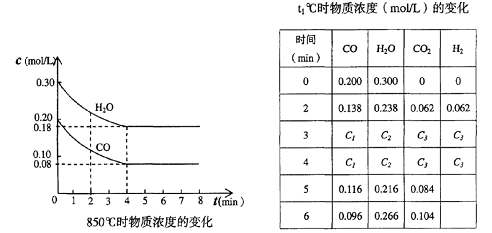
(3)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表。
①表中3min—4min之间反应处于_________状态;
C1数值_________0.08 mol/L (填大于、小于或等于)。
②反应在4min—5min问,平衡向逆方向移动,可能的原因是________(单选),
表中5min—6min之间数值发生变化,可能的原因是__________(单选)。
a.增加水蒸气 b.降低温度
c.使用催化剂 d.增加氢气浓度
四、(本题含3小题,共28 分)
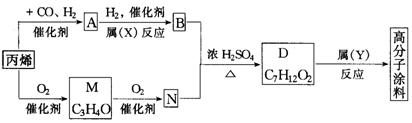 24.(10分)有一种广泛用于汽车、家电产品上的高分子涂料,是按下列流程图生产的.流程图中:A和M(C3H4O)都可发生银镜反应,M和N的分子中碳原子数相同,A的烃基上的一氯代物有3种。
24.(10分)有一种广泛用于汽车、家电产品上的高分子涂料,是按下列流程图生产的.流程图中:A和M(C3H4O)都可发生银镜反应,M和N的分子中碳原子数相同,A的烃基上的一氯代物有3种。
(1)写出下述物质的结构简式:A________,M________.
(2)物质A的同类别的同分异构体为________.
(3)N+B→D的化学方程式为____________________.
(4)反应类型:X为________,Y为________.
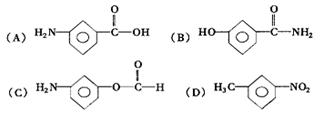
25.(11分)已知-NH2连在苯环上显碱性,![]() 连在苯环上显中性,化学式为C7H7NO2的有机物中其分子结构中有一个苯环,两个侧链(间位),符合下列条件的结构简式为:
连在苯环上显中性,化学式为C7H7NO2的有机物中其分子结构中有一个苯环,两个侧链(间位),符合下列条件的结构简式为:
(1)既有酸性又有碱性______________; (2)只有酸性__________________ ;
(3)只有碱性______________________; (4)显中性____________________。
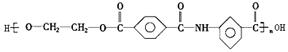
(5)由于-COOH能跟-NH2形成![]() ,所以可用乙二醇、对苯二甲酸跟上述既显酸性又显碱性的物质发生反应,生成高分子化合物[(C17H13NO5)n]。该化合物为高强度纤维材料,其结构简式为
.
,所以可用乙二醇、对苯二甲酸跟上述既显酸性又显碱性的物质发生反应,生成高分子化合物[(C17H13NO5)n]。该化合物为高强度纤维材料,其结构简式为
.
24. (7分) 我国研制的长征捆绑式火箭在第一、二级发动机中用“偏二甲(基)肼”和四氧化二氮作为液体燃料。
① 已知偏二甲(基)肼的相对分子质量为60,其中含碳40%,含氢13.33%,其余为氮;又知其分子中有一个氮原子不与氢原子相连。写出偏二甲(基)肼分子的化学式和结构简式:化学式 ,结构简式 。
② 在发动机中偏二甲(基)肼在四氧化二氮中充分燃烧,写出该燃烧反应的化学方程式(反应中所有的氮元素均转化为N2) 。
五、(本题含2小题,共24 分)
27.(12分)维生素C(水溶液呈酸性)具有明显的抗衰老作用,但易被空气氧化。新鲜水果、蔬菜、乳制品中都富含维生素C。如新鲜橙汁中维生素C的含量在500mg/L左右。某课外小组利用碘滴定法测某橙汁中维生素C 的含量,
 其反应原理为:
其反应原理为:
(1) 下列说法中正确的是( )
(A) 上述反应为取代反应 (B) 滴定时可用淀粉溶液作指示剂
(C) 滴定时可用甲基橙作指示剂 (D) 锥形瓶不能用待测橙汁润洗。
(2) 上述实验前要配制7.50×10-3mol/L的标准碘溶液100 mL。除玻璃棒外,还需要的玻璃仪器有______________等(填编号)
(A) 容量瓶 (B)烧杯 (C) 锥形瓶 (D) 烧瓶
(3) 标准碘液放入________(填仪器名称),滴定时,眼睛注视 ,直到滴定终点。滴定至终点的现象是________________。
(4) 滴定过程中能否剧烈摇动锥形瓶______(填能或不能)。为什么_____________________。
(5) 若经数据处理,滴定中消耗的标准碘溶液的体积是15.00 mL ,锥形瓶中注入的待测橙汁是20.00mL,则此橙汁中维生素C的含量是____________mg/L 该橙汁______(填“是”或“不是)纯天然的新鲜橙汁
28.(12分)某种含有少量氧化钠的过氧化钠试样(试样质量为1.560g、锥形瓶和水的质量
190.720g),利用左图装置测定混合物中Na2O2的质量分数,每隔相同时间读得电子天
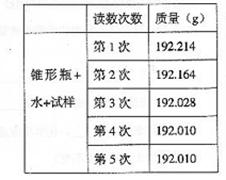
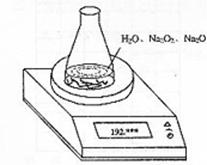 平的数据如表:
平的数据如表:
(1)写出Na2O2和H2O反应的化学方程式
(2)计算过氧化钠质量分数时,必需的数据是
不必作第6次读数的原因是
(3)测定上述样品(1.560g)中Na2O2质量分数的另一种方案,其操作流程如下:
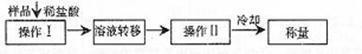
①操作Ⅱ的名称是
②需直接测定的物理量是
③测定过程中需要的仪器有电子天平、蒸发皿、酒精灯,还需要 、
(固定、夹持仪器除外)
④在转移溶液时,如溶液转移不完全,则Na2O2质量分数的测定结果
(填偏大、偏小或不变)。
参考答案
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| D | A | B | C | A | A | D | D | C | D | C | D | C | AD | AC | C | C | CD | BD | D |
21.(10分)Ⅰ.(1)略(2)1个 H:N:H (3)-2 氟 (4)C Ⅱ. M/2a3ρ
22. (8分)(1)①>②>③,(2)①>②>③,(3)①=②=2③,(4)①=②=③/2,
23.(10分)
(1) 可能增大也可能减小 (2) 0.03 (3) ①平衡 大于 ②d a
|
|
![]() (3)CH2=CHCOOH + CH3(CH2)3OH CH2=CHCOO
(CH2)3CH3+ H2O
(3)CH2=CHCOOH + CH3(CH2)3OH CH2=CHCOO
(CH2)3CH3+ H2O
 (4)加成反应,加聚反应
(4)加成反应,加聚反应
25.(11分)
26.(7分)
① 偏二甲(基)肼分子式为:C2H8N2
其结构式为:
![]() H3C
H3C
N—NH2
![]() H3C
H3C
②(3分)C2H8N2+2N2O4 2CO2↑+4H2O↑+3N2↑
27. (12分) (1)(B)(D)(2分) (2) (A)(B) (2分)
(3)酸式滴定管;锥形瓶;溶液呈蓝色(3分)
(4)不能 ;维生素C易被空气氧化 (2分)
(5)990(2分);不是(1分)
28.(12分)(1)2Na2O2+2H2O = 4NaOH+O2↑
(2)试样质量、锥形瓶加水的质量、第4(或5)次读数(或用具体数值表示),
锥形瓶内质量已达恒重
(3)①蒸发 ②NaCl的质量 ③烧杯 玻璃棒 ④偏大