高三化学上学期月考试题
化 学 试 题
本试卷90分钟
Ⅰ卷(选择题 共48分)
可能用到的相对原子量:C=12 H=1 O=16 Zn=65 Ca=40 K=39
一、选择题(每小题只有一个选项符合题意。每小题3分)
1.为迎“绿色奥运”某同不提出了下列环保建意义,其中你认为可以采纳的是 ( )
①用气态燃料代替液态和固态燃料作为发动机动力来源
②开发生产无汞电池
③提倡使用一次性发泡塑料餐具和塑料袋
④分类回收垃圾
⑤开发无磷洗涤剂
⑥提倡使用手帕,减少餐巾纸的使用
A.①②③④ B.②③④⑤ C.①②④⑤⑥ D.全部
2.随着人们生活节奏的加快,方便的小装食品已被广泛接受。为延长食品的保质期,防止
食品受潮及富脂食品氧化变质,在包装袋中应放入的化学物质是 ( )
A.无水硫酸铜、蔗糖 B.硅胶、硫酸亚铁
C.食盐、硫酸亚铁 D.生石灰、食盐
3.在一个固定容积的容器中,有可逆反应
![]() (Ⅰ)2A(g)+B(g) 2C(g);△H=+Q1kJ·mol-1
(Ⅰ)2A(g)+B(g) 2C(g);△H=+Q1kJ·mol-1
![]() (Ⅱ)3A(g) D(g)+E(g);△H=-Q2kJ·mol-1
(Ⅱ)3A(g) D(g)+E(g);△H=-Q2kJ·mol-1
下列条件均能使反应(Ⅰ)、(Ⅱ)中的A的转化率增大的是 ( )
①增大压强 ②升高温度 ③增加A的浓度
A.仅① B.①③ C.①②③ D.都不能
4.某无色溶液与NH4HCO3作用能产生气体,此溶液中一定能大量共存的离子组是( )
A.C1—、Mg2+、Zn2+、SO42— B.Na+、Ba2+、N3-、SO42-
C.MnO4-、K+、C1-、SO42- D.K+、NO3-、SO42-、Na+
5.下列叙述正确的是 ( )
A.直径介于1nm—100nm之间的微粒称为胶体
B.电泳现象可证明胶体属电解质溶液
C.利用丁达尔效应可以区别溶液与胶体
D.胶体粒子很小,可以透过半透膜
6.下列有关物质的结构或性质的叙述均错误的选项是 ( )
①水是一种非常稳定的化合物,这是由于氢键所致
②由极性键形成的分子不一定是极性分子
③结合H+的能力:SO42—>HCO3—>CO32—
④分子晶体中一定存在分子间作用力,可能有共价键
A.①② B.①③ C.②③ D.③④
7.下列反应的离子方程式书写正确的是 ( )
A.氯化铝溶液中加入过量氨水:A13++4NH3·H2O=A1O2—+4NH4++2H2O
B.澄清石灰水与少量苏打溶液混合:Ca2++OH—+HCO3—=CaCO3↓+H2O
C.碳酸钙溶于醋酸:CaCO3+2H+=Ca2++CO2↑+H2O
D.氯化亚铁溶液中通入氯气:2Fe2++C12=2Fe3++2C1—
8.1mol物质中含有的粒子数约为6.02×1023。下列叙述中正确的是 ( )
A.室温下,22.4L乙烷和乙烯的混合气体中含有的C原子数约为6.02×1023
B.标准状况下,11.2LCC14含有的分子数约为0.5×6.02×1023
C.常温常压下,17gH2O2中含有的中子数约为8×6.02×1023
D.0.5L0.5mol/L的NaNO3溶液中含有的粒子总数为0.5×6.02×1023
9.X、Y、Z为短周期元素,X原子最外层只有一个电子,Y原子的最外层电子数比内层电
子总数少4,Z的最外层电子数是内层电子总数的3倍。有关下列叙述正确的是( )
A.Y、Z两元素形成的化合物熔点较高
B.X、Y两元素形成的化合物可能为离子晶体
C.X肯定为碱金属元素
D.稳定性:Y的氢化物>Z的氢化物
10.碱性电池具有容量大、放电电流大的特点,因而得到广泛的应用。锌—锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:
Zn(s)+2MnO2(s)+H2O(1)=Zn(OH)2(s)+Mn2O3(s)。
|
A.电池工作时,锌为正极
B.电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e—=Mn2O3(s)+2OH—(aq)
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过0.2mol电子,锌的质量理论上减小13g
![]() 11.一定条件下,A(g)+3B(g) 2C(g)达到平衡的标志是 ( )
11.一定条件下,A(g)+3B(g) 2C(g)达到平衡的标志是 ( )
A.A的生成速率为B的消耗速率的3倍
B.单位时间内生成nmolA同时生成3nmolB
C.C的生成速率为A的消耗速率的2倍
D.单位时间内生成1molA同时生成2molC
12.草酸是二元中强酸,草酸氢钠溶液呈酸性。常温下,向10mL0.01/L NaHC2O4溶液中滴加0.01mol/L NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是
( )
A.V(NaOH)=0时,c(H)=1×10-2mol/L
B.V(NaOH)<10时,可能存在c(Na+)=2c(C2O42-)+c(HC2O4)
C.V(NaOH)>10时,c(H+)=1×10-7mol/L
D.V(NaOH)=10时,c(Na-)>c(HC2O4—)>c(C2O42—)
13.已知反应:①101Kpa时,2C(s)+O2(g)=2CO(g);△H=-221kJ/mol
②稀溶液中,H+(aq)+OH—(aq)=H2O(1);△H=-57.3kJ/mol
下列结论正确的是 ( )
A.碳的燃烧热为110.5kJ/mol
B.①的反应热为221kJ/mol
C.稀硫酸与稀NaOH溶液反应的中和热为-57.3kJ/mol
D.稀醋酸与稀NaOH溶液反应生成1mol水,放出热量小于57.3kJ
14.用试纸测定某无色溶液的pH时,规范的操作是 ( )
A.将pH试纸放入溶液中观察其颜色变化,跟标准比色卡比较
B.将溶液倒在pH试纸上,跟标准比色卡比较
C.用干燥洁净的玻璃棒蘸取溶液,滴在pH试纸上,跟标准比色卡比较
D.在试管内放入少量溶液煮沸,把pH试纸放在管口,观察颜色,跟标准比色卡比较
|
指超硬新材料。氮化碳晶体结构示意图如图:
下列有关氮化碳的说法中不正确的是( )
A.氮化碳晶体属于原子晶体
B.氮化碳中碳显-4价,氮显+3价
C.氮化碳的化学工为C3N4
D.每个碳原子于四个氮原子相连,每个氮原子于三个碳原子相连
16.类推是在化学学习和研究中常用的思维方法,但类推出的结论最终要经过实践的检验才能决定其正确与否,下列几种类推结论中不正确的是 ( )
A.钠、镁都是活泼金属,由金属钠和镁引起火灾都不能用干冰灭火器灭火
B.第二周期元素氢化物的稳定性顺序是:HF>H2O>NH3,则第三周期元素氢化物的稳
定顺序也是:HC1>H2S>PH3
C.NH4C1、NH4I结构相似,将两种固体分别加热,都分解生成HX和NH3
D.原电池中通常是活泼金属做负极,不活泼金属做正极,用铜和铝与浓硝酸构成原电
池时,铝却是正极
|
可能用到的相对原子量:C=12 H=1 O=16 Zn=65 Ca=40 K=39
17.(4分)下列有关实验操作的结果的说法中正确的是 。
A.将pH试纸用蒸馏水湿润后,测量某溶液的pH
B.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡
C.滴定管洗净后经蒸馏水润洗后,即可注入标准液进行中和滴定实验
D.电解盐酸溶液后(盐酸过量),再通入一定量HC1气体时,电解质溶液可恢复到和
原来一样
E.用广泛pH试纸测量Na2S溶液的pH时,得pH=10.5
F.实验室在配制FeC13溶液时,先将FeC13溶于一定量的盐酸中,再加蒸馏水稀释至所
需浓度
18.(8分)在a、b两支试管中,分别加入形态相同,质量相等的一颗锌粒,然后向两支试管中,分别加入相同物质的量浓度、相同体积的稀盐酸和稀醋酸。填写下列空白:
(1)a、b两支试管中的现象,相同点是 ;不同点是 ;原因是 。
(2)a、b两支试管中生成气体的体积,开始时a 于b,反应完毕后生成气体的总体积是a 于b(填“>”“<”“=”),原因是 。
19.(8分)X、Y、X、W是原子序数依次增大的短周期元素,且互不同族;其中只有两种为金属;X原子的最外层电子数与次外层电子数相等;X与W、Y与Z这两对原子的最外层电子数之和均为9。单质Y和W都可与浓的NaOH溶液反应。请回答下列问题:
(1)Y、Z、W的原子半径由小到大的顺序是 。
(2)ZW2它在常温下呈液态,形成晶体时,属于 晶体。
(3)Y的最高价氧化物对应的水化物显 性,写出与氢氧化钠溶液反应的离子方程式 。
(4)X与Y化学性质相似,则X与浓的NaOH溶液反应的化学方程式是
。
|
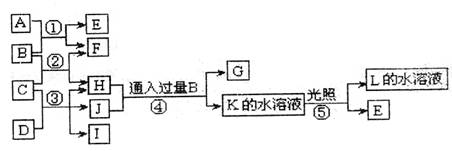
试回答:
(1)写出A的化学式: ;G的化学式 。
G在一定条件下可以转化为F,写出其反应的化学方程式
。
(2)B的电子式: 。在I中先通入NH3,再通入过量的B是工业上制备F的步骤之一,该化工生产的方法是: 。写出此步反应的化学方程式 。
(3)写出③步反庆的离子方程式 。
(4)反应①和反应⑤生成等量E时转移的电子数之比为 。
|
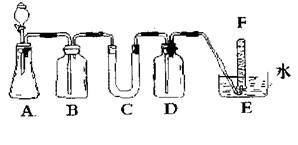
(1)对A进行气体气密性检查的最简单方法是 。
A是制取CO2的装置。写出A中发生反应的化学方程式:
。
(2)填写表中空格:
| 仪器 | 加入试剂 | 加入该试剂的目的 |
| B | 饱和NaHCO3溶液 | |
| C | ||
| D |
(3)写出过氧化钠与二氧化碳反应的化学方程式: 。
(4)试管F中收集满气体后,下一步实验操作是: 。
22.(6分)将KOH和Ca(OH)2混合物1.86g全部溶于一定量水中形成稀溶液,再缓缓通入足量的CO2气体。当生成沉淀的质量刚好最大时,消耗CO2的体积为224mL(标准状况,忽略CO2溶于水情况,以下情况相同。)
(1)原混合物中Ca(OH)2的质量为 g。
(2)沉淀恰好溶解时,消耗CO2的体积为 mL;
参考答案
选择题17个每小3分,共48分
1.C 2.B 3.A 4.D 5.C 6.B 7.D 8.C
9.B 10.B 11.D 12.B 13.D 14.C 15.B 16.C
|
18.(共8分,每空1分)
(1)都产生无色气泡(1分);a的反应速率较快(1分);因为盐到是强酸,醋酸是弱酸,盐酸中c(H+)大(2分)
(2)>(1分);=(1分);因为开始反应时盐酸中c(H+)较大,但n(H+)相等(2分)
19.(8分)(1)C1<S<A1(2分)
(2)分子(1分)
(3)两性(1分);A1(OH)3+OH—、 A1O2—+2H2O(2分)
(4)Be+2NaOH=Na2BeO2=H2↑(2分)
20.(13分)
|
|
|
(2):O::C::O:
侯氏制碱法(1分)
NH3+H2O+CO2 NH4HCO3
NaC1+NH4HCO3 NaHCO3↓+NH4C1(共2分)
(3)2OH—+C12=C1—+H2O(2分)
(4)1:2(2分)
21.(13分)
(1)在A、B之间的乳胶管上用弹簧夹夹紧,在分液漏斗中加水,打开活塞,若水流下一部分后不再流下,则气密性好。(2分)
CaCO3+2HC1=CaC12+H2O+CO2↑(2分)
| 仪器 | 加入试剂 | 加入该试剂的目的 |
| B | 除去CO2气体中混入的HC1 | |
| C | 过氧化钠 | 与CO2和水反应,产生O2 |
| D | NaOH溶液 | 吸收示反应的CO2气体 |
(3)2Na2O2+2CO2=2Na2CO3+O2(2分)
(4)把E中的导管移出水面,关闭分液漏斗活塞,用拇指堵住试管口,取出试管,立即把带火星的木条伸入试管口内,木条复燃,证明试管中收集的气体是氧气。(2分)
22.(6分)
(1)0.74g(3分)
(2)896mL(3分)