高三化学第一学期期中试卷
化学
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。考试时间100分钟。
第Ⅰ卷(选择题 共53分)
注意事项:
1.作答第Ⅰ卷前,请考生务必将自己的姓名、考试证号用书写黑色字迹为0.5毫米的签字笔填写在答题卡上。
2.第Ⅰ卷答案必须用 2B 铅笔填涂在答题卡上,在其他位置作答一律无效。每小题选出答案后,用 2B 铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na—23 Al-27 K-39 Ca—40
一、单项选择题(本题包括7小题,每小题3分,共21分。每小题只有一个选项符合题意)
1.2006年3月,温家宝指出“抓好资源节约,建设环境友好型社会”,这是我国社会和经济长期发展的重要保证。你认为下列行为与之相悖的是
A.研制对目标昆虫有毒杀作用的新型、可降解杀虫剂
B.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
C.研制开发以水代替有机溶剂的化工涂料
D.以聚苯乙烯全面代替木材,生产包装盒、快餐盒等以减少木材使用,保护森林
2.物质的颗粒达到纳米级时,具有特殊的性质。如将单质铜制成“纳米铜”时,“纳米铜”具有非常强的化学活性,在空气中可以燃烧。下列叙述中正确的是
A.常温下,“纳米铜”与铜片的还原性相同
B.常温下,“纳米铜”比铜片更易失电子
C.常温下,“纳米铜”比铜片的金属性强
D.常温下,“纳米铜”比铜片的氧化性强
3.20世纪80年代后,人们发现和证实了碳的另一类单质,它们是由一系列偶数个碳原子组成的分子,其中C60(足球烯,分子中含有30个双键)最具代表性。下图所示为n个C60连接而成的物质X。下列有关说法不正确的是
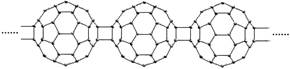
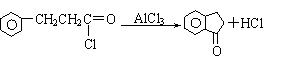
A.X难溶于水 B.一定条件下X可与H2发生加成反应
C.X是碳的一种同素异形体 D.X的摩尔质量为720n
4.通过对实验现象的观察、分析推理得出正确的结论是化学学习的方法之一。对下列实验事实的解释正确的是
| 现象 | 解释 | |
| A | KI淀粉溶液中通入Cl2,溶液变蓝 | Cl2能与淀粉发生显色反应 |
| B | 浓HNO3在光照条件下变黄 | 浓HNO3不稳定,生成有色产物能溶于浓硝酸 |
| C | 某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成 | 说明该溶液中含有SO42- |
| D | 铜片放入浓硫酸中,无明显变化 | 说明铜在冷的浓硫酸中发生钝化 |
5.某无色溶液中,若加入溴水,溴水褪色,若加入NH4HCO3,固体溶解并产生刺激性气味的气体,则该溶液中可能大量存在的离子组是
A.Na+、Mg2+、S2—、ClO— B.H+、Na+、SO42-、NO3—
C.K+、Ca2+、OH—、SO32— D.Na+、K+、Cl-、OH-
6.蒽与苯炔反应生成化合物X:
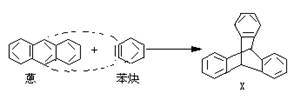
X中一个氢原子被甲基取代的所有异构体数为
A.2种 B.3种 C.4种 D.5种
7.将物质的量均为a mol的钠和铝一同投入mg水中(水足量),所得溶液的密度为ρg·cm-3,则此溶液的物质的量浓度为
A.![]() mol·L-1 B.
mol·L-1 B.![]() mol·L-1
mol·L-1
C.![]() mol·L-1 D.
mol·L-1 D. ![]() mol·L-1
mol·L-1
二、不定项选择题(本题包括8小题,每小题4分,共32分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个该小题就为0分)
8. 类推的思维方法在化学学习和研究中常会产生错误的结论,因此类推出的结论最终要经过实践的检验才能决定其正确与否。下列几种类推结论中正确的是
A.第二周期元素氢化物稳定性顺序是HF>H2O>NH3;
则第三周期元素氢化物稳定性顺序也是HCl>H2S>PH3
B.Fe3O4可写成FeO·Fe2O3;Pb3O4也可写成PbO·Pb2O3
C.可电解熔融MgCl2来制取金属镁;也能电解熔融AlCl3来制取金属铝
D.晶体中有阴离子,必有阳离子;则晶体中有阳离子,也必有阴离子
9.A、B、C为三种短周期元素,A、B在同周期, A、C的最低价离子分别为A2-和C-,B2+和
C-具有相同的电子层结构。下列说法中正确的是
A.原子序数:A>B>C B.原子半径:A>B>C
C.离子半径:A2->C->B2+ D.原子核外最外层电子数:A>C>B
10. 实验是化学研究的基础,关于下列各实验装置图的叙述中,正确的是
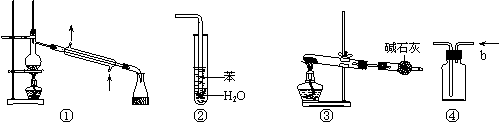 |
A.装置①常用于分离互不相溶液体混合物
B.装置②可用于吸收HCl气体,并防止倒吸
C.以NH4HCO3为原料,装置③可用于实验室制备少量NH3
D.装置④b口进气可收集CO2、NO等气体
11.NA表示阿伏加德罗常数的值,下列说法中正确的是
A.1mol甲基(-CH3)中含有7NA个电子
B.1L 0.5mol·L-1的(NH4)2SO4溶液中含有NA个NH4+
C.在铜与硫的反应中,1mol铜失去的电子数为NA
D.36g C5H12分子中含有8NA个共价键
12.U常见化合价有+4和+6,硝酸铀酰[UO2(NO3)2]加热可发生如下分解。UO2(NO3)2——UxOy+NO2↑+O2↑,在600K时,将气体产物集于试管并倒扣水中,水充满试管。则生成的铀的氧化物化学式是
A.UO2 B.UO3 C.2UO2·UO3 D.UO2·2UO3
13. 下列反应的离子方程式书写正确的是
A.过量的铁与浓硝酸反应: Fe + 6H++ 3NO3- = Fe3+ 十3NO2↑+ 3H2O
B. 次氯酸钙溶液中通入过量CO2 : ClO-+CO2 + H2O= HClO+ HCO3-
. C. 在碳酸氢镁溶液中加入足量 Ca(OH)2 溶液:
Mg2+ +2HCO3-+Ca2+ +2OH-= MgCO3↓ + CaCO3↓ + 2H2O
D.1mol·L-1 的 NaAlO2 溶液和2.5mol· L-1 的盐酸等体积混合:
2AlO2- + 5 H+= Al(OH)3 ↓+ Al3+ + H2 O
14.萜类物质中有许多都已被用于香料工业。常见的有如下几种结构(括号内表示④的结构简式), 关于上述四种香料,下列说法正确的是
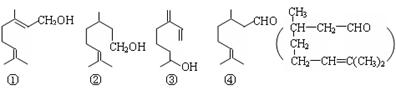
A.④是②的氧化产物 B.①③互为同系物
C.②③均属于烯烃 D.③④均能发生消去、酯化反应
15.某研究性学习小组为了探索镁粉与溴水反应的机理,做了如下四组实验:
①将镁粉投入冷水中,未见任何现象;
②将镁粉放入溴水中,观察到只是开始时产生极少量的气泡,但溴水的颜色逐渐褪去;
③将镁粉放入液溴中,未观察到任何明显现象;
④向含足量镁粉的液溴中滴加几滴水,观察到溴的红棕色很快褪去。
则下列关于镁与溴水的反应机理的论述中正确的是
A.镁粉只直接与溴水中的溴反应 B.镁粉只与溴水中的酸反应
C.产生极少量的气泡是由于镁粉与水反应得到 D.镁粉在水的催化下与溴发生反应
第Ⅱ卷(非选择题 共67分)
16.(12分)1943年我国著名的化工专家侯德榜博士发明了联合制碱法,后被命名为侯氏制碱法。侯德榜制碱法原理与索尔维法基本相同,不同之处,在析出碳酸氢钠后的母液中继续加入食盐,通入氨气,使氯化铵析出,从而得到了两种物质:碳酸钠和氯化铵,侯氏制碱法震惊了全世界,为中国人赢得了荣誉和尊重。侯氏制碱法的循环工艺流程如下:
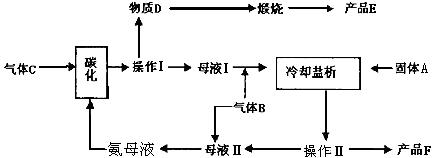
仔细阅读上图,完成下列问题:
(1) 写出碳化反应方程式: 。
(2) 气体B的电子式为 。向饱和食盐水中应先通入气体 (填气体名称),再通入气体 (填气体的结构式)才能得到物质D,其原因是
。
| |
通入气体B的装置图。
(4) 操作Ⅰ的名称是 。进行操作Ⅱ所
需要的玻璃仪器是:玻璃棒、烧杯、 。
在实验室里进行煅烧所用的主要仪器是 。
(5) 上述生产过程中能循环使用的物质是:C、B、
F、 、 。(填:物质编号)
17.(10分)工业“从海水中提取镁”的流程图如下:
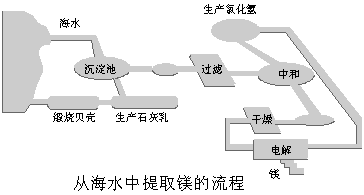
步骤为:① 将海边大量存在的贝壳煅烧成石灰,并将石灰制成石灰乳;
② 将石灰乳加入到海水沉淀池中经过滤得到Mg(OH)2沉淀;
③ 在Mg(OH)2沉淀中加入盐酸得到MgCl2溶液,再经蒸发结晶得到MgCl2·6H2O;
④ 将MgCl2·6H2O在一定条件下加热得到无水MgCl2;
⑤ 电解熔融的氯化镁可得到Mg。请回答以下问题:
(1) 步骤③中的蒸发是利用风吹日晒来完成的,而在实验室中进行蒸发操作需要的主要仪器有 、 、酒精灯、铁架台等。
(2) 步骤④中的“一定条件”指的是 ,目的是 。
(3) 上述提取镁的流程中,在降低成本、减少污染方面做了一些工作,请写出其中一点:
。
(4) 有同学认为:步骤②后可加热Mg(OH)2得到MgO,再电解熔融的MgO制金属镁,这样可简化实验步骤,体现实验的简约性原则。你同意该同学的想法吗?为什么?
你的观点是 。
理由是 。
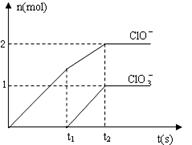 18.(8分)在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应)。生成物中含有Cl-、C1O-、C1O3-三种含氯元素的离子,其中C1O-、C1O3-两种离子的物质的量(n)与反应时间(t)的曲线如右图所示。
18.(8分)在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应)。生成物中含有Cl-、C1O-、C1O3-三种含氯元素的离子,其中C1O-、C1O3-两种离子的物质的量(n)与反应时间(t)的曲线如右图所示。
⑴t2时,Ca(OH)2与Cl2发生反应的总的化学方程式为_____________________________________________。
⑵该石灰乳中含有Ca(OH)2的物质的量是_______ mol。
⑶ 据分析,生成Ca(C1O3)2的反应是由温度升高引起的,通入氯气的速度不同,C1O-和C1O3-的比例也不同。
若在原石灰乳中通入氯气的速度加快,则反应后![]() 2(填“>”、“<”或“=”);
2(填“>”、“<”或“=”);
若![]() ,则n(C1-)= mol(用含a的代数式来表示)。
,则n(C1-)= mol(用含a的代数式来表示)。
19.(10分)下图是部分常见元素的单质及其化合物的转化关系图(有关反应的条件及生成的部分产物已略去)。
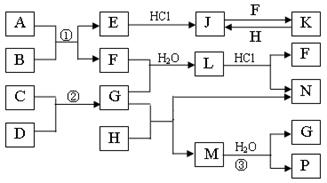
已知:E为红色固体,K为浅绿色溶液;反应②是化工生产中的重要反应;B、C、D、H是单质;B、C、D、F、G、H常温下是气态; F、P 和H的水溶液均具有漂白作用,且F是形成酸雨的主要物质之一;N是一种常见的氮肥;化合物G分子构型为三角锥形,化合物M由两种元素组成,分子内共有58个电子。
⑴化合物A中含有的两种元素是 。(填元素符号)
⑵F的化学式 ;G的水溶液中,最多的阳离子是 。
⑶写出K与H反应的离子方程式: ;
G与H反应的化学方程式: 。
⑷在实验室中,向饱和H水溶液中加入CaCO3粉末,充分反应后过滤,可制得浓度较大的P的水溶液。使用化学平衡移动原理加以解释 。
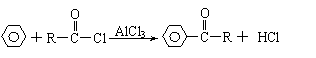 |
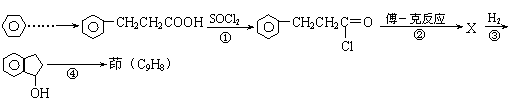
20.(8分)已知“傅-克反应”为:
下面是由苯制有机物“茚”的反应过程(有些步骤已被省去)
 |
请回答下列问题:
⑴①、③反应分别属于 、 反应(填“反应类型”);反应④的条件是 。
⑵茚的结构简式: 。
⑶写出反应②的化学方程式 。
![]()
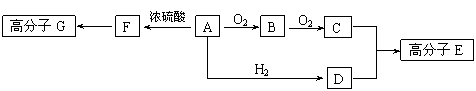
![]() 21.(11分)部分有机物之间的转化关系以及转化过程相对分子质量变化关系如下:
21.(11分)部分有机物之间的转化关系以及转化过程相对分子质量变化关系如下:
物质转化关系:R-CH2OH RCHO RCOOH
相对分子质量: M M-2 M+14
已知:物质A中只含有C、H、O三种元素,一定条件下能发生银镜反应,物质C的相对分子质量为104。A与其他物质之间的转化关系如下图所示:
 |
请回答下列问题:
⑴F中含有的官能团有 ;G的结构简式 。
⑵一定条件下B发生银镜反应的化学方程式 。
⑶由C、D在一定条件下反应还能生成环状化合物,其化学反应方程式为
。
⑷A的同分异构体很多,写出与A中所含官能团不同,但能与NaOH溶液反应各种同分异构体的结构简式: 。
22.(8分)现有一种碱金属的碳酸盐(M2CO3)和碳酸氢钠组成的混合物,取其1.896g加热至质量不再变化,把放出的气体通入足量的澄清石灰水中,得到白色沉淀0.800g。将加热后残留的固体与足量稀硫酸充分反应,生成的气体经充分干燥后通过足量的过氧化钠粉末,结果过氧化钠粉末增重0.336g。
(1)通过计算确定M2CO3的M为何种元素。
(2)有同学提出,通过简单的定性实验,也可以确定该样品中的M为何种碱金属元素。你认为该实验方案是什么?

 高三化学期中考试答卷纸
高三化学期中考试答卷纸
注意:将选择题答案涂到答题卡上!
16.(12分)(1) 。
(2) 。 (填气体名称), (填气体的结构式)
原因是
。
| |
通入气体B的装置图。
(4) 操作Ⅰ的名称是 。进行操作Ⅱ所
需要的玻璃仪器是:玻璃棒、烧杯、 。
主要仪器是 。
(5) 、 。(填:物质编号)
17.(10分)(1)主要仪器有 、 、酒精灯、铁架台等。
(2) “一定条件”指的是 ,目的是 。
(3)请写出其中一点:
。
(4) 你的观点是 。
理由是 。
18.(8分)⑴化学方程式为 。
⑵ mol
⑶ 2; n(C1-)= mol
19.(10分)⑴ 。(填元素符号)
⑵F的化学式 ;阳离子是 。
⑶写出K与H反应的离子方程式: ;
G与H反应的化学方程式: 。
⑷用化学平衡移动原理加以解释
。
20.(8分)⑴①、③反应分别属于 、 反应(填“反应类型”);反应④的条件是 。
⑵茚的结构简式: 。
⑶写出反应②的化学方程式 。
21.(11分)⑴官能团有 ;G的结构简式 。
⑵化学方程式 。
⑶化学方程式 。
⑷各种同分异构体的结构简式: 。
22.(8分)(1)通过计算确定M2CO3的M为何种元素。
(2)你认为该实验方案是什么?
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | |
| D | A | D | B | D | B | C | |
| 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| A | AC | C | CD | B | BD | AB | D |
期中考试参考答案
16、(12分)(1)NaC1+H2O+NH3+CO2→NaHCO3↓+NH4C1(1分)
(2)略(1分),氨气,O=C=O(2分),先通氨气使溶液碱性增强,能溶解更多的二氧化碳,生成较多的碳酸氢钠,使碳酸氢钠晶体析出。(2分)
(3) (1分)
(1分)
(4)过滤(1分),漏斗(1分),坩埚(1分)
(5)A、D(2分)
17、(10分)⑴蒸发皿,玻璃棒;(2分)
⑵在HCl气流中,(1分)抑制MgCl2水解成Mg(OH)2;带走水蒸气;(2分)
⑶电解产生的Cl2用于制取HCl气体;(2分)
⑷不同意。(1分)
因为MgO熔点很高,熔融时耗费大量的能量而增加生产成本(2分)
18.⑴10Ca(OH)2+10Cl2=2Ca(C1O)2+Ca(C1O3)2+7CaCl2+10H2O
⑵5
⑶< ![]() (每空2分,共8分)
(每空2分,共8分)
19.(10分)⑴S、Fe(2分)
⑵SO2 NH4+ (2分)
⑶2Fe2++ Cl2=2 Fe3+ + 2Cl- 4NH3+3Cl2=NCl3+3NH4Cl (共4分)
⑷饱和H水溶液中存在平衡:Cl2+H2O![]() H++Cl-+HClO,加入的CaCO3粉末与H+反应,平衡正向移动,HClO浓度增大 (2分)
H++Cl-+HClO,加入的CaCO3粉末与H+反应,平衡正向移动,HClO浓度增大 (2分)
20.(8分)取代、加成(2分) 浓硫酸、加热(2分)
![]() (2分)
(2分)
|
21.(11分)碳碳双键、醛基(2分)
![]()
![]() (2分)
(2分)
OHC-CH2-CHO+4Ag(NH3)2OH 4Ag+NH4OOC-CH2-COONH4+6NH3+2H2O(2分)
 HOCH2CH2CH2OH+HOOCCH2COOH
HOCH2CH2CH2OH+HOOCCH2COOH
![]() +2H2O(2分)
+2H2O(2分)
CH3CH2COOH CH3COOCH3 HCOOCH2CH3(3分)
22.(8分)⑴2NaHCO3 ~ Na2CO3 ~ CO2 ~ CaCO3
n(NaHCO3)=![]() × 2=0.016mol(2分)
× 2=0.016mol(2分)
2CO2+2Na2O2=2Na2CO3+O2 △m
2mol 56g
(0.012mol) 0.336g
加热后的n(M2CO3)=0.012mol-![]() ×0.016mol =0.004mol (2分)
×0.016mol =0.004mol (2分)
设M的相对原子质量分别为x 。
依题意:84g·mol-1×0.016mol+(2x+60)g·mol-1×0.004mol=1.896g x=39
根据碱金属的相对原子质量,可知M元素是K。(2分)
⑵对混合物进行焰色反应实验,透过蓝色的钴玻璃,若看到浅紫色火焰,则说明M元素是K。(2分)