高三化学第一学期第一次月考试卷
高三化学(高一 1~3章)
注意:本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,满分100分,考试时间为90分钟。
第Ⅰ卷(选择题,共48分)
一、选择题(本题包括16小题,每小题3分,共48分。每小题只有一个选项符合题意。)
1、欲观察氢气燃烧时火焰的颜色,燃气导管口的颜色最好是
A.钠玻璃 B.钾玻璃 C.石英玻璃 D.铜管
2、着人们生活节奏的加快,方便的小包装食品已被广泛接受,为了防
止富脂食品的氧化变质,延长食品的保质期,在包装袋中常放入抗氧化物质,下列不属于抗氧化物质的是
A、生石灰 B、还原铁粉 C、亚硫酸钠 D、维生素C
3、ClO2是一种广谱型的消毒剂,根据世界环保联盟的要求ClO2将逐渐
取代Cl2成为生产自来水的消毒剂,工业上ClO2常用NaClO3和Na2SO3溶液混合并加H2SO4酸化后反应制得,在以上反应中NaClO3和Na2SO3的物质的量之比为
A.1∶1 B.2∶1 C.1∶2 D.1∶3
4、限用硝酸、硫酸、盐酸、醋酸、钠盐、钾盐、钡盐相互反应符合离子
方程式:2H++SO32-=H2O+SO2 的化学方程式个数有
A.4 B.6 C.8 D.12
5、在给定的四种溶液中,加入以下各种离子,各离子能在原溶液中大量共存的有
A.滴加石蕊试液显红色的溶液 Fe3+ 、NH![]() 、Cl- 、SCN-
、Cl- 、SCN-
B.pH值为1的溶液 Cu2+、Na+
、Mg2+、NO![]()
C.水电离出来的c(H+)=10-13mol/L的溶液 K+、HCO![]() 、Br-、Ba2+
、Br-、Ba2+
D.所含溶质为Na2SO4的溶液 K+ 、CO![]() 、NO
、NO![]() 、Al3+
、Al3+
6、下列离子反应方程式书写正确的是
A.在Ba(OH)2溶液中加入少量的硫酸氢钠溶液
Ba2++2OH-+2H++SO![]() =BaSO4↓+2H2O
=BaSO4↓+2H2O
B.向次氯酸钙溶液中通入SO2气体
Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO
C.标准状况下,将112mLCl2缓慢注入10mL 1mol·L-1的FeBr2溶液中 2Fe2++4Br-+3Cl2 =2Fe3++6Cl-+2Br2
D.向苯酚钠溶液中通入少量CO2气体
![]()
7、某溶液中含有NO![]() 、SiO
、SiO![]() 、Al O
、Al O![]() 、S2-等四种阴离子,若向其中加入过量的盐酸溶液,微热并搅拌,再加入过量的NaOH溶液,则溶液中大量减少的阴离子是
、S2-等四种阴离子,若向其中加入过量的盐酸溶液,微热并搅拌,再加入过量的NaOH溶液,则溶液中大量减少的阴离子是
A.NO![]() AlO
AlO![]() B.SiO
B.SiO![]() S2-
S2-
C. S2- D.NO![]() S2-
S2-
8、下列说法或表示方法正确的是
A.在稀溶液中,H+(aq)+ OH-(aq)= H2O(l);△H = -57.3 kJ·mol-1,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热大于57.3 kJ
B. 由C(石墨)= C(金刚石);△H = +1.90 kJ·mol-1可知,金刚石比石墨稳定
C. 等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
D. 在101 kPa时,2 g H2 完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+ O2(g)= 2H2O(l);△H = -285.8 kJ·mol-1
9.为确证NaHCO3固体中是否含Na2CO3,下列实验操作及判断正确的是
A. 观察加热时能否放出气体
B. 观察加盐酸时能否放出气体
C. 溶于水中,加入澄清石灰水,观察是否有白色沉淀生成
D.溶于水中,滴加少量BaC12溶液,观察是否有白色沉淀生成
10、①氧化钠 ②氢氧化钠 ③过氧化钠 ④亚硫酸钠, 1mol上述固体物质长期放置于空气中,下列说法正确的是
A.上述物质都有发生了氧化还原反应
B.过氧化钠在反应中转移了2mol电子
C.质量增加的情况是①>③>④>②
D.质量增加的情况是②>①>③>④
11、在下列物质的溶液中分别加入一定量的![]() 固体,不会出现浑浊现象的是
固体,不会出现浑浊现象的是
A. 饱和溶液Na2CO3溶液 B. ![]() 稀溶液
稀溶液
C.
![]() 稀溶液
D. 饱和
稀溶液
D. 饱和![]() 溶液
溶液
12、酒精的分子式为![]() ,在质量分数为46%的酒精溶液中,酒精和水分子的个数比为
,在质量分数为46%的酒精溶液中,酒精和水分子的个数比为
A.1:1 B.1:3 C.3:1 D.23:27
13、如果a g某气体中含有的分子数为b,则c g该气体在标准状况下的体积是
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
14、已知某溶液的:①体积②密度③溶质和溶剂的质量比④溶质的摩尔质量,要根据溶质的溶解度计算其饱和溶液的物质的量浓度时,上述条件中必不可分的是
A.①②③④ B.①②③ C.②④ D. ①④
15、将40mL1.5mol•L-1CuSO4溶液与30mL3mol•L-1NaOH溶液混合,生成浅蓝色沉淀,假如溶液中Cu2+或OH-浓度都已变得很小,可忽略,则生成沉淀的组成可表示为
A、Cu(OH)2 B、CuSO4•Cu(OH)2
C、CuSO4•2Cu(OH)2 D、CuSO4•3Cu(OH)2
16、质量分数为a的某物质的溶液m g与质量分数为b的该物质的溶液n g混合后,蒸发掉p g水,得到的溶液的密度为q g/mL,物质的量浓度为C,则溶质的相对分子质量为
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
参考答案
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | C | A | B | C | B | D | D | A |
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 | D | C | C | B | A | C | D | B |
17. (6分) (1)KHCO3 (1分) (2)2.4×1022 (2分)(3)碳(C)(1分)
(4)H2O2作氧化剂,其产物是H2O;H2O没有毒性及污染性。(2分)
18.(8分)⑴ P2O3 P2O5 (各1分)
2.75 3.55 (各1分)
⑵ -(20X-Y) KJ/mol (2分)
⑶ P(s) + 3/4O2(g) == 1/2 P2O3(s);△H = -(20X-Y) KJ/mol (2分)
19. (10分) 药匙、500mL容量瓶 (2分)
(1)③ (2)② (3)② (4)② (5)② (6)① (7)③ (8)②(各1分)
20. (8分)(1) 2Na2O2+2H2O=4Na++OH-+O2↑(2分)
(2)试样质量、锥形瓶加水的质量、第4(或5)次的读数(或用具体数值表示);(1分)锥形瓶中质量已达恒重。(1分)
(3)①蒸发 (1分)②NaCl的质量(1分) ③偏大(2分)
21、(12分)
⑴A.Na2O2、 D.CO2 (各2分)
⑵2Na2O2+2H2O=4NaOH+O2 NaHCO3+NaOH=Na2CO3+H2O (各3分)
⑶ 1∶2 (2分)
22. ⑴无 (1分)、蓝(1分) 偏高(2分)
⑵ 0.25×10-4 (2分)
⑶1.75(2分)
 | |||
高三化学(高一 1~3章)
第Ⅰ卷答题卡(共48分)
一、选择题(本题包括16小题,每小题3分,共48分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | ||||||||
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 |
第Ⅱ卷(非选择题,共52分)
二、(本题包括2小题,共14分)
17、(6分)“绿色试剂”双氧水可作为矿业废液消毒剂,如要消除采矿业废液中的氰化物(如KCN),化学方程式为:
KCN+H2O2+H2O=A+NH3↑
(1)生成物A的化学式为 。
(2)在标准状况下有0.448L氨气生成,则转移的电子数为
(3)反应中被氧化的元素为
(4)H2O2被称为“绿色氧化剂”的理由是:
18、(8分) 磷在氧气中燃烧,可能生成两种固态氧化物。3.1g的单质磷(P)在3.2g的氧气中燃烧,至反应物耗尽,并放出x kJ的热量。
⑴通过计算确定反应产物的组成(用化学式表示)是 ,
其相应的质量为___ _。
⑵ 已知单质磷的燃烧热为y kJ /mol,则1mol P与O2反应生成固态P2O3 的反应热△H = ________ ________。
⑶ 写出1mol P与O2反应生成固态P2O3 的热化学反应方程式:
三、(本题包括2小题,共18分)
19、(10分)在用固体碳酸钠配制500mL 0.1mol/L碳酸钠溶液时,所用到的仪器除天平(含砝码)、烧杯、玻璃棒、胶头滴管外,还需要的仪器是: ;
下述因素使配成的溶液浓度与指定配制浓度相比是:
①偏高 ②偏低 ③无影响
(1) 称量时在托盘天平两边的托盘上放两张大小相同的白纸,然后称取所需碳酸钠固体,倒入烧杯中,用适量蒸馏水溶解_______。(填序号,下同)
(2) 称量时当砝码总和为4g,游码在刻度尺上的读数为0.4g时,天平达到平衡,配制后发现砝码和药品放颠倒了_________。
(3) 溶解碳酸钠时,因加水太多,致使洗涤时用水太少或被迫减少洗涤次数_____。
(4) 溶解碳酸钠所用烧杯不洁净,附有酸性物质________。
(5) 加蒸馏水时,不慎超过了刻度,又用胶头滴管吸出 ______。
(6) 定容时俯视观察液面___________。
(7) 容量瓶用蒸馏水洗净后,未经干燥即用来配溶液___________。
(8) 若所称的碳酸钠中含十水碳酸钠________。
20、(8分)某种含有少量氧化纳的过氧化钠试样(已知试样质量为1.560g、锥形瓶和水的质量为190.720g),利用下图装置测定混合物中![]() 的质量分数,每隔相同时间读得电子天平的数据如表:
的质量分数,每隔相同时间读得电子天平的数据如表:
(1) 写出![]() 和
和![]() 反应的离子方程式:
反应的离子方程式:
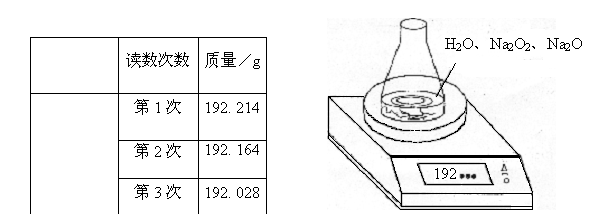
(2)计算过氧化钠质量分数时,必需的数据是 。不必做第6次读数的原因是 。
(3)测定上述样品(1.560g)中![]() 质量分数的另一种方案,其操作流程如下:
质量分数的另一种方案,其操作流程如下:
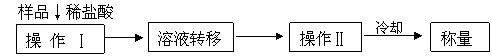 |
①操作Ⅱ的名称是 。
②需直接测定的物理量是 。
③在转移溶液时,如溶液转移不完全,则![]() 质量分数的测定结果 (填“偏大”、“偏小”或“不变” )
质量分数的测定结果 (填“偏大”、“偏小”或“不变” )
四、(本题共12分)
21、(12分)有A、B两种常见化合物组成混合物,其焰色反应均为黄色,其相互转化关系如图(其它物质均略去)。
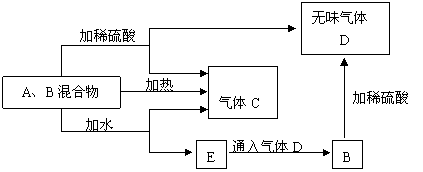
![]() 根据以上关系,回答下列问题:
根据以上关系,回答下列问题:
⑴写出电子式:
A ,D 。
⑵写出混合物中加水反应的化学方程式:
⑶加热后,若只得到一种固体化合物,则A与B的物质的量之比的最大值为 ∶ (填数字)。
五、(本题共8分)
22、(8分)某校研究性学习课外环保小组对采集气体样品中所含污染气
体CO的浓度进行测定,其方法与步骤如下:
①先使采集的气体样品2.00L缓缓通过含I2O5的加热管,发生反应:
CO + I2O5 → CO2 + I2
②将产生的I2升华,并由浓度为0.005mol•L―1的Na2S2O3溶液30.0mL完全吸收,此时发生反应:I2 + S2O32― → I― + S4O62―
③向②的溶液中加4滴淀粉溶液作指示剂,用浓度为0.01mol•L―1的I2水滴定,耗去5.00mL的溶液恰好变色。
⑴操作③中,滴定终点时溶液由___________色变为_________色。若在用I2水滴定操作读数时,滴定前仰视将会导致测得的CO浓度_________。(填“偏高” 、“偏低” 、“不影响” )
⑵步骤①中由CO与I2O5反应生成I2的物质的量是 mol。
⑶该气体样品中CO的浓度为 mg•L―1