高三化学第一学期第一次月考试题
化 学 试 卷
YC 本试卷分为第Ⅰ卷选择题和第Ⅱ卷(非选择题)两部分,共120分。考试时间100分钟.
注意事项:
答题前,考生务必将自己的姓名、班级、学号写在答题纸的密封线内。选择题答案按要求填涂在答题纸上;非选择题的答案写在答题纸上对应题目的答案空格内,答案不要写在试卷上。考试结束后,交回答题纸。
可能用到的相对原子质量:H:1 C:12 N:14 O:16 Mg:24 Ca:40
第I卷选择题(共57分)
一、选择题(本题包括10小题,每小题3分,共30分。每小题只有1个选项符合题意)
1、下列依据热化学方程式得出的结论正确的是
A.已知2H2(g)+O2(g)=2H2O(g);△H=-483.6 kJ· mol—1
则氢气的燃烧热为241.8 kJ· mol—1
B.已知C(石墨,s)=C(金刚石,s);△H>0
则金刚石比石墨稳定
C.已知NaOH(ag)+HCl(aq)=NaCl(aq)+H2O(l);△H=-57.4 kJ· mol—1
则含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量
D.己知2C(s)+2O2(g)=2CO2(g));△H1 2C(s)+O2(g)=2CO(g);△H2,
则△H1>△H2
2、某化工厂的工业废水中含H2SO4的质量分数为1%,采用边排放边中和的方法将它处理,使之基本呈中性,处理方法如图所示:
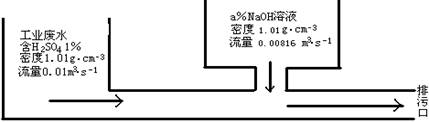
若处理后的废水pH=7,则所用NaOH溶液中溶质的质量分数为
A.0.5% B.1% C.2% D.4%
3.2008年北京奥运会“祥云”奥运火炬所用环保型燃料丙烷(C3H8),悉尼奥运会所用火炬燃料为65%丁烷(C4H10)和35%丙烷,已知丙烷的燃烧热为:2221.5 kJ/mol;正丁烷的燃烧热为:2878 kJ/mol;异丁烷的燃烧热为:2869.6 kJ/mol下列有关说法正确的是
A.奥运火炬燃烧时主要是将化学能转变为热能
B.相同质量的正丁烷和丙烷分别完全燃烧,前者需要的氧气多产生的热量也多
C.正丁烷比异丁烷稳定
D.丙烷燃烧的热化学方程式可表示为:
C3H8+5O2=3CO2+4H2O;ΔH=-2221.5 kJ/mol
4.已知氧化还原反应:
2Cu(IO3)2+24KI+12H2SO4=2CuI↓+13I2+12K2SO4+12H2O
其中1mol氧化剂在反应中得到的电子为
A.10mol B.11mol C.12mol D.13mol
5.下列离子方程式中,正确的是
A.氧化钠投入水中:O2- +H2O- == 2OH-
B.在CuSO4溶液中加入过量Ba(OH)2溶液:Ba2+ + SO42- == BaSO4↓
C.氯气通入水中:Cl2 + H2O== Cl- + ClO- + 2H+
D.在AlCl3溶液中加入过量氨水:Al3+ + 3NH3·H2O == Al(OH)3↓ + 3NH4+
6、某溶液中含有NO![]() 、SiO
、SiO![]() 、Al O
、Al O![]() 、S2-等四种阴离子,若向其中加入过量的盐酸溶液,微热并搅拌,再加入过量的NaOH溶液,则溶液中大量减少的阴离子是
、S2-等四种阴离子,若向其中加入过量的盐酸溶液,微热并搅拌,再加入过量的NaOH溶液,则溶液中大量减少的阴离子是
A.NO![]() AlO
AlO![]() B.SiO
B.SiO![]() S2- C. S2- D.NO
S2- C. S2- D.NO![]() S2-
S2-
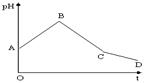 7、将等物质的量浓度的CuSO4和NaCl等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如右,则下列说法正确的是:
7、将等物质的量浓度的CuSO4和NaCl等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如右,则下列说法正确的是:
A.阳极产物一定是Cl2,阴极产物一定是Cu
B.BC段表示在阴极上是H+放电产生了H2
C.整个过程中阳极先产生Cl2,后产生O2
D.CD段表示阳极上OH-放电破坏了水的电离平衡,
产生了 H+
8. 对于可逆反应m
A(g) + n B(g) ![]() pC(g)
+ g D(g),若其它条件都不变,只是在反应前加入合适的催化剂,则两种v~t图像如下图。
pC(g)
+ g D(g),若其它条件都不变,只是在反应前加入合适的催化剂,则两种v~t图像如下图。
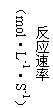  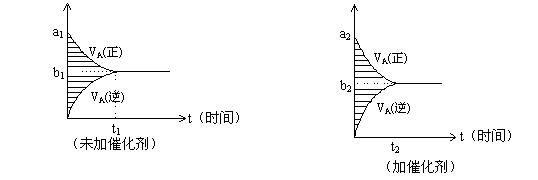 |
①a1 = a2 ②a1 < a2 ③b1 = b2 ④b1 < b2 ⑤t1>t2 ⑥t1= t2
⑦两图中阴影部分面积相等 ⑧右图阴影部分面积更大
以上正确的为【 】
A.②④⑤⑦ B.②④⑥⑧ C.②③⑤⑦ D.②③⑥⑧
9、相同温度下,将足量的AgCl分别放入下列溶液中:
① 40mL 0.02mol/L BaCl2溶液 ② 40mL 0.03mol/L 盐酸
③ 10mL 蒸馏水 ④ 50mL0.05mol/L AgNO3溶液
则AgCl的溶解度大小顺序为【 】
A.① = ② = ③ = ④ B. ③ > ② > ① > ④
C.④ > ② > ① > ③ D. ③ > ① > ② > ④
10、用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得的溶液中加入0.1mol Cu(OH)2后恰好恢复到电解前的浓度和PH。则电解过程中转移的电子数为( )
A、0.1mol B、0.2mol C、0.3mol D、0.4mol
二、选择题(本题包括9小题,每小题3分,共27分。每小题有1—2个选项符合题意)选修3《物质结构与性质》
11.反应A+B→C的反应速率方程式为:v=k·c(A)·c(B),v为反应速率,k为速率常数。当c(A)=c(B)=1 mol/L时,反应速率在数值上等于速率常数。下列说法正确的是
A.c(A)增大时,v也增大 B.c(B)增大时,k也增大
C.升高温度时,k值不变 D.升高温度时,v值增大
12、超酸是指酸性比普通无机酸强106∽1010倍的酸,魔酸(HSO3F-SbF5)是已知超酸中最强的,许多物质如H2SO4在魔酸中可获得质子。则硫酸溶于魔酸中所表现出的这种性质是
A.碱性 B.酸性 C.还原性 D.氧化性
![]() 13、欲使CH3COONa稀溶液中的值增大,可采取的措施是
13、欲使CH3COONa稀溶液中的值增大,可采取的措施是
A.升温 B.加水稀释 C.加少量的KOH固体 D.加少量固体Na2CO3
14.已知I-、Fe2+、SO2、Cl-和H2O2均具有还原性,它们在酸性溶液中还原性的强弱顺序是Cl-< Fe2+<H2O2< I-<SO2 ,则下列反应中不能发生的是
A、2Fe3++SO2+2H2O 2Fe2++SO42-+4H+
B、SO2+I2+2H2O H2SO4+2HI
C、H2O2+H2SO4 SO2↑+O2↑+2H2O
D、2Fe2++I 2 2Fe3++2 I-
15.
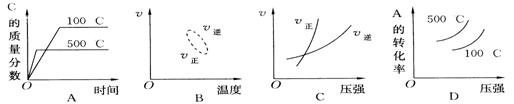 |
用来表示可逆反应2A(g)+B(g)
16、锑(Sb)在自然界一般以硫化物的形式存在,我国锑的蕴藏量占世界第一。从硫化物中提取单质锑一般是先在高温下将硫化物转化为氧化物,再用碳还原:
2Sb2S3+3O2+6Fe=Sb4O6+6FeS ……………………①
Sb4O6+6C=4Sb+6CO ………………………………②
关于反应①、反应②的说法正确的是
A. 反应①②中的氧化剂分别是Sb2S3、Sb4O6
B.反应①中每生成3 mol FeS时,共转移6 mol电子
C.反应②说明高温下Sb的还原性比C强
D.每生成4 mol Sb时,反应①与反应②中还原剂的物质的量之比为4︰3
17、固体氧化物燃料电池(SOFC)以固体氧化物作为电解质。其工作原理如右图所示:
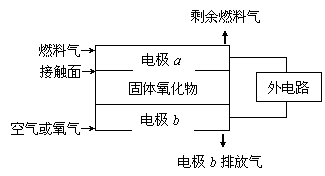 |
下列关于固体燃料电池的有关说法正确的是
A.电极b为电池负极,电极反应式为O2+4e-=4O2-
B.固体氧化物的作用是让电子在电池内通过
C.若H2作为燃料气,则接触面上发生的反应为H2+2OH--4e-=2H++H2O
D.若C2H4作为燃料气,则接触面上发生的反应为C2H4+6O2--12e-=2CO2+2H2O
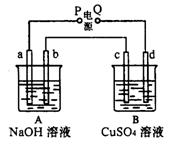 18、按右图装置实验,A、B两烧杯分别盛放200g10%NaOH和足量CuSO4溶液。通电一 段时间后,c极上有Cu析出;又测得A杯中溶液的质量减少4.5 g (不考虑水的蒸发)。 则下列叙述中正确的是
18、按右图装置实验,A、B两烧杯分别盛放200g10%NaOH和足量CuSO4溶液。通电一 段时间后,c极上有Cu析出;又测得A杯中溶液的质量减少4.5 g (不考虑水的蒸发)。 则下列叙述中正确的是
A.电源P极为负极
B.标准状况下,b极产生气体的体积为5.6 L
C.c极上析出固体的质量为16 g
D.a极上所发生的电极反应式为
40H--4e-= 2H2O+O2↑
19.某体积可变的密闭容器中盛有适量的A和B的混合气体,在一定条件下发生反应:A+3B![]() 2C,若维持温度和压强不变,当达到平衡时,容器的体积为VL,其中C气体的体积占10%,下列推断正确的是
2C,若维持温度和压强不变,当达到平衡时,容器的体积为VL,其中C气体的体积占10%,下列推断正确的是
A.原混合气体的体积分数为1.2VL B.原混合气体的体积为1.1VL
C.反应达到平衡时,气体A消耗0.05VL D.反应达到平衡时,气体B消耗掉0.05VL
|
三、
20.(12分)在过氧化氢中加入乙醚后,再加入数滴K2Cr2O7的硫酸溶液,轻轻振荡后静置,乙醚层呈现蓝色,这是由于生成的过氧化铬(CrO5)溶于乙醚的缘故。CrO5 的结构式见下式。
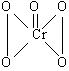
(1)在CrO5中氧元素的化合价为 ;
(2)这一反应的离子方程式是 ;
(3)这个反应 (填“是”或“不是”)氧化还原反应,其理由
是 ;
(4)如果将9.60×10-4molAO4-离子在溶液中还原成较低价态,需用0.100 mol•L-1H2O2溶液24.0mL,试通过计算确定A元素的最终价态 。
计算依据是
。
四、
21.(10分).某无色透明溶液可能含有下列离子:K+、Al3+、Fe3+、Ba2+、NO3-、SO42-、HCO3-、Cl-等,取该溶液进行如下实验:
①用蓝色石蕊试纸检测该溶液,试纸显红色;
②取溶液少许,加入铜片和稀硫酸共热,产生无色气体,该气体遇到空气立即变为红棕色;
③取溶液少许,加入氨水有白色沉淀生成,继续加入过量氨水,沉淀不消失;
④取溶液少许,滴入氯化钡溶液产生白色沉淀;
⑤取实验④后的澄清溶液,滴入硝酸银溶液产生白色沉淀,再加入过量的稀硝酸,沉淀不消失。请回答下列问题:
⑴在实验①中,下图所示的操作中正确的是_______________(填代号)

⑵根据上述实验判断原溶液中肯定存在的离子是___________________,
肯定不存在的离子是___________________
⑶写出与②③④三个实验有关的离子方程式:
②: ___ ___________ ___________ ________ ;
③: ___ ___________ _______ ____________ ;
22.(8分)已知某无色溶液中只含有包括Na+、CH3COO-在内的四种离子,请回答下列问题:
(1)若该溶液中只含有一种溶质,则该溶液显 性。相关的离子方程式为 。
(2)若该溶液呈酸性,则溶液中的溶质为 。
(3)若溶液中含有两种溶质,且溶液呈碱性,则该溶液中不可能出现的离子浓度大小关系是 。(选填编号字母)
A.c(Na+)>c(CH3COO-) B.c(CH3COO-)> c(Na+)
C.c(OH-)> c(Na+) D.c(Na+)> c(OH-)
E.c(OH-)>c(CH3COO-) F. c(CH3COO-)> c(OH-)
五、
23.(12分) 铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式 。
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、负极,并写出电极反应式。
正极反应式 ,负极反应式 。
(3)腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10 mol·L-1,请参照下表给出的数据和药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤:
。
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ Fe2+ Cu2+ | 1.9 7.0 4.7 | 3.2 9.0 6.7 |
| 提供的药品:Cl2 浓H2SO4 NaOH溶液 CuO Cu | ||
(4)某科研人员发现劣质不锈钢在酸中腐蚀缓慢,但在某些盐溶液中腐蚀现象明显。请从上表提供的药品中选择两种(水可任选),设计最佳实验,验证劣质不锈钢易被腐蚀。
有关反应的化学方程式 、
劣质不锈钢腐蚀的实验现象: 。
|
![]() CO(g)+H2O(g)
CO2(g)+H2(g),其化学平衡常数K和温度k的关系如
CO(g)+H2O(g)
CO2(g)+H2(g),其化学平衡常数K和温度k的关系如
下表:
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K= 。该反应为 反应(选填“吸热”、“放热”)。
(2)能判断该反应是否达到化学平衡状态的依据是 。
(a)容器中压强不变 (b)混合气体中c(CO)不变
(c)![]() 逆(H2)=
逆(H2)=![]() 正(H2O) (d)c(CO2)=c(CO)
正(H2O) (d)c(CO2)=c(CO)
(3)830℃时,容器中的反应已达到平衡。在其他条件不变的情况下,缩小容器的体积。平衡 移(选填“向正反应方向”、“向逆反应方向”、“不”)
(4)若830℃时,向容器中充入1mol CO、5mol H2O,反应达到平衡后,CO的转化率为
。
五、计算
25.(9分)
(1) 氢氧化铁悬浊液中存在如下平衡:Fe(OH)3 (s)![]() Fe3+(aq)+3OH-(aq),常温下其Ksp=c(Fe3+) · c3(OH-)=4×10-38 。
Fe3+(aq)+3OH-(aq),常温下其Ksp=c(Fe3+) · c3(OH-)=4×10-38 。
①某氯化铁溶液里c(Fe3+)=0.04mol/L,如要生成Fe(OH)3沉淀,应调整溶液pH使之大于 。
②要使0.004mol/L氯化铁溶液中Fe3+沉淀较为完全(使Fe3+浓度降至原来的千分之一),则应向溶液里加入氢氧化钠溶液使溶液pH为 。
⑵ 已知AgCl的Ksp=1.80×10-10, Ag2CrO4的Ksp=1.1×10-12。在0.1 mol/L KCl和0.1 mol/L K2CrO4混合溶液中,逐滴加入AgNO3溶液,则AgCl和Ag2CrO4两种电解质 最先产生沉淀.通过计算说明。
化 学 试 卷 答 案
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | C | B | A | B | D | D | C | A | B | D |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | AD | A | C | CD | AC | B | D | AC | BC |
20. (1)一个氧为-2价,4个氧为-1价。
(2) Cr2O72- + 4 H2O2 +2H+ = 2CrO5 +5H2O
(3)不是;化学反应前后元素的化合价不变。
(4)2,化合价升降总数相等或电子得失总数相等
21.(1)BD
(2)一定有NO3—、Al3+、SO42—;一定无Fe3+、Ba2+、HCO3—
(3)②3Cu+8H++2NO3—=3Cu2++2NO↑+4H2O
③Al3++3NH3·H2O=Al(OH)3↓+NH4+
![]() 22、(1)碱性(2分) CH3COO-+H2O CH3COOH+OH-(2分)
22、(1)碱性(2分) CH3COO-+H2O CH3COOH+OH-(2分)
(2)CH3COOH、CH3COONa(4分)
(3)B、C(4分)
23.(1)2Fe3++Cu=2Fe2++Cu2+
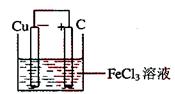 (2)装置图
(2)装置图
正极反应:Fe3++e-=Fe2+(或2Fe3++2e-=2Fe2+)
负极反应:Cu=Cu2++2e-(或Cu-2e-=Cu2+)
(3)①通入足量氯气将Fe2+氧化成Fe3+;②加入CuO调节溶液的pH至3.2~4.7;
③过滤[除去Fe(OH)3]
(4)CuO+H2SO4=CuSO4+H2O
CuSO4+Fe=FeSO4+Cu,不锈钢表面有紫红色物质生成。
24.(13分)(1)![]() (2分) 放热(2分) (2)b c(3分)
(2分) 放热(2分) (2)b c(3分)
(3)不(3分) (4)83%(3分)
25.五、计算
(1) pH>2 pH=3.3
(2)解:设混合液中产生AgCl沉淀时,所需c(Ag+)为x mol/L,
而产生Ag2CrO4沉淀时,所需c(Ag+)为y mol/L;
根据溶度积常数表达式,则……
因为x《y ,就是说产生AgCl沉淀时所需c(Ag+)远小于产生 AgCrO4沉淀时所需c(Ag+)。所以,在混合溶液中,逐滴加入AgNO3溶液时,最先析出AgCl白色沉淀;只有溶液中c(Ag+)达到3.3×10-6mol/L以上时,才能析出Ag2CrO4砖红色沉淀。
化学答题卡
第Ⅰ卷(选择题,共57分)
一、二选择题(1—10题为单项选择题;11—19题为1-2个正确答案的选择题)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | ||||||||||
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 |
第Ⅱ卷(非选择题 共63分)
三、四、五、六、题(共包括20-25题)
|

|
