高三化学第一次大练习试题
可能用到的相对原子质量:H:1 Mg:24 C:12 O:16 S:32 Cl:35.5 N:14 Na:23 Al:27 K:39 Fe:56 Ca:40 Ag:108
一、选择题(每小题3分,共54分,每小题只有一个选项符合题意)
1.下列关于生产生活中的化学问题的叙述不正确的是
A.为了保护臭氧层,禁止人们使用或少用氟氯代烃
B.在含硫的燃料中加入适量的生石灰,可减少污染大气的二氧化硫的生成
C.食用植物油的主要成分是高级不饱和脂肪酸的甘油酯,是人体内不可缺少的重要营养物质
D.市场销售的洗涤灵的主要成分是对十二烷基苯磺酸钠,它能洗去餐具上的油污,发生的主要是化学变化
2.2004年,美国科学家通过“勇气”号太空车探测研究金星大气成分,发现金星大气中有一种称之为硫化羰(COS)的分子,其结构与CO2类似,但能在氧气中完全燃烧,硫化羰是一种与生命密切相关的物质,下列有关COS的推测肯 定不正确的是
A.COS分子是含有极性键的极性分子
B.COS分子中所有原子都满足8电子稳定结构
C.1 mol硫化羰在氧气中完全燃烧时转移6mol电子
D.像二氧化碳一样COS可作灭火剂
3.NA表示阿伏加德罗常数,以下说法正确的是
A.28 g乙烯分子里含有共用电子对数目为6NA
B.在熔融状态下,1 mol NaHS04完全电离出的阳离子数目为2NA
C.7.8 g Na202含有的阴离子数目为0.2NA
D.22.4l氖气所含的原子数为2 NA
4.下列说法一定正确的是
A.位于短周期的x元素的阳离子与Y元素的阴离子具有相同的电子层结构,则两元素的最高化合价X<Y
B.PH=2盐酸和醋酸溶液各10ml,分别加水稀释到1L,所得溶液的PH 较小的是醋酸
C.二氧化硅晶体中,每个硅原子与2个氧原子形成共价键
D.在晶体中只要有阳离子就一定有阴离子
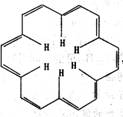 5.早在40年前,科学大师Heilbronner经过理论研究预测,应当有可能合成“莫比乌斯”形状的芳香族(大环)轮烯分子,这一预测在2003年被德国化学家合成证实。[18]-轮烯是一种大环轮烯,其结构简式如下:
5.早在40年前,科学大师Heilbronner经过理论研究预测,应当有可能合成“莫比乌斯”形状的芳香族(大环)轮烯分子,这一预测在2003年被德国化学家合成证实。[18]-轮烯是一种大环轮烯,其结构简式如下:
有关它的说法正确的是
A.[18]- 轮烯分子中所有原子不可能处于同一平面
B.1 mol[18]- 轮烯最多可与9 mol氢气发生加成反应生成环烷烃
C.[18]- 轮烯的分子式为:C18H12
D.[18]- 轮烯与乙烯互为同系物.
6.某氯原子的质量是a g ,12C原子的质量是bg ,用NA表示阿伏加德罗常
数,下列说法中正确的是
A.氯元素的相对原子质量为 12b/a
B.m g该氯原子的物质的量一定是m/(a NA) mol
C.该氯元素的摩尔质量是aNA
D.n g该氯原子所含的电子数为17n/b
7.下列反应的离子方程式书写正确的是
A.明矾溶液中加入过量的氨水 Al3++4OH-=AlO2-+2H2O
B.次氯酸钙溶液中通入过量二氧化碳:ClO-+H2O+CO2=HClO+HCO3-
C.碳酸氢镁溶液中加入过量的氢氧化钠溶液
Ca2++2OH-+Mg2+ + 2HCO3-=MgCO3↓ +CaCO3↓+2H2O
D.澄清的石灰水中加入少量的NaHCO3溶液:
Ca2++2OH-+2HCO3-=CaCO3↓+ 2H2O + CO32-
8. 室温时,将x m L pH=a的稀NaOH溶液与y m L pH=b的稀盐酸充分反应,下列关于反应后溶液p H的判断,正确的是
A.若x=y,且a+b=14,则pH>7 B.若10x=y,且a+b=13,则pH =7
C.若ax=by,且a+b=13,则pH =7 D.若x=10y,且a+b=14,则pH>7
9.右上图中a、b、c、d、e为周期表前4周期的一部分元素,下列叙述正确的是
 A.b元素除0价外,只有一种化合价
A.b元素除0价外,只有一种化合价
B.五种元素中,c元素的性质最稳定
C.b、d气态氢化物溶于水,溶液的酸性:b > d
D.e元素最高价氧化物的水化物和不同量的氢氧化钠溶液反应,可能生成三种盐
10.下列分子中,所有原子都满足最外层为8电子结构的是
(A)BF3 (B)PCl5 (C)HCl (D)CF2Cl2
11. 0.02 mol · L – 1的HCN溶液与0.02 mol · L – 1的NaCN溶液等体积混合,测得溶液中c (CN – ) < c (Na +),则下列关系中不正确的是
A.c (Na+) > c (CN – ) > c (OH – ) > c (H+)
B.c (HCN) + c (CN – ) = 0.02 mol · L – 1
C.c (CN – ) 〈 c (HCN)
D.c (Na+) + c (H+) = c (CN – ) + c (OH – )
12. 已知:①C(s)
+![]() O2(g)
O2(g) CO(g);△H = – 110.5 kJ · mol
– 1
②C(s) + O2(g) CO2(g);△H = – 393.51 kJ · mol – 1
则反应:C(s) + CO2(g) 2CO(g)的△H为
A.– 283.01 kJ · mol – 1 B.+ 172.51 kJ · mol – 1
C.+ 283.01 kJ · mol – 1 D.+ 504.00 kJ · mol – 1
13. 向100 mL NaOH溶液中通人标准状况下的1.12L CO2后,将溶液小心蒸干得到不含结晶水的固体5.08 g,则下列说法中正确的是
A.原NaOH溶液的浓度是1.00 mol/L,所得固体是Na2CO3
B.原NaOH溶液的浓度是O.50 mol/L,所得固体是Na2CO3,和NaHC03的混合物
C.原NaOH溶液的浓度是1.00 mol/L,所得固体是NaOH和Na2CO3的混合物
D.原NaOH溶液的浓度是O.90 mol/L,所得固体是Na2CO3和NaHC03的混合物
14.下列各组离子中,在碱性溶液能大量共存,且在加入盐酸的过程中会产生气体和沉淀的是
A Na+ 、 NO3- 、AlO- 、SO42- B Na+ 、NO3- 、SiO32- 、K+
C K+ 、Cl- 、AlO2- 、CO32- D Na+ 、Cl- 、HCO3- 、Ca2+
15.燃料电池是使气体燃料氧化直接产生电流的装置,这是本世纪最具挑战性的课题之一。最近有人制造了一种燃料电池,一个电极通入空气,另一电极通人丁烷,电池的电解质是掺杂了Y203(三氧化二钇)的ZrO2(二氧化锆)晶体,它在高温下能传导O2-.下列说法错误的是
A.该燃料电池的正极电极反应式为 : 13 O2 + 52e-= 26 02-
B. 该燃料电池负极反应式为: 2 C4 H10 + 26 02- - 52e-= 8C02 + 10H20
C.该燃料电池的正极电极反应式为 2H2O+ O2+4e-= 4OH_
D.该燃料电池工作时,固体电解质中的O2-向负极移动
16.高铁酸钾(K2Fe04)是一种新型、高效、多功能水处理剂,是比Cl2、O3,、 C102.、KMn04氧化性更强,无二次污染的绿色水处理剂。工业上是先制得高铁酸钠,然后在低温下,在高铁酸钠溶液中加入KOH至饱和就可析出高铁酸钾(K2Fe04)。湿法制备的主要反应方程式为:2Fe(OH)3 +3C10一+ 40H_ = 2FeO42-+ 3Cl_ + 5H20,干法制备的主要反应方程式为:2FeS04 + 6Na202 = 2Na2Fe04 + 2Na20 + 2Na2S04+02下列有关说法不正确的是
A.高铁酸钾中铁显+6价
B.湿法中每生成l mol Na2FeO4,转移3 mol电子
C.干法中每6 mol Na202参加反应时电子转移的数目为12 mol
D.K2Fe04处理水时,不仅能消毒杀菌,还能除去水体中的H2S、NH3等,生成的Fe(OH)3 ,还能吸附水中的悬浮杂质
17.一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2,发生下列反应:2SO2(g)+O2(g)![]() 2SO3(g)达到平衡后改变下述条件,平衡时SO3气体的质量百分数不改变的是
2SO3(g)达到平衡后改变下述条件,平衡时SO3气体的质量百分数不改变的是
A. 保持温度和容器体积不变,充入1molSO3(g)
B. 保持温度和容器内压强不变,充入1molSO3(g)
C. 保持温度和容器内压强不变,充入1molO2(g)
D. 保持温度和容器内压强不变,充入1molAr(g)
18、将含有杂质的4.0g NaOH配成1000mL溶液,取20mL置于锥形瓶中,用0.1mol/L的盐酸滴定。用甲基橙作指示剂,滴定达终点时,耗酸19.0mL,则NaOH中含有的杂质不可能为( )
A、NaCl B、Na2CO3 C、NaHCO3 D、Ca(OH)2
二、填空题及推断题 ( 18分)
19.①t℃时,测得纯水中c(OH-)=2×10-7mol·L-1, 则t (填“>”、“<”或“=”) 25℃,该温度下,水的离子积常数为 ;
②25℃时,某K2SO4溶液中c(SO42-)=1×10-4mol·L-1,取该溶液1mL加水稀释至100mL,则稀释后的溶液中c(K+): c(H+)= ;
20.若1体积硫酸恰好与10体积PH=11的氢氧化钠溶液完全反应,则两者物质的量浓度之比应为 。
21.0.1mol/l下列溶液 ①NH4Cl ② NH4HCO3 ③NH4HSO4 ④(NH4)2CO3 ⑤(NH4)2Fe(SO4)2 ⑥ (NH4)2SO4 NH4+的物质的量的浓度由大到小的排列顺序 。
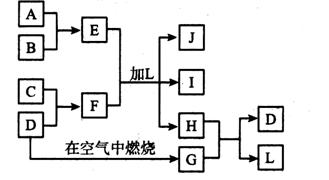
22.如图所示,图每一方框中的字母代表一种反应物或生成物,产物J是含A元素的白色胶状沉淀,I为NaCl溶液,D是淡黄色固体单质。试填写下列空白:
(1)L的化学式为 F的化学式为
(2)写出A+B→E反应的化学方程式
(3) H和G之间反应的化学方程式
三、实验题 (17分)
23.(12分)某化学实验小组欲制取氧化铜并证明氧化铜能加快氯酸钾的分解,进行了如下实验:
(I)制取氧化铜
(1)称取2gCuSO4 5H2O在 (填仪器)中研细后倒入烧杯,加10mL蒸馏水溶解。
(2)向上述CuSO4溶液中逐滴加入NaOH溶液,立即产生蓝色沉淀,继续滴加,直到不再产生沉淀。然后将所得混合物转移到 (填仪器)中,加热至沉淀全部变为黑色,停止加热。
(3)将步骤(2)所得混合物过滤、洗涤,晾干后研细备用。
回答下列问题: ‘
①完成上面的空白。
②上述实验步骤中需要使用玻璃棒的是 (填实验序号)。
③步骤(3)中洗涤沉淀的操作是
.
(Ⅱ)该小组同学从资料中得知氧化铜也能催化分解氯酸钾。他们为了比较氧化铜和氧化锰的催化效果,设计用右图装置进行实验,实验时均以生成25mL气体为准。其它可能影响实验的因素均已控制,相关数据见下表:
| 实验序号 | KCl03质量 | 其它物质质量 | 待测数据 |
| (4) | I,2g | 无其他物质 | |
| (5) | 1.2g | CuO 0.5g | |
| (6) | 1.2g | Mn02 O.5g |
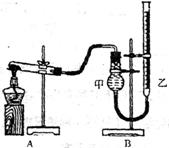
回答下列问题.
④上述实验中的待测数据指
⑤若(5)(6)中待测数据分别为10和7(单位相同),则 (填写化学式)催化效果好。
⑥为探究CuO在实验(5)中是否起催化作用,需补做如下实验(无需写出具体操作):
a ,b验证CuO的化学性质没有改变。
四、有机题(10分)
24.(16分)已知碳碳双键的碳原子上连有羟基的结构是不稳定的结构。A是一种直链一溴代物,1mol A与2mol H2反应生成1mol G,F是环状化合物,环上有5个原子,其化学式为C4H6O2。请根据下面的反应路线回答问题:
![]() 、
、![]() NaOH溶液、
NaOH溶液、![]()
![]() H2、Ni、
H2、Ni、![]() 浓H2SO4、
浓H2SO4、![]()
![]() F
F
① ② ③ ④ ⑤
(1)化合物F的结构简式是____________,化合物C的结构简式是____________。
(2)化合物A含有的官能团是________________________。
(3)G的结构简式是____________________________________。
(4)写出D在一定条件下发生加聚反应的化学方程式是________________________
________________________________________________。
五、计算题(9分)
25.下图为某市售盐酸试剂瓶标签上的部分数据。
(1)配制200mL0.100 m01.L-1盐酸需该浓盐酸多少毫升?(保留两位
小数)
(2)取等物质的量浓度NaOH溶液两份A和B各10 mL,分别向其
通入不等量的C02,再继续向两溶液中逐滴加入上述配好的0.100
m01.L-1的盐酸,标准状况下产生C02气体体积与所加的盐酸关系如
图所示,,求:
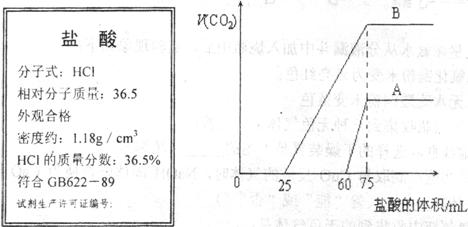
① 原NaOH溶液的物质的量浓度?
② B溶液中通入C02后所含溶质的物质的量之比?
高三化学第一次大练习答题纸
一、选择题(本题共18小题,每题3分,共54分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| D | D | D | B | B | D | B | D | D |
| 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| D | C | B | D | C | C | C | B | D |
二、填空题及推断题 ( 18分)
19. 4×10-14
20. 20:1.
21. ⑤⑥④③①② .
22. (1)L的化学式为 H2O F的化学式为 Na2S
(2)写出A+B→E反应的化学方程式 2Al + 3Cl2 =2AlCl3
(3) H和G之间反应的化学方程式2H2S+SO2 = 3S+H2O
二、实验题(17分)
23. (I) ①(1) 坩埚 (2) 蒸发皿 ;
② ① ② ;
(Ⅱ) ④ 时间 ;
⑤ 乙 .
⑥ 反应前后的质量不变 .
四、有机题(10分)略
五、计算题(9分)
25.1.69; 0.013; 1∶1