高三化学第一次联考试题
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Mg 24 Al 27 S 32
Fe 56 Cu 64
第I卷(共42分)
一、选择题(本题包括14小题,每小题3分,共42分。每小题只一个选项符合题意)
1.我国科学家在世界上第一次为一种名为“钴酞菁”的分子(直径为1.3×10-9m)恢复了磁性。“钴酞菁”分子结构和性质与人体内的血红素及植物内的叶绿素非常相似。下列关于“钴酞菁”分子的说法中正确的是( )
A.在水中所形成的分散系属悬浊液
B.“钴酞菁”分子既能透过滤纸,也能透过半透膜
C.分子直径比Na+小
D.在水中形成的分散系能产生丁达尔效应
2.某氧化还原反应中有反应物和生成物共六种:NO、FeSO4、Fe(NO3)3、H2O、HNO3和Fe2(SO4)3。其中HNO3为反应物,则该氧化还原反应中的还原剂为( )
A. NO B. FeSO4 C. Fe(NO3)3 D. Fe2(SO4)3
3.不断升高温度,可实现“雪花→水→水蒸气→氧气和氢气”的变化。在变化的各阶段被破坏的粒子间的主要作用力依次是( )
A.氢键;分子间作用力;非极性键 B.氢键;氢键;极性键
C.氢键;极性键;极性键 D.分子间作用力;氢键;非极性键
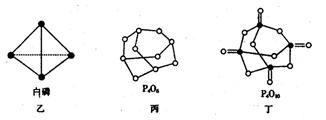
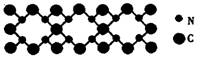 4.氮化碳结构如右图,其中β-氮化碳硬度超过金刚石晶体,成为首屈一指的超硬新材料。下列有关氮化碳的说法不正确的是( )
4.氮化碳结构如右图,其中β-氮化碳硬度超过金刚石晶体,成为首屈一指的超硬新材料。下列有关氮化碳的说法不正确的是( )
A.氮化碳属于原子晶体
B.该晶体中的碳、氮原子核外都满足8电子稳定结构
C.氮化碳的化学式为C3N4
D.该晶体熔化时,共价键不受破坏
5.下列各组离子在相应的条件下一定能大量共存的是( )
A.在碱性溶液中:CO32-、K+、Cl-、Ca2+
B.与铝粉反应放出氢气的无色溶液中:NO3-、Mg2+、Na+、SO42-
 C.在c(H+)/c(OH-)=1×1013的溶液中:NH4+、Ca2+、Cl-、K+
C.在c(H+)/c(OH-)=1×1013的溶液中:NH4+、Ca2+、Cl-、K+
D.在中性溶液中:Fe3+、I-、NO3-、Al3+
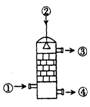
6.在硫酸工业生产中,SO3的吸收过程是在吸收塔(如图)中进行的,吸收塔里还装入了大量瓷环。下列有关SO3的说法中不正确的是( )
A.从①处通入SO3,整个吸收操作采取逆流的形式
B.从②处喷下98.3%的硫酸,瓷环的作用是增大接触面积
C.从③处导出的气体只含有少量SO2,可直接排入大气
D.从④处流出的是可供稀释用的硫酸
7.下列是有关反应:N2H5++2H2O2==N2+4H2O+H+的叙述:①N2H5+被氧化;②H2O2是还原剂;③N2是还的产物;④生成1mol N2时,反应中电子转移总数为4NA。其中正确的是( )
A.只有① B.①② C.①④ D.全部
8.下列有关反应热的说法中正确的是( )
A.一个化学反应是否能在常温下发生与该反反应的△H值的大小没有必然联系
B.中和热△H=-57.3kJ·mol-1,所以,1.00L 1.00mol·L-1H2SO4与稀的NaOH溶液恰好完全反应放出57.3kJ的热量
C.用等体积的0.50mol·L-1盐酸、0.55mol·L-1NaOH溶液进行中和热测定的实验,会使测得的值偏大
D.在101KPa时,1molCH4完全燃烧生成CO2和水蒸气放出的热量就是CH4的燃烧热
9.不久前,美国一个海军航空站安装了一台250kW的MCFC型燃料电池,该电池可同时供应电和水蒸气,其工作温度为600℃~700℃,所用燃料为H2,电解质为熔解的K2CO3,已知该电池的总反应为:2H2+O2===2H2O,负极反应为:H2+CO32――2e-==H2O+CO2,则下列推断中正确的是( )
A.正极反应为4OH-==O2+2H2O+4e- B.该电池的电极没有参加反应
C.电池供应1mol水蒸气,转移的电子数4mol D.O2从正极通入,发生氧化反应
10.在101kPa时,燃烧480t含FeS2质量分数为50%的黄铁矿生成固态Fe2O3和气态SO2,放出a×106kJ的热量,表示上述反应的热化学方程式正确的是( )
A.4FeS2(s)+11O2(g)==2Fe2O3(s)+8SO2(g);△H=-2a kJ·mol-1
B.FeS2(s)+![]() O2(g)==
O2(g)==![]() Fe2O3(s)+2SO2(g);△H=+0.5akJ·mol-1
Fe2O3(s)+2SO2(g);△H=+0.5akJ·mol-1
C.4FeS2(S)+11O2(g)==2Fe2O3(s)+8SO2(g);△H=+2akJ·mol-1
D.FeS2(s)+![]() O2(g)==
O2(g)==![]() Fe2O3(s)+2SO2(g);△H=-a kJ·mol-1
Fe2O3(s)+2SO2(g);△H=-a kJ·mol-1
11.下列离子方程式中不正确的是( )
A.向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全:
Ba2++2OH-+H++NH4++SO42-==BaSO4↓+H2O+NH3·H2O
B.碳酸氢钠溶液与硫酸氢钠反应:HCO3-+H+==CO2↑+H2O
C.向AlCl3溶液中滴加少量NaAlO2溶液:Al3++3AlO2-+6H2O==4Al(OH)3↓
D.漂白粉配制成的溶液中通入SO2: Ca2++2ClO-+SO2+H2O==CaSO3↓+2HClO
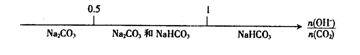
12.将某些化学知识用数轴表示,可以收到直观、简明、易记的效果。用数轴表示的下列知识正确的是( )
A.硫及其化合物的化合价与氧化还原反应的关系:

B.分散系的分类:
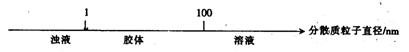
C.AlCl3溶液与NaOH溶液反应后铝元素的存在形式:
![]()
D.CO2与NaOH溶液反应后的产物
13.下列图像是NaCl、CsCl、干冰的晶体结构图或是从其中分割出来的部分结构图,试判断属于NaCl的晶体结构图像的是( )
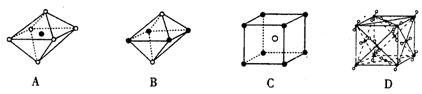
14.已知t℃时,盐M(不含结晶水,摩尔质量为126g·mol-1)的溶解度为S g。在一定量的M的水溶液中加入a g M后,恰好为t℃时的饱和溶液,饱和溶液的密度是ρg·ML-1,物质的量浓度是c mol·L-1,质量分数为ω。若用M·7H2O代替M,欲使原溶液在t℃时恰好饱和,则需加入b g M·7H2O,下列等式不正确的是( )
A.![]() B.
B.![]() C.
C.![]() D.b=2a
D.b=2a
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 答案 | |||||||
| 题号 | 8 | 9 | 10 | 11 | 12 | 13 | 14 |
| 答案 |
第II卷(共58分)
二、(本题包括2小题,共17分)
15、(6分)某工厂的废水只含硫酸镁和少量硫酸,课外活动小组以此作为课题,探讨如何从中回收纯净的硫酸镁固体。他们设计了两种不同的方案,请你参加讨论:
(1)方案一:选用镁粉作试剂。
1往废水中逐渐加入镁粉,当观察到 时,说明加入镁粉的量已经足够。
2接下来的操作方法依次是 和蒸发。
(2)方案二:选用氢氧化钠溶液作试剂。
1向废水中逐滴加入氢氧化钠溶液,当 时,停止滴入氢氧化钠溶液。
2为了得到纯净的硫酸镁溶液,接着应进行的实验操作是过滤、洗涤沉淀。其中洗涤沉淀的操作是_________________________
3往洗涤过的沉淀中加入硫酸到沉淀恰好完全溶解时停止滴加,蒸发溶剂得到硫酸镁固体。
(3)比较两个方案,假设实验中都没有损耗,那么,最后得到的硫酸镁固体的质量是否相同?
;原因是 。
16、(11分)下面是某化学学习小组的同学进行“草酸晶体受热分解的部分产物的验证”的研究性实验,已知草酸及草酸晶体的一些相关知识如下表:
| 名称 | 分子式 | 颜色、状态 | 溶解性 | 熔点(℃) | 密度(g·cm—3) |
| 草酸 | H2C2O4 | — | 易溶于水 | 189.5 | 1.900 |
| 草酸晶体 | H2C2O4·2H2O | 无色晶体 | — | 101.5 | 1.650 |
备注:草酸晶体失去结晶水后,175℃以上开始分解。且分解产物中的气体可能是CO、CO2或它们的混合物。请回答下列问题:
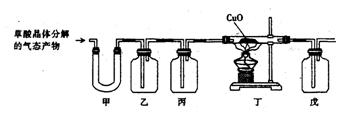
(1)写出草酸晶体加热分解的化学方程式:__________________________。
(2)填写表中空格:(请在澄清石灰水、氢氧化钠溶液、浓硫酸,无水硫酸铜之间选择试剂)
| 仪器 | 加入试剂 | 加入该试剂的目的 |
| 甲 | 验证分解产物有水生成 | |
| 乙 | 除去产物中的CO2 | |
| 丙 | 浓硫酸 | |
| 戊 | 验证CO氧化产物是CO2 |
(3)在实验过程中,该学生发现应对上述实验装置进行一些改进,才能保证实验的科学性和安全性(如下图)。请回答下列问题:
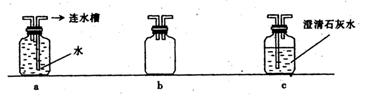
①为证明通往玻璃管的CO气体已除去CO2,可在乙和丙之间连接_______。(填装置序号)
②在装置丁和戊之间连接b装置,其作用是______________________。
③为了防止余气对实验室或环境造成污染,可在装置丁后连接________(填装置序号)。
(4)资料记载:草酸是二元弱酸,酸性比碳酸强,在受热分解过程中有少量升华;草酸钙和草酸氢钙均为白色不溶物。若在乙装置中盛澄清石灰水,发现澄清石灰水变浑浊,能否证明草酸晶体分解生成的气体中一定有CO2,请说明由_____________________________。
三、(本题包括2小题,共16分)
17.(8分)工业生产硫酸的原料气成分(体积分数)为SO2:7%,O2:11%,N2:82%.压强及温度对SO2转化率的影响如下:
|
转化率/% 温度/℃ | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
(1)工业上,二氧化硫催化氧化过程采用的是常压而不是高压,主要原因是______________________________________________。
(2)分析上表数据可知,二氧化硫的催化氧化是放热反应,理由是_________________________________________________。
(3)据测算,接触法制硫酸过程中,每生产1 t 98%的硫酸需消耗3.60×105kJ能量。若反应:2SO2(g)+O2(g) ![]() 2SO3(g);△H=-196.6kJ·mol-1放出的热量完全被利用,则每生产1 t 98%的硫酸可为外界提供_______kJ能量。(不考虑其他过程释放的能量)
2SO3(g);△H=-196.6kJ·mol-1放出的热量完全被利用,则每生产1 t 98%的硫酸可为外界提供_______kJ能量。(不考虑其他过程释放的能量)
(4)依据题给数据计算:在500℃、0.1MPa条件下,二氧化硫的催化氧化达到平衡时,各种气体的体积比V(O2):V(N2)=_________:82(结果保留两位有效数字)。
18.(8分)阅读下列两段材料,请回答下列问题:
材料一:2006年全国理综I第9题:把分别盛有熔融的氯化钾、氯化镁、氯化铝的三个电解槽串联,在一定条件下通电一段时是后,析出钾、镁、铝的物质的量之比为( )
A.1:2:3 B.3:2:1 C.6:3:1 D.6:3:2
材料二:已知下列表中有关物质的熔、沸点如下:
| 物质 | K2O | MgO | Al2O3 | KCl | MgCl2 | AlCl3 |
| 熔点(℃) | 881 | 2852 | 2015 | 711 | 714 | 190(259kPa) |
| 沸点(℃) | — | 3600 | 2980 | 1437 | 1412 | 181 |
(1)有人认为材料一中的题干与选项有矛盾,若选项正确,则结合材料二可推知氯化钾、氯化镁、氯化铝三种物质中有一种物质是不符合题意的,这种物质是_____________,其理由是_________________________。
(2)有人认为材料一中的题干正确,只要把一个正确的选项补加进去就是一道好题,你认为选项改加“(I)0:0:0”和“(II)6:3:0”哪个好?_____________(填写编号)
(3)也有人认为只要把氯化钾、氯化镁、氯化铝中的其中一种物质改为材料二表格中另一种物质也符合题意。写出电解这种物质的化学方程式:_________________________。
(4)设计可靠实验证明:MgCl2、AlCl3所属的晶体类型,其实验方法是________________
________________________________________________。
 四、(本题包括2小题,共17分)
四、(本题包括2小题,共17分)
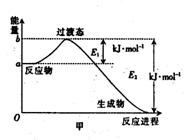
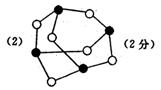
19.(8分)(1)20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成,而是在反应物到生成物的过程中经过一个高能量的过渡态。图甲 是白磷(P4)和O2反应生成P4O10过程中能量变化示意图,请写出白磷(P4)和O2反应生成P4O10的热化学方程式:_________________
_____________(△H用含E1和E2的代数式表示,其中E1、E2均大于0)。
(2)白磷(图乙)是正四面体构型的分子,当与氧气作用形成P4O6时,相当于每两个磷原子之间插入一个氧原子(如图丙)。当形成P4O10时,相当于在P4O6的分子中每个磷原子又以双键结合一个氧原子(如图丁)。
请在图丙的示意图中把磷原子用钢笔或铅笔把磷原子涂黑。
(3)进一步研究表明,化学反应的能量变化(△H)与反应物和生成物的键能有关。键能可以简单的理解为断开1mol化学键时所需吸收的能量。下表是部分化学键的键能数据:
| 化学键 | P—P | P—O | O=O | P=O |
| 键能/kJ·mol—1 | 198 | 360 | 498 | X |
已知白磷(P4)的燃烧热为2982 kJ·mol—1,白磷完全燃烧的产物结构如图丁所示,则上表中x=________________
(4)写出1molP4与O2反应生成固态P4O6的反应热△H=_____________。
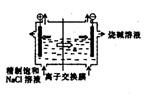 20.(9分)目前世界上比较先进的电解制碱技术是离子交换膜法,右图为离子交换膜法电解饱和食盐水的原理示意图。
20.(9分)目前世界上比较先进的电解制碱技术是离子交换膜法,右图为离子交换膜法电解饱和食盐水的原理示意图。
(1)透过交换膜的离子a是____________,电解饱和食盐水的离子方程式是______ ________。
 (2)现有离子交换膜A和B将电解槽分为I、II、Ⅲ三个区域,A为“阳离子交换膜”,它有一特殊的性质——允许阳离子通过,但阻止阴离子和气体通过,而B是“阴离子交换膜”,它允许阴离子通过,阻止阳离子和气体通过,电极均为惰性电极。若在I区投入Na2SO4溶液,通电电解,阴极的电极反应式为_____________________________________,在III区得到_________________________________。
(2)现有离子交换膜A和B将电解槽分为I、II、Ⅲ三个区域,A为“阳离子交换膜”,它有一特殊的性质——允许阳离子通过,但阻止阴离子和气体通过,而B是“阴离子交换膜”,它允许阴离子通过,阻止阳离子和气体通过,电极均为惰性电极。若在I区投入Na2SO4溶液,通电电解,阴极的电极反应式为_____________________________________,在III区得到_________________________________。
(3)在(2)的装置基础上撤去离子交换膜A、B,且把Na2SO4溶液换成CuSO4溶液,通电一段时间后,若要恢复到电解前溶液的pH和体积,需向所得溶液中加入0.1molCu(OH)2,则此电解过程中转移电子的物质的量为_________。
五、(本题包括1小题,共8分)
21.(8分)现有含NH3为1.7mg·L—1的废水300m3(密度为1g·cm—3),可采用如下两种方法进行处理。
(1)方法一:把甲醇加入含氨的废水中,在一种微生物作用下发生反应:
2O2 + NH3 === NO3- + H+ + H2O, 6NO3— + 6H+ + 5CH3OH→ 3N2↑ + 5CO3↑ + 13H2O.
若用此方法处理,假设每步的转化率为100%,需要甲醇多少克?
(2)方法二:对废水进行加热蒸发(假设NH3全部蒸发出来),所得NH3用一定量空气氧化(设空气中氧气的体积分数为20%,氮气的体积分数为80%),发生的主要反应有:
4NH3 + 5O2 ![]() 4NO + 6H2O , 4NO + 3O2
+ 2H2O === 4HNO3,
4NO + 6H2O , 4NO + 3O2
+ 2H2O === 4HNO3,
副反应有:4NH3 + 3O2 === 2N2 + 6H2O.产生的混合物的组成为:NO27mol, O218mol, N2225mol和少量的HNO3(高温下NO和O2不反应),求NH3转化为NO和HNO3的转化率各是多少。
高三第一次联考·化学试卷
参考答案
1.D 2.B 3.B 4.D 5.C 6.C 7.C 8.A
9.B 10.A 11.D 12.C 13.A 14.D
15.(1)①镁粉有剩余(或溶液中不再有气泡产生)(1分) ②过渡(1分)
(2)①不再产生沉淀(或沉淀不再增加)(1分)
②向漏斗的沉淀中注入蒸馏水,使水浸没沉淀物,等水流完后,重复操作数次(1分)
(3)不同(1分),方案一中加入镁粉,增加硫酸镁的质量(1分)、。
16.(1)H2C2O4·2H2O ![]() CO↑ + 3H2O(2分)
CO↑ + 3H2O(2分)
(2)
| 仪器 | 加入试剂 | 加入该试剂的目的 |
| 甲 | 无水硫酸铜(1分) | |
| 乙 | 氢氧化钠溶液(1分) | |
| 丙 | 除去CO气体中的水蒸气(1分) | |
| 戊 | 澄清石灰水(1分) |
(3)①c(1分) ②防止戊中的液体倒吸(1分) ③a(1分)
(4)不能(1分),在未洗气的情况下通入石灰水,可能因草酸蒸气与石灰水反应生成草酸钙沉淀,对实验有干扰(1分)
17.(1)常压时SO2的转化率已经很大,增大压强会增加动力成本和设备成本(2分)
(2)压强一定时,温度升高SO2的转化率下降(2分)
(3)6.23×102(2分)
(4)7.7(2分)
18.(1)氯化铝(1分);从表中数据可知,AlCl3易升化,熔、沸点低,属分子晶体,熔融时不能被电解(2分)
(2)I(1分)
(3)2Al2O3 ![]() 4Al + 3O2↑(2分)
4Al + 3O2↑(2分)
(4)将两种晶体加热到熔化状态,测定其导电性,能导电的离子晶体;不能导电的是分子晶体(2分)
19.(1)P4(s) + 5O2(g) === P4O10(s); △h=-(E2-E1)kJ·mol-1(2分)
(3)585(2分)
(4)发638kJ·mol-1(2分)
20.(1)Na+(1分);2Cl- + 2H2O ![]() Cl2↑ + H2↑ + 2OH-(2分)
Cl2↑ + H2↑ + 2OH-(2分)
(2)2H2O + 2e- === H2↑ + 2OH-或2H- + 2e- === H2↑(2分);H2SO4溶液(1分)
(3)0.4mol(3分)
21.(1)由反应:2O2 + NH3 === NO3- + H+ + H2O,
6NO3- + 6H+ + 5CH3OH → 3N2↑ + 5CO2↑ +13H2O
得关系式:6NH3——6NH3-——5CH3OH——3N2↑
废水中:n(NH3)=![]()
设每天处理废水需x kg甲醇
根据关系式 6NH3 —— 5CH3OH
6mol 5×32×10-3
![]() x
x
x=0.8kg(3分)
所以需甲醇0.8kg.
(2)NH3转化为NO的转化率为:![]() (2分)
(2分)
设所用空气为ymol,生成的HNO3为xmol,
根据N原子守恒有:27+225×2+x=0.8y×2+30 ①
根据得失电子守恒有:![]() ②
②
联合方程①、②,解得![]()
故NH3转化为HNO3的转化率为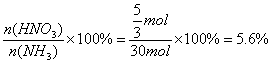 (3分)
(3分)
 压强/MPa
压强/MPa