高三化学复习班下期第一次月考
化 学 试 卷
考生注意:
1.本试卷满分100分,考试用时100分钟。
2.请务必用钢笔或圆珠笔将答案清楚地写在试卷相应的位置。
3.可能用到的相对原子质量:H 1,N 14,O 16,S 32,Cl 35.5,Fe 56,Cu 64。
一、选择题(本题包括16小题,每小题3分,共48分。每小题只有一个选项符合题意。请将选择题答案填入第5页答题栏内,否则不予计分。)
1.下列变化,一定都有新物质生成的是
A.炭化、风化、硝化、老化、钝化、油脂硬化
B.蒸馏、分馏、电解、电镀、电化学腐蚀、水解、分解
C.化合、混合、水合、氧化、酯化、皂化
D.空气液化制O2、脱水、渗析、盐析、凝聚
2.下列叙述正确的是
A.直径介于1 nm~100 nm之间的微粒称为胶体
B.电泳现象可证明胶体属电解质溶液
C.利用丁达尔效应可以区别溶液与胶体
D.胶体粒子很小,可以透过半透膜
3.下列说法正确的是
A.在101 kPa时,1 mol物质完全燃烧时所放出的热量,叫做该物质的燃烧热
B.酸和碱发生中和反应生成1 mol水,这时的反应热叫中和热
C.燃烧热和中和热都属于反应热
D.在稀溶液中,1 mol CH3COOH和1 mol NaOH完全中和时放出的热量为57.3 kJ
4.钛(Ti)被称为继铁、铝之后的第三金属,以TiO2制取Ti的主要反应有:
①TiO2+2C+2Cl2![]() TiCl4+2CO ②TiCl4+2Mg
TiCl4+2CO ②TiCl4+2Mg![]() 2MgCl2+Ti
2MgCl2+Ti
下列叙述正确的是
A.反应①是置换反应 B.反应②是复分解反应
C.反应①中TiO2是氧化剂 D.反应②中金属镁是还原剂
5.一定能在下列溶液中大量共存的离子组是
A.含有大量Al3+的溶液:Na+、NH4+、SO42-、Cl-
B.c(H+)=1×10-13mol·L-1的溶液:Na+、Ca2+、SO42-、CO32-
C.含有大量Fe3+的溶液:Na+、Mg2+、NO3-、SCN-
D.含有大量NO3-的溶液:H+、Fe2+、SO42-、Cl-
6.下列离子方程式中正确的是
A.CH3COOH溶液与NaOH溶液反应:H++OH-=H2O
B.Na2CO3溶液中通入少量CO2:CO32-+CO2+H2O=2HCO3-
C.H2SO4与Ba(OH)2溶液反应:Ba2++OH-+H+十SO42-=BaSO4↓+H2O
D.Ca(HCO3)2与过量Ca(OH)2溶液反应:
Ca2++HCO3-+2OH-=CaCO3↓+CO32-+2H2O
7.设NA代表阿伏加德罗常数,下列说法正确的是
A.5.6 g铁与足量盐酸反应转移的电子数为0.3NA
B.100 mL 2.0 mol/L的盐酸与醋酸溶液中氢离子均为0.2NA
C.标准状况下,22.4 L氦气与22.4 L氟气所含原子数均为2NA
D.20 g重水(D2O)中含有的电子数为10NA
8.下列条件下,两瓶气体所含原子数一定相等的是
A.同质量、不同密度的N2和CO B.同温度、同体积的H2和N2
C.同体积、同密度的C2H4和C2H6 D.同压强、同体积的N2O和CO2
9.将溶质质量分数为3p%的X溶液与p%的X溶液等体积混合,其混合溶液中溶质质量分数小于2p%,则X可能是下列物质的
A.H2SO4 B.NaCl C.C2H5OH D.NaOH
10.下图是几种盐的溶解度曲线下列说法正确是
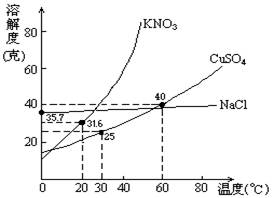
A.40 ℃时,将35 g食盐溶于100 g水中,降温至0 ℃时,可析出氯化钠晶体
B.20 ℃时,硝酸钾饱和溶液中溶质的质量分数为31.6%
C.60 ℃时,200 g水中溶解80 g硫酸铜达饱和,当降温至30 ℃时,可析出30 g硫酸铜晶体
D.30 ℃时,将35 g硝酸钾和35 g食盐同时溶于100 g水中,蒸发时,先析出的是氯化钠
11.已知下列分子或离子在酸性条件下都能氧化KI,自身发生如下变化
H2O2 →H2O IO3— →I2 MnO4—→Mn2+ HNO2→NO
如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是
A.H2O2 B.IO3— C.MnO4— D.HNO2
12.已知:
①向KMnO4晶体滴加浓盐酸,产生黄绿色气体;
②向FeCl2溶液中通入少量实验①产生的气体,溶液变黄色;
③取实验②生成的溶液滴在淀粉KI试纸上,试纸变蓝色。
下列判断正确的是
A.上述实验证明氧化性:MnO4—>Cl2>Fe3+>I2
B.上述实验中,共有两个氧化还原反应
C.实验①生成的气体不能使湿润的淀粉KI试纸变蓝
D.实验②证明Fe2+既有氧化性又有还原性
13.在一定条件下,RO3n—与R2—发生如下反应:RO3n— + 2R2— + 6H+ == 3R + 3H2O,下列关于元素R的叙述中正确的是
A.R原子的最外层上有4个电子 B.RO3n—中的R只能被还原
C.HnRO3一定是强酸 D.R的单质既有氧化性又有还原性
14.已知1—18号元素的离子aW3+、bX+、cY2—、dZ—都具有相同的电子层结构,下列关系正确的是
A.质子数c>b B.离子的还原性Y2—>Z—
C.氢化物的稳定性H2Y>HZ D.原子半径X<W
15.1999年1月,俄美科学家联合小组宣布合成出114号元素的一种同位素,该同位素原子的质量数为298。以下叙述不正确的是
A.该元素属于第七周期
B.该元素位于ⅢA族
C.该元素为金属元素,性质与82Pb相似
D.该同位素原子含有114个电子,184个中子
16.运用元素周期律分析下面的推断。其中错误的是
A.已知Ra是第七周期、IIA族的元素,故Ra(OH)2的碱性比Mg(OH)2的碱性强
B.已知Cs的原子半径比Na的大,故Cs与水反应比Na与水反应更剧烈
C.已知As是第四周期、VA族的元素,故AsH3的稳定性比NH3的稳定性强
D.已知Cl的核电荷数比Al的核电荷数大,故Cl的原子半径比Al的原子半径小
高三化学复习班下期第一次月考
化 学 试 卷
![]() 高2007届理科复习班 姓名__________ 得分____________
高2007届理科复习班 姓名__________ 得分____________
一、选择题(本题包括16小题,每小题3分,共48分。每小题只有一个选项符合题意。)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 |
二、非选择题(本题包括6小题,共52分)
17.(6分)由氢气和氧气反应生成1 mol水蒸气放热241.8 kJ,写出该反应的热化学方程式:
。若1g水蒸气转化成液态水放热2.444 kJ,则反应H2(g)+![]() O2(g)=H2O(1)的ΔH=
kJ·mol-1,氢气的燃烧热为
kJ·mol-1。
O2(g)=H2O(1)的ΔH=
kJ·mol-1,氢气的燃烧热为
kJ·mol-1。
18.(12分)用18.4 mol·L-1的浓H2SO4配制100 mL浓度为1 mol·L-1的稀H2SO4,其操作可分为以下各步:
A.用量筒取 mL浓H2SO4缓缓注入装有约50 mL蒸馏水的烧杯中,并用玻璃棒不断搅拌
B.用约30 mL蒸馏水,分成三次洗涤烧杯和玻璃棒,将每次洗液都倒入容量瓶里
C.将稀释后的H2SO4小心倒人容量瓶里
D.检查100 mL容量瓶口部是否会发生漏液
E.将蒸馏水直接加入容量瓶至液面接近环形刻度线1~2 cm处
F.盖紧瓶塞,反复颠倒,摇匀溶液
G.用 向容量瓶里逐滴滴人蒸馏水,至液面最低点恰好与环形刻度线相切
据此填写:
(1)上述各步的空白处。
(2)正确的操作顺序是(字母填写) 。
(3)进行A步操作应选择下列量器:①10 mL量筒;②50 mL量筒;③500 mL量筒;④1000mL量筒中的 (填写序号)。
(4)进行A步操作后,必须 后,才能进行下一步操作。
(5)下列情况对实验结果产生偏低影响的是 。(填入编号)
A.容量瓶中原有少量蒸馏水
B.稀释所用烧杯洗涤2~3次,洗涤液一并注入容量瓶
C.定容时,仰视读刻度线
D.量取浓H2SO4时,仰视读数
19.(12分)已知X、Y、Z都是短周期的元素,它们的原子序数依次递增。X原子的电子层数与它的核外电子总数相同,而Z原子的最外层电子数是次外层电子数的三倍,Y和Z可以形成两种以上气态化合物,则
(1)X是 、Y是 、Z是 。(写名称)
(2)由Y和Z组成,且Y和Z质量比为7∶20的化合物的化学式(分子式)是
。
(3)由X、Y、Z中的两种元素组成,且与X2Z分子具有相同电子数的两种离子是 和 。
(4)X、Y、Z可以形成一种盐,此盐中X、Y、Z元素的原子的个数比为4∶2∶3,该盐的化学式(分子式)是 。
20.(8分)氢化亚铜(CuH)是一种难溶物质,用CuSO4溶液和“另一物质”在40—50 ℃时反应可生成它。CuH不稳定,易分解;在氯气中能燃烧;与稀盐酸反应能生成气体;Cu+在酸性条件下发生的反应是:2Cu+=Cu2++Cu。根据以上信息,结合自己所掌握的化学知识,回答下列问题:
(1)在CuSO4溶液和“另一物质”制CuH的反应中,用氧化还原观点分析,这“另一物质”在反应中所起的作用是 (填“氧化剂”或“还原剂”)。
(2)写出CuH在氯气中燃烧的化学反应方程式
。
(3)CuH溶解在稀盐酸中生成的气体是 (填化学式)。
(4)如果把CuH溶解在足量的稀硝酸中只生成NO气体,请写出CuH溶解在足量稀硝酸中反应的离子方程式:
。
 21.(4分)
21.(4分)
(1)右图为某市售盐酸试剂瓶标签上的部分数据。该盐酸的物质的量浓度为 mol·L-1。
(2)将标准状况下的NH3(g)溶于水中,得到密度为ρ g·cm—3的氨水a g,物质的量浓度为c mol·L—1,则
溶于水中NH3(g)的体积是 L。
22.(10分)
2 g Cu2S和CuS的混合物在酸性溶液中用400 mL 0.075 mol/L KMnO4溶液处理,发生反应如下:
8MnO4-+5Cu2S+44H+=10Cu2++5SO2+8Mn2++22H2O
6MnO4-+5CuS+28H+=5Cu2++5SO2+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与350 mL 0.1mol/L (NH4)2Fe(SO4)2溶液完全反应。
![]() (1)配平KMnO4与(NH4)2Fe(SO4)2反应的离子方程式:
(1)配平KMnO4与(NH4)2Fe(SO4)2反应的离子方程式:
MnO4-+ Fe2++ H+= Mn2++ Fe3++ H2O
(2)KMnO4溶液与混合物反应后,剩余KMnO4的物质的量为 mol。
(3)欲配制500mL 0.1mol/L Fe2+溶液,需称取(NH4)2Fe(SO4)2·6H2O(M=392g/mol)的质量为 g。
(4)混合物中Cu2S的质量分数为 。
化学试卷参考答案
1.A 2.C 3.C 4.D 5.A 6.B 7.D 8.A 9.C 10.D
11.B 12.A 13.D 14.B 15.B 16.C
17.(6分)
H2(g)+![]() O2(g)=H2O(g);ΔH=-241.8 kJ·mol-1 -285.8 285.8
O2(g)=H2O(g);ΔH=-241.8 kJ·mol-1 -285.8 285.8
18.(12分)
(1)A.5.4 G.胶头滴管
(2)DACBEGF
(3)①
(4)待溶液冷却至室温
(5)C
19.(12分)
(1) 氢 氮 氧
(2) N2O5
(3) NH4+ OH—
(4) NH4NO3
20.(8分)
(1)还原剂
(2)2CuH+3Cl2![]() 2CuCl2+2HCl
2CuCl2+2HCl
(3)H2
(4)CuH+3H++NO3-=Cu2++NO↑+2H2O
21.(4分)
(1) 11.8
(2) 22.4ac/1000ρ
22.(10分)
(1) 1 5 8 1 5 4
(2) 0.007
(3) 19.6
(4) 40%