高三化学应届班第二次月考试卷
化 学 试 题
可能用到的相对原子质量:H-1 C-12 N-14 O-16
Na-23 Cl-35.5 K-39 Mn-55 Fe-56
一、选择题(每小题只有一个选项符合题意,每小题3分,共45分)
1、在泡沫橡胶的制造中,要利用下面反应放出的氧气:![]() ,该反应中的双氧水 ( )
,该反应中的双氧水 ( )
A、仅为氧化剂 B、仅为还原剂
C、既是氧化剂又是还原剂 D、既不是氧化剂又不是还原剂
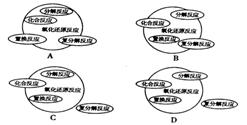
2、能正确表示四种基本反应类型与氧化还原反应关系的示意图是( )
3、如下三个热化学方程式:
![]()
![]()
![]()
关于以上三个热化学方程式的表述中正解的是( )
①它们都是放热反应 ②a、b、c均增为正值 ③a=b ④b>a ⑤2b=c
A、①④⑤ B、①②④ C、①②③ D、①⑤
4、下列金属冶炼的反应原理,错误的是( )
A、![]() B、
B、![]()
C、![]() D、
D、![]()
5、如果a g某气体中含有的分子数为b,则c g该气体在标准状况下的体积是(NA代表阿伏加德罗常数)
A、![]() B、
B、![]() C、
C、![]() D、
D、![]()
6、设NA代表阿伏加德罗常数,则下列说法正确的是( )
A、常温常压下,11.2LCO2气体与过量Na2O2充分反应后生成氧气分子的数目为0.25NA
B、常温下,18.0g重水(D2O)所含电子数为10NA
C、常温下,5.6g铁与过量稀硝酸反应,失去的电子数为0.2NA
D、常温下,1L0.1mol·L-1MgCl2溶液中含Cl-数为0.2NA
7、下列反应的离子方式式正确的是( )
A、向小苏打溶液中滴加醋酸:![]()
B、氯化铵与氢氧化钠溶液混合加热:![]()
C、单质铜与稀硝酸反应:![]()
D、氢氧化钠溶液中通入足量![]()
8、下列说法中错误的是( )
A、离子晶体在熔化状态下能导电B、在晶体中只要有阴离子就一定有阳离子
C、原子晶体中一定有非极性共价键D、分子晶体中不一定含有共价键
9、下列事实或性质与胶体没有直接关系的是( )
A、清晨,在茂密的树林,常常可以看到从枝叶间透过的一道道光柱
B、用微波手术刀进行外科手术,可使开刀处的血液迅速凝固而减少失血
C、肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗
D、自来水可通过Cl2进行消毒
10、已知反应①![]()
②![]()
③![]() ;下列说法正确的是( )
;下列说法正确的是( )
A、上述三个反应都有单质生成,所以都是置换反应。
B、氧化性由强到弱的顺序为KBrO3>KClO3>Cl2>Br2
C、反应①中还原剂与氧化剂的物质的量之比为1:6
D、若反应②中有1mol还原剂参加反应,则氧化剂得电子的物质的量为2mol
11、碳与浓硫酸共热产生的气体X和铜与浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图所示),下列有关说法正确的是( )A、洗气瓶中产生碳酸钡沉淀
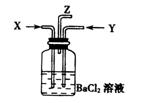 B、洗气瓶中不会产生沉淀
B、洗气瓶中不会产生沉淀
C、导气管Z中导出的气体无二氧化碳
D、在导气管Z口处有红棕色气体出现
12、下列四个实验结论中,肯定有错误的是( )
①有一瓶澄清的碱性溶液,做离子鉴定时得出结论是含有Ca2+、Fe2+、Na+、Cl-和![]() 。②一固体混合物溶于水后,检验出含
。②一固体混合物溶于水后,检验出含![]() ,则固体混合物可能是硝酸钾和氯化钠或硝酸钠和氯化钾的混合物。③固体氢氧化钠部分吸收了空气中的二氧化碳并溶于水后,溶液中含有较多的
,则固体混合物可能是硝酸钾和氯化钠或硝酸钠和氯化钾的混合物。③固体氢氧化钠部分吸收了空气中的二氧化碳并溶于水后,溶液中含有较多的![]() 。④配制FeCl3溶液时,常将FeCl3固体溶于较浓的盐酸中,然后再用水稀释到所需的浓度
。④配制FeCl3溶液时,常将FeCl3固体溶于较浓的盐酸中,然后再用水稀释到所需的浓度
A、①② B、①③ C、②④ D、②③
13、某无色透明的强酸性溶液中,能大量共存的一组离子是( )
A、![]() B、
B、![]()
C、![]() D、
D、![]()
14、高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:
![]()
下列叙述不正确的是( )
A、放电时负极反应为:![]()
B、充电时阳极反应为:![]()
C、放电时每转移3mol电子,正极有1molK2FeO4被氧化
D、放电时正极附近溶液的碱性增强
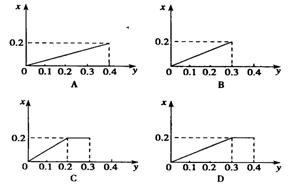
15、将22.4g铁粉逐渐加入到含HNO30.8mol的硝酸中,反应生成的气体的物质的量(x)(假设HNO3的还原产物只有NO)随消耗铁粉的物质的量(y)变化关系中正确的是 ( )
二、非选择题(本题包括5小题,共55分)
16、(10分)A、B、C、D、E、F、G七瓶不同物质的溶液,它们各是![]()
![]() 溶液中的一种,为了鉴别,各取少量溶液进行两两混合,实验结果如下表所示。(表中“↓”表示生成难溶或微溶物质,“↑”表示生成气体,“-”表示观察不到明显的现象)
溶液中的一种,为了鉴别,各取少量溶液进行两两混合,实验结果如下表所示。(表中“↓”表示生成难溶或微溶物质,“↑”表示生成气体,“-”表示观察不到明显的现象)
| A | B | C | D | E | F | G | |
| A | - | - | - | - | - | - | ↓ |
| B | - | - | - | ↑↓ | ↓ | ↓ | ↓ |
| C | - | - | - | ↓ | - | ↓ | ↓ |
| D | - | ↑↓ | ↓ | - | ↓ | ↓ | ↓ |
| E | - | ↓ | - | ↓ | - | ↓ | - |
| F | - | ↓ | ↓ | ↓ | ↓ | - | ↓ |
| G | ↓ | ↓ | ↓ | ↓ | - | ↓ | - |
试回答:
(1)A的化学式为_________,G的化学式为_________,其判断出A、G化学式的理由是___________________________________。
(2)B与D反应的离子方程式为____________________________________。
(3)写出B与F两溶液混合所发生反应的化学方程式(可能有多种情况,只写一种情况即可):______________________________________________。
 |
17、(10分)A-J是中学化学常见的物质,它们之间的转化关系如下图所示(部分产物已略去)。已知A是一种高熔点物质,D是一种红棕色固体,H的焰色反应呈黄色。
请回答下列问题:
(1)A物质的化学式为__________,H物质的名称为____________。
(2)G→J的化学方程式为__________________________。
(3)D物质与盐酸恰好反应的离子方程式为____________________________所得溶液显示酸性的原因是________________________(用离子方程式表示)。
18、(12分)某化学兴趣小组为探究铜跟浓硫酸的反应,用下图所示装置进行有关实验。请回答:
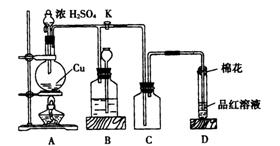 (1)装置A中发生的化学反应方程式为_____________________________。
(1)装置A中发生的化学反应方程式为_____________________________。
(2)装置D中试管口放置的棉花中应浸一种液体,这种液体是___________,其作用是__________。
(3)装置B的作用是贮存多余的气体。当D处有明显的现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中现象是________________。B中应放置的液体是(填字母)______________。
a、水 b、酸性KMnO4溶液 c、浓溴水 d、饱和NaHSO3溶液
(4)实验中,取一定质量的铜片和一定体积18mol·L-1的浓硫酸放在圆底烧瓶中共热,直到反应完毕,发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
①有一定量的余酸但未能使铜片完全溶解,你认为原因是_________________
②下列药品中能用来证明反应结束后的烧瓶中确有余酸的是____(填字母)
a、铁粉 b、BaCl2溶液 c、银粉 d、Na2CO3溶液
19、(10分)如下图装置中,b电极用金属M制成,a、c、d为石墨电极,接通电源,金属M沉积于b极,同时a、d电极上产生气泡。
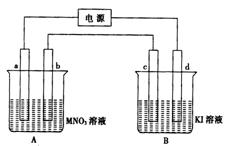
(1)a为_______极,c的电极反应式为:___________________________。
(2)电解开始时,在B烧怀中滴几滴淀粉溶液,你能观察到的现象为:______________________________________________________________。
(3)当d极上产生标准状况下448ml气体时停止电解,a极上放出______mol气体,若b极上沉积金属M的质量为4.32g,则金属M的摩尔质量为______。
20、(13分)取0.04molKMnO4固体加热一段时间后,收集到a mol单质气体,此时KMnO4的分解率为x,在反应后的残留固体中加入100mL36.5%、1.18g/cm3的浓盐酸地(过量)并加热,充分反应后又收集到bmol单质气体(假定气体全部逸出),锰元素(Mn)全部以Mn2+存在于反应后的溶液中。
分解产物与浓盐酸在加热时涉及下列反应:
①![]()
②□![]() +□Cl-+□H+=□Mn2++□Cl2+□H2O
+□Cl-+□H+=□Mn2++□Cl2+□H2O
③![]()
(1)试配平反应②的离子方程式,将化学计量数填入上述对应的方框内(如果是1,也必须填写)。
(2)a+b=_______(用含x的代数式表示)
(3)当x=_______时(a+b)取最小值,且最小值为___________。
(4)当a+b=0.09mol时,0.04molKMnO4按上述操作反应后,将所得溶液稀释至1L。该稀释后的溶液中c(H+)=________mol·L-1。
答题卷
姓名__________ 班级____________
一、选择题(共15小题,每小题3分,共45分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| 答案 |
二、非选择题
16、(10分)
(1)A_____________________,G_____________________,判断理由是_____________________________________________________________________________________________________________________________________。
(2)_____________________________________________________________
__________________________________________________________________。
(3)______________________________________________________________
___________________________________________________________________
17、(10分)
(1)A_______________,H_______________。
(2)G→J_________________________________________________________。
(3)_____________________________________________________________。
原因___________________________________________。(用离子方程式表示)
18、(12分)
(1)____________________________________________________________。
(2)_______________,作用是______________________________________。
(3)B中现象是___________________________________________________。
B中液体是___________________________________________________。
(4)①原因是_____________________________________________________。②______________。
19、(10分)
(1)a为______极,c的电极反应式为_______________________________。
(2)____________________________________________________________。
(3)a极上放出_______mol气体,M的摩尔质量为____________________。
20、(13分)
(1)□![]() +□Cl-+□H+=□Mn2++□Cl2+□H2O
+□Cl-+□H+=□Mn2++□Cl2+□H2O
(2)a+b=_______(用含x的代数式表示)
(3)当x=_______时,且最小值为___________。
(4)c(H+)=________mol·L-1。
参考答案
1.C 2.D 3.D 4.C 5.A 6.D 7.B 8.C 9.D 10.B
11.D 12.B 13.A 14.C 15.C
16.(10分。每空2分)
(1)KCl,AgNO3。混合时只生成一种沉淀的,只有KCl,生成的沉淀为AgCl,所以A定为KCl,G为AgNO3。
(2)2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑
(3)Al2(SO4)3+3Ba(OH)2=3BaSO4↓+2Al(OH)3↓
或Al2(SO4)3+4Ba(OH)2=3BaSO4↓+2Ba(AlO2)3+4H2O (写对其中一个就给2分)
17.(10分。每空2分)
(1)Al2O3 偏铝酸钠
(2)4Fe(OH)2+O2+2H2O=4Fe(OH)3
(3)Fe2O3+6H+=2Fe3++3H2O Fe3++3H2O![]() Fe(OH)3+3H+
Fe(OH)3+3H+
18.(12分。未标示分数的每空2分)
(1)Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
(2)碱液(其他合理答案均可给分);吸收多余的二氧化硫,防止污染空气(每空1分)
(3)试剂瓶中液面下降,长颈漏斗中液面上升;d
(4)①反应过程中浓硫酸被消耗,逐渐变稀,而铜不和稀硫酸反应;②a、d
19.(10分。每空2分)
(1)阳极 2I--2e—=I2
(2)C极附近的溶液首先变蓝
(3)0.01 108 g/mol
20.(13分。未标示分数的每空2分)
(1)1,4,8=1,2,4
(2)0.1-0.02x(3分)
(3)1 0.08
(4)0.9(4分)