高三化学上学期联考试卷
化 学
命题人:熊维平 学校:南昌一中 审 题 人:邓 涛 学校:南昌一中
考试时间:100分钟 试卷总分:100分
可能用到的相对原子量: H:1 C:12 N:14 O:16 Na:23 Mg:24 Al:27 K:39 S:32 Cl:35.5 Fe:56
Cu:64 Zn:65 Ba:137 I:127 Br:80
一、选择题(每小题只有一个正确选项,本大题分值16×3,=48分)
1.20世纪80年代后,人们发现和证实了碳的另一类单质,它们是由一系列偶数个碳原子组成的分子,其中C60(足球烯,分子中含有30个双键)最具代表性。下图所示为n个C60连接而成的物质X。下列有关说法不正确的是
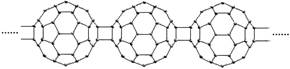
A.常温常压下X为固态且难溶于水
B.一定条件下X可与Cl2发生加成反应
C.X是碳的一种同素异形体
D.X的摩尔质量为720n
2.通入少量CO2,下列溶液能发生反应,但无明显现象的是
A.澄清石灰水 B.水玻璃 C.苯酚钠溶液 D. 苏打溶液
3.下列各组物质反应后,含碳元属的物质既是氧化剂又是还原剂的是
A.CO2+Na 2O2 B.Mg+CO2 C.CaO+C D.CaCO3+SiO2
4.欲除去含有1mol·L-1Mg(HCO3)2和2mol·L-1CaCl2的混合溶液中的Mg2+、Ca2+,选用下列一种试
剂适量即可,该试剂是
A.NaHCO3 B.Na2CO3 C.NaOH D.Ca(OH)2
5.下列反应的离子方程式书写不正确的是
A.向NaHCO3溶液中加入少量澄清的Ca(OH)2溶液:
2HCO3-+Ca2++2OH- = CaCO3↓+CO32-+2H2O
B.用碳酸钠溶液吸收少量二氧化硫:2CO32-+SO2+H2O=2HCO3-+SO32-
C.在饱和的苏打溶液里滴入少量盐酸:CO32-+2H+=CO2↑+H2O
D.过量二氧化碳通人偏铝酸钠溶液中:CO2+2H2O+AlO2-=Al(OH)3↓+HCO3-
6.现有下列各组溶液:
①10℃时10mL 0.1mol/L的Na2S2O3溶液和50mL0.1mol/L的H2SO4溶液;
②10℃时10mL 0.05mol/L的Na2S2O3溶液和l0 mL 0.1mol/L的H2SO4溶液;
③30℃时10mL 0.05mol/L的Na2S2O3溶液和10mL0.1mol/L的H2SO4溶液。
若同时将它们混合发生反应:Na2S2O3+ H2SO4≒Na2SO4+S↓++SO2↓+H2O,则出现浑浊的先后次序是
A.①②③ B.②①③ C.③②① D.①③②
7.对处于化学平衡的体系,关于化学平衡与化学反应速率的关系正确的是
A.化学反应速率变化时,化学平衡一定发生移动
B.只有在催化剂存在下,才会发生化学反应速率变化而化学平衡不移动的情况
C.正反应进行的程度大,正反应速率一定大
D.化学平衡发生移动时,化学反应速率一定变化
8.在一固定容积的密闭容器中加入2molA和lmolB发生下列反应并且达到化学平衡状态,
2A(g)+B(g)≒3C(g)+D(s)。平衡时C的浓度为a mol/L,若维持容器体积和温度不变,按下列四
种配比作为起始物质充入该容器中,达到平衡后,C的浓度不是2 a mol/L的是
A.4molA+2mol B
B.2molA+lmol B+3mol C+2mol D
C.6mol C+6mol D
D.3mol C+lmol D+lmol B+lmol A
9.为了更好地表示溶液的酸碱性,科学家提出了酸度(AG)的概念,AG=lg![]() 。已知某无色溶液的AG=12,则在此溶液中能大量共存的离子组是
。已知某无色溶液的AG=12,则在此溶液中能大量共存的离子组是
A.Na+、AlO2-、K+、NO3-
B.MnO4-、K+、SO42-、Na+
C.NH4+、NO3-、Al3+、Cl-
D.Mg2+、SO42-、HCO3-、Na+
10.如图所示,某刚性容器内有一活塞和弹簧,B为真空,A内已充入2molSO2和1molO2,在一定
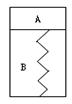 条件下发生可逆反应2SO2+O2
条件下发生可逆反应2SO2+O2![]() 2SO3;△H=-QkJ/mol,(Q>0)
2SO3;△H=-QkJ/mol,(Q>0)
一段时间后活塞已保持静止,SO2的反应速率为V0。再往A内迅速充入
2 molSO2和1molO2,当活塞再次保持静止时,SO2的反应速率为V,在此过
程中,下列说法正确的是
A.活塞先下移,后上移但不到原静止位置, V > V0
B.活塞先下移,后上移到原静止位置, V = V0
C.活塞先下移,后上移到原静止位置, V > V0
D.活塞先下移,后上移但不到原静止位置, V = V0
11.常温时,在同体积pH=3的H2SO4、HNO3、CH3COOH溶液中,加入足量镁粉,下列说法正确的是
A.H2SO4中放出H2最多
B.HNO3比醋酸放出H2多
C.H2SO4和HNO3放出H2一样多
D.醋酸中放出H2最多
12.某溶液中只含有Na+、H+、OH—、A—四种离子,下列说法正确的是
A.若溶液中c(A—)=c(Na+),则溶液一定呈中性
B.溶液中不可能存在:c(Na+)>c (A—)>c(OH—)>c(H+)
C.若c(OH—)>c(H+),溶液中不可能存在:c(Na’)>c(OH—)>c(A—)>c(H+)
D.若溶质为NaA、HA,则一定存在: c(A—)>c(Na+)>c(H+)>c(OH—)
13.室温时,将x mL pH=a 的稀NaOH溶液与ymL pH=b的稀盐酸充分反应。下列关于反应后溶液pH的判断,正确的是
A.若x=y,且a+b=14,则pH>7
B.若10x=y,且a+b=13,则pH=7
C.若ax=by,且a+b=13,则pH=7
D.若x=10y,且a+b=14,则pH>7
14.在一定条件下化学反应:2SO2(g)+O2(g)![]() 2SO3(g);△H=-197
kJ/mol 现有容积相同的
2SO3(g);△H=-197
kJ/mol 现有容积相同的
甲、乙、丙三个容器,在上述条件下分别充入的气体和反应 放出的热量(Q)如下表所列:
| 容器 | SO2(mol) | O2(mol) | N2(mol) | Q(kJ) |
| 甲 | 2 | 1 | 0 | Q1 |
| 乙 | 1 | 0.5 | 0 | Q2 |
| 丙 | 1 | 0.5 | 1 | Q3 |
根据以上数据,下列叙述不正确的是
A.2Q2=2Q3<Q1<197 kJ
B.在上述条件下每摩该反应进行到底时放出的热量为197 kJ
C.在上述条件下反应生成1 molSO3气体放热98.5 kJ
D.Q1=2Q2=2Q3<197
|
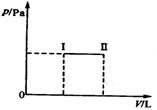
从状态I自发反应到状态Ⅱ的变化曲线如图,则该反应
过程A(g)+B(g) ![]() 2C(g)是
2C(g)是
A.放热反应
B.吸热反应
C.状态Ⅱ达到化学平衡状态
D.状态Ⅱ一定达到化学平衡状态
16.浓度均为0.1mol/L的(NH4)2SO4、NaOH、NaHSO4、Na2SO4溶液,分别从25℃升到 95℃,其中pH值变化不大的是(物质的蒸发及溶液的体积变化忽略)
A.(NH4)2SO4 B.NaOH
C.NaHSO4 D.Na2SO4
二、填空题
17.对于反应:N2+3H2≒2NH3(正反应为放热反应),请从以下选项中选择填空(填写编号,多选倒扣分)。
(Ⅰ)其他条件不变能使反应速率增大的因素有 ,
(Ⅱ)其他条件不变能使平衡向正反应方向移动的因素有 。
①增大N2或H2的浓度 ②增大压强(缩小容积) ③降低温度
④加(正)催化剂 ⑤增大NH3的浓度 ⑥减小NH3的浓度
⑦保持容积不变,充入氩气 ⑧保持压强不变,充入氩气
18.常温下有浓度均为0.5mol·L-1的四种溶液:①碳酸钠溶液 ②碳酸氢钠溶液 ③盐酸 ④氨水。请根据题目要求回答下列问题:
(Ⅰ)上述溶液中,可发生水解反应的是 (填序号,下同),在发生水解反应的溶液中pH最大的是 。
(Ⅱ)上述溶液中,既能与氢氧化钠溶液反应,又能与硫酸溶液反应的是 。
(Ⅲ)取适量溶液④,加入少量氯化铵固体,此时溶液中![]() 的值 (填“增大”或“减小”或“不变”)
的值 (填“增大”或“减小”或“不变”)
(Ⅳ)将等体积的③和④的溶液混合后,所得溶液中离子浓度由大到小的顺序是
。
(Ⅴ)取10mL溶液③,加水稀释到500mL,则该溶液中由水电离出的c(H+)= 。
19.现有四种单质组成的合金A,为分析其成分,用此合金进行一系列实验,其过程及发生反应的现象如下图所示。
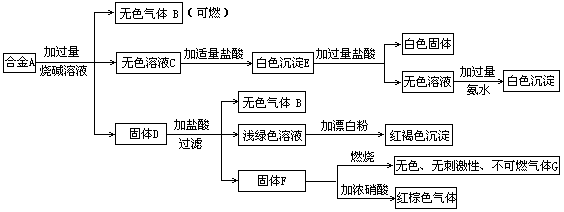
填写下列空白:
(1)A中含单质为为 (写化学式);G的电子式为 。
(2)写出A中的某单质与烧碱溶液反应的离子方程式______ __________.
(3) 写出固体F与硝酸反应的化学方程式,并标出电子转移的方向和数目
。
20.在425℃时,在1升密闭容器中进行的反应 H2(g)+I2(g)![]() 2HI(g) 达到平衡,分析下面示意图后,
2HI(g) 达到平衡,分析下面示意图后,
(1)从下列选项中选出能从示意图中读出相关信息的选项_____________________(填选项号)
(2)除(1)选出的选项,还能从示意图读出的信息是_________________________________。
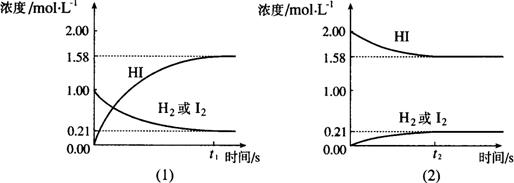
A.同温同压下,从正、逆方向都可以建立平衡。
B.同温下,当三种物质状态为气态时,压强改变对平衡无影响 。
C.此可逆反应的正反应进行程度更深 ,正反应方向为主要反应。
D.当三种物质状态为气态时,温度改变但气体体积不变。
E.![]() HI :
HI :![]() :
:![]() =2:1:1
=2:1:1
F.相同条件下,分别从正、逆方向建立等同的平衡状态,所须时间可能不同。
21.根据下列叙述回答(1)~(3)题。
在一个容积固定的反应容器有一可左右滑动的密封隔板,两侧分别进行如图所示的可逆
反应:
| 2A(g)+B(g)≒2C(g) | D(g)+3E(g)≒2F(g) |
各物质的起始加入量如下:A、B、C、D、E、F的物质的量分别为2mol,1mol,0 mol,Xmol,Ymol,Zmol,两边反应达平衡后,隔板恰好在正中间的位置。
(1).恒温时,若向左边容器中充入0.3mol He(He不与A、B、C、D、E、F反应),下列说法正确的是
A、A的物质的量增加
B.B的转化率增大
C.C的物质的量不变
D.F的浓度,体积分数一定都增大
(2).恒温时,若向左边容器中通人的不是He,而是2 molA和1mol B的气体,则下列说法正确的是
A.A的体积分数不变
B.B的转化率降低
C.C的体积分数、浓度都增大
D.右边容器中气体平均相对分子质量增加
(3).恒温时在(2)题的平衡体系中,若向左右两容器中同时再各注入lmolHe,平衡后与(2)题的平衡体系相比,下列说法正确的是
A.C、F的浓度都不变
B.B的转化率,F的分解率都增加了
C.A、D物质的量都增加了
D.A、B、C、D、E、F物质的量都不变
三、计算题
22.向盛有VLNaHSO4和Na2SO4混合溶液的烧杯中不断加入Ba(OH)2溶液,当沉淀量达到最大值时,溶液的总体积为2VL。溶液中产生沉淀的物质的量与溶液的pH变化如图。求原溶液中NaHSO4、Na2SO4 及所加Ba(OH)2三者的物质的量浓度。
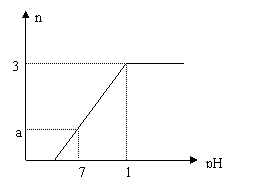
(1) c(NaHSO4)__________________
(2)c(Na2SO4)___________________
(3)c(Ba(OH)2)__________________
 | |||||||
| |||||||
化 学 答 题 纸
一、选择题(共48分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 选项 |
|
|
|
|
|
|
|
|
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 选项 |
|
|
|
|
|
|
|
|
二、填空题(共46分)
17.(Ⅰ)_______________(Ⅱ)_______________
18.(Ⅰ)______________ ,_____________
(Ⅱ)___________
(Ⅲ)___________
(Ⅳ)__________________________
(Ⅴ)________________________
19.(1)_________________________________________
(2)________________________________________
(3)____________________________________________
20.(1)______________________
(2)__________________________________________________________________
21.(1)______________ (2)_______________(3)________________
三、计算题(共6分)
22.(1)__________________ (2)__________________(3)__________________
高三试卷
化学参考答案及评分标准
一、选择题
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 选项 | D | D | C | C | C | C | D | D |
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 选项 | C | A | D | A | D | D | A | C |
二、填空题
17.(Ⅰ)①②④⑤ (4分) (Ⅱ)①②③⑥ (4分)
(每个1分,多选、错选1个倒扣1分,不出现负分)
18.
(Ⅰ)①②, ① (3分)
(Ⅱ)② (2分)
(Ⅲ)减小 (2分)
(Ⅳ)c(C1-)>c(NH4+)>c(H+)>c(OH-)(2分)
(Ⅴ)10-12mol·L-1 (2分)
19.(1)Fe、Al、Si、C
(2×4=8分) ![]() (2分)
(2分)
(2)2Al +2OH-+2H2O=2AlO2-+3H2↑ (2分)
![]() (3)
(3)
C+4HNO3(浓)=CO2↑+4NO2↑+2H2O (3分)
20.(1)ABCE(4分)
(2)相同条件下,分别从正、逆方向建立等同的平衡状态,所须时间可能不同。(2分)
21.(1)AD(2分)
(2)CD(2分)
(3)B(2分)
22.(1)0.010mol/L、(2分)
(2)0.005 mol/L、(2分)
(3)0.015 mol/L(2分)