高三化学下学期月考试题
6.下列说法不符合人与自然和谐相处的是 ( )
A.很多城市对废旧电池进行回收处理
B.许多国家对聚乙烯等塑料垃圾进行了深埋或者倾倒入海处理
C.现在不少地区正在使用沼气,太阳能,风能等能源替代传统的煤炭
D.许多地方政府出台相关法规来保护生物物种多样性
 7、右图是同学们经常使用的某品牌修正液包装标签。小明仔细阅读后,结合自己的生活经验和所学知识得出了该修正液的某些性质,小明的推测中不合理的是( )
7、右图是同学们经常使用的某品牌修正液包装标签。小明仔细阅读后,结合自己的生活经验和所学知识得出了该修正液的某些性质,小明的推测中不合理的是( )
A.修正液是一种胶体,均一、透明 B.修正液中含有的化学物质有毒
C.修正液的成分对纸张不具有腐蚀性 D.修正液的溶剂易挥发、易燃
8.下列关于工业生产的叙述中,错误的是( )
A.用离子交换膜法电解饱和食盐水制烧碱
B,目前合成氨,没有采用更高温度、更大压强是从设备和动力要求方面考虑的
C.采用电解熔融氯化铝的方法制取金属铝
D.生产硫酸时,接触室内热交换器的作用是预热进入的炉气和冷却反应生成的气体
9.下列实验能达到预期效果的是( )
①用乙醇和浓硫酸除去乙酸乙酯中的少量乙酸
②将氯气的制备和性质实验联合进行以减少对空气的污染
⑧用食醋和澄清石灰水验证蛋壳中含有碳酸盐
④用硝酸钡溶液鉴别硫酸根离子与亚硫酸根离子
⑤用溴水检验汽油中含有不饱和烃
A.①②③ B.①③④ C.②③⑤ D.②④⑤
10.阿佛加德罗常数约为6.02×1023mol—1,下列叙述正确的是( )
A.标准状况下,2.24L苯中约含有3.612×1023 个碳原子
B.常温常压下,氧气和臭氧的混和物16g中约含有6.02×1023 个原子
C.25℃时,1L pH=13的氢氧化钠溶液中约含6.02×1023个氢氧根离子
D.0.5molCH4中约含有3.01×1023个电子
11.下列有关化学实验的操作或说法中,正确的是 ( )[答案]B
A.制备硫酸亚铁晶体时,向稀硫酸中加入废铁屑至有少量气泡发生时,过滤,然后加热蒸干滤液即可得硫酸亚铁晶体。
B.制备Fe(OH)2时,将盛NaOH(aq)的滴管伸入到试管内FeSO4(aq)的液面下
C.焰色反应操作是:将铂丝放在稀盐酸中洗涤,然后蘸取待检物置于酒精灯或煤气灯的火焰上灼烧,观察火焰的颜色
D.用盐析法除去淀粉中混有的NaCl杂质
12.在一个1L的密闭容器中,加入2molA和1molB ,发生下述反应:
2A(g) + B(g) ![]() 3C(g) + D(s),达到平衡时,C的浓度为1.2mol/L,维持容器的体积和温度不变,按下列配比作为起始物质,达到平衡后,C的浓度还是1.2mol/L的是 ( )[答案]C
3C(g) + D(s),达到平衡时,C的浓度为1.2mol/L,维持容器的体积和温度不变,按下列配比作为起始物质,达到平衡后,C的浓度还是1.2mol/L的是 ( )[答案]C
A.1mol A+0.5mol B+1.5mol C+0.1mol D B.3mol C+ 0.7mol D
C.2mol A+1mol B+1molD D.0.5mol A+0.25mol B+2.25mol C
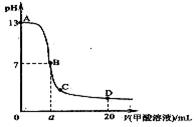 13.在15mL0.1 mol·L-1KOH溶液中逐滴加入0.2 mol·L-1
13.在15mL0.1 mol·L-1KOH溶液中逐滴加入0.2 mol·L-1
甲酸溶液,溶液pH和加入的甲酸的体积关系曲线如下图
所示,有关粒子浓度大小关系正确的是( )
A.在A、B间任意一点:c(K+)>c(HCOO-)>c(OH-)>c(H+)
B.在B点:c(K+)=c(HCOO-)>c(OH-)=c(H+),且a=7.5
C.在C点:c(HCOO-)>c(K+)>c(OH-)>c(H+)
D.在D点:c(HCOO-)+c(HCOOH)>2c(K+)
26.(12分)A、B、C、D、E、F均为短周期元素,原子序数依次递增。A元素原子核内无中子。B元素原子外最外层电子数是次外层电子数的2倍。C元素是地壳是含量最多的元素。D是短周期元素中金属性最强的元素。E与F的位置相邻,F的最高价氧化物的水化物为最强酸。
(1)推断B的元素周期表中的位置:第 周期,
族。
(2)画出F的原子结构示意图: 。
(3)C、D可形成淡黄色的粉末,其电子式为: 。
(4)写出A与C形成的10电子微粒的化学式: 、 、
。
(5)D、E形成的正盐的水溶液中,阴离子的浓度大小顺序为:
(从大到小排列) 。
(6)常温下,1molA元素的单质与C元素的单质化合,放出286kJ的热,写出反应的热化学方程式: 。
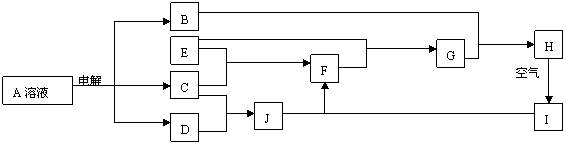
27.(16分)A、B、C、D、E、F、G、H、I、J均为中学化学中常见物质,其相互转化的关系如下所示:已知,A的焰色反应呈黄色,I是一种红褐色沉淀。
⑴写出下列物质的化学式:B:NaOH ;E:Fe ;D: H ;H: Fe(OH) 。
⑵常温下C是黄绿色气体:
①写出A的电极反应方程式:阴极: 2H++2e-=H↑(或2HO+2e-=H↑+2OH-) ;
阳极: 2Br--2e -=Br ;
②写出H→I的化学方程式:4Fe(OH)+O+2HO=4Fe(OH) ↓;
③G与足量Cl2反应的离子方程式:2Fe2++4Br-+3Cl=2Fe3++2Br+6Cl- 。
28.(14分)已知: CH3-CH=CH2 + HBr → CH3-CHBr-CH3
1mol某烃A充分燃烧后可以得到8 mol CO2和4 mol H2O。该烃A 在不同条件下能发生下图所示的一系列变化。
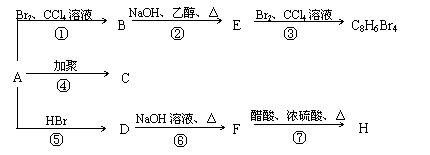 |
(1)A的化学式: A的结构简式:
(2)上述反应中,①是 反应,⑦是 反应。(填反应类别)
(3)写出C、D、E、H物质的结构简式:
C , D ,
E , H 。
(4)写出D → F反应的化学方程式
29.(18分)I,(6分).(1)在仪器①分液漏斗、②试剂瓶、③集气瓶、④滴瓶、⑤滴定管、⑥容量瓶、⑦量筒、⑧托盘天平 中,标有“0”刻度的是(填序号,下同)__________________;标有使用温度的仪器是____________。
(2)“磨砂”是增加玻璃仪器密封性的一种处理工艺。在仪器 ①试管、②分液漏斗、③细口试剂瓶、④广口试剂瓶、⑤集气瓶、⑥滴瓶、⑦酸式滴定管、⑧碱式滴定管 中,没用到“磨砂”的有__________________。
II,(12分). 海水的综合利用可以制备金属镁,其流程如下图所示:
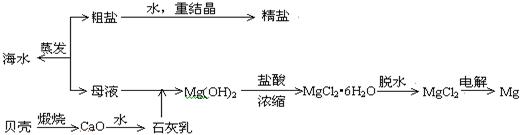
(1)实验时将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到的玻璃仪器是___________,说明在蒸发时使用该玻璃仪器的目的____________________________________________。
(2) 若在空气中加热MgCl2•6H2O,生成的是Mg(OH)Cl或MgO,请写出生成Mg(OH)Cl的化学方程式
用电解法制取金属镁时,需要无水氯化镁。在干燥的HCl气流中加热MgCl2•6H2O时,能得到无水MgCl2,其原因是 _______________________________
(3)由MgCl2·6H2O制取无水MgCl2的部分装置(铁架台、酒精灯已略)如下:
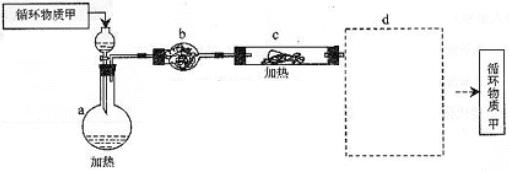
① 循环物质甲的名称是 b装置的仪器名称是_____________________
② 装置b中填充的物质可能是 (填入编号)
e 硅胶 f. 碱石灰 g. 无水氯化钙 h. 浓硫酸
③设计d装置要注意防止倒吸,请在方框中画出简图,并要求与装置c的出口处相连(铁架台不必画出)。