高三化学上学期期中质量检测题
相对原子质量:Ar(H)=1 Ar(C)=12 Ar(O)=16 Ar(N)=14 Ar(Na)=23 Ar(Al)=27 Ar(S)=32 Ar(Fe)=56 Ar(Sn)=119
第Ⅰ卷 (选择题部分共64分)
一、选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意)
1.2008年夏季奥运会将在北京举行,届时要突出“绿色奥运、人文奥运、科技奥运”理念。绿色奥运是指 ( )
A.加大反恐力度,并讲求各国运动员的营养搭配,使他们全身心投入比赛。
B.严禁使用兴奋剂,使运动员公平竞争。
C.把环境保护作为奥运设施规划和建设的首要条件
D.奥运场馆建设均使用天然材料,不使用合成材料
2.目前人类已发现的非金属元素除稀有气体外,共有16种,下列对这16种非金属元素的相关判断 ( )
①都是主族元素,最外层电子数都大于4
②单质在反应中都只能作氧化剂
③氢化物常温下都是气态,所以又都叫气态氢化物
④氧化物常温下都可以与水反应生成酸
A.只有①②正确 B.只有①③正确 C.只有④正确 D.①②③④均不正确
3.纯净的氯化钠是不潮解的,但粗盐很容易潮解,这主要是因为其中含有杂质MgCl2的缘故。为得到纯净的氯化钠,有人设计了一个实验:把买来的粗盐放入纯氯化钠饱和溶液一段时间,过滤,洗涤,可得纯净的氯化钠晶体。则下列说法中,正确的是 ( )
A.粗盐的晶粒大一些有利于提纯
B.设计实验的根据是MgCl2比NaCl易溶于水
C.设计实验的根据是NaCl的溶解平衡
D.在整个过程中NaCl饱和溶液浓度会变大(温度不变)
4.以NA代表阿伏加德罗常数,则关于反应:
C2H2(g) +![]() O2(g)
O2(g)![]() 2CO2(g) + H2O(l);△H=-1300kJ/mol
2CO2(g) + H2O(l);△H=-1300kJ/mol
热化学方程式的说法正确的是 ( )
A.有8NA个电子转移时,该反应放出1300kJ的能量
B.有NA个水分子生成且为液体时,吸收1300kJ的能量
C.有4NA个碳氧共用电子对生成时,放出1300kJ的能量
D.有8NA个碳氧共用电子对生成时,放出1300kJ的能量
5.下列说法正确的是 ( )
A.在晶体中只要有阳离子就一定有阴离子
B.原子晶体的熔点一定比金属晶体的高
C.正四面体的分子结构中键角一定为109º28’
D.不同的原子化学性质可能相同
6.已知Al和Ga是同族元素,且都是两性元素,并知Al(OH)3的碱性比Ga(OH)3大。若将等物质的量的Al和Ga溶于NaOH溶液中,然后再通入CO2,则 ( )
A.Ga(OH)3先沉淀 B.Al(OH)3和Ga(OH)3同时沉淀
C.Al(OH)3先沉淀 D.无法判断两种沉淀的先后顺序
7.11.9g金属锡跟100mL12mol·L-1HNO3共热一段时间。完全反应后测定溶液中c(H+)为
8mol·L-1,溶液体积仍为100mL。放出的气体在标准状况下体积约为8.96L。由此推断氧化产物可能是 ( )
A.SnO2·4H2O B.Sn(NO3)4 C.Sn(NO3)2 D.Sn(NO3)2和Sn(NO3)4
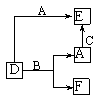 8.A、B、C分别是常见的金属或非金属单质。D、E、F是常见的三种氧化物,且有如图所示转化关系。则下列说法不正确的是
( )
8.A、B、C分别是常见的金属或非金属单质。D、E、F是常见的三种氧化物,且有如图所示转化关系。则下列说法不正确的是
( )
A.D、E中一定都含有A元素
B.单质B肯定是氧化剂
C.A、B、C中一定有一种是氧元素的单质
D.若A是非金属,则B一定为金属
二、选择题(本题包括8小题,每小题4分,共32分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分。)
9.已知同温度下的溶解度:Zn(OH)2>ZnS,MgCO3>Mg(OH)2;就溶解或电离出S2-的能力而言,FeS>H2S>CuS,则下列离子方程式错误的是 ( )
A.Mg2+ + 2HCO3- + 2Ca2+ + 4OH- = Mg(OH)2↓+ 2CaCO3↓+ 2H2O
B.Cu2+ + H2S = CuS↓+ 2H+
C.Zn2+ + S2- + 2H2O = Zn(OH)2↓+ H2S↑
D.FeS + 2H+ = Fe2+ + H2S↑
10.NH3和O2的混合气100mL通过红热的铂网,充分反应后的混合气再通过足量的水,最终收集到10mL残留气体,则原混合气体中O2的体积不可能是(气体体积在相同条件下测定) ( )
A.12.5mL B.21.5mL C.64.2mL D.70.0mL
11.下列溶液中通入足量SO2后,最终一定会出现沉淀的是 ( )
A.Na2S B.BaCl2 C.Ba(NO3)2 D.Ca(OH)2
12.一定条件下,碘单质与砹单质以等物质的量进行反应,可得AtI。它与Zn、NH3都能发生化学反应,化学方程式分别如下:2AtI+2Zn = ZnI2+ZnAt2,AtI+2NH3(l) = NH4I+NH2At下列关于AtI性质的叙述正确的是 ( )
A.ZnI2既是氧化产物,又是还原产物
B.ZnAt2既是氧化产物,又是还原产物
C.AtI与液氨反应,AtI既是氧化剂,又是还原剂
D.AtI与液氨反应,是自身氧化还原反应
13.科学家预言超级原子的发现将会重建周期表,2005年1月美国科学家在《Science》上发表论文,宣布发现A1的超原子结构A113和A114,并在质谱仪检测到稳定的Al13I-等。A113、A114的性质很像现行周期表中的某主族元素,已知这类超原子当具有40个价电子时最稳定。下列说法不正确的是 ( )
A.All4与ⅡA族元素性质相似
B.A113与卤素性质类似
C.A113在气相中与HI反应的方程式可表示为:A113 + HI = HAl13I
D.A113超原子中A1原子间是通过离子键结合的
14.下面二维平面晶体所表示的化学式为AX3的是 ( )
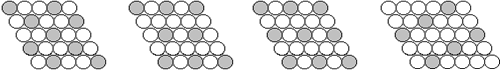 |
A. B. C. D.
15.用氢化钙(CaH2)和重水(D2O)反应,生成物中不可能有的物质是 ( )
A.Ca(OH)2 B.Ca(OD)2 C.HD D.H2
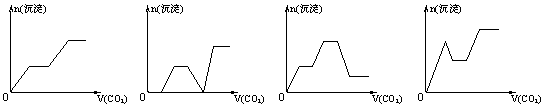 |
16.将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀与通入CO2的量的关系可表示为 ( )
A B C D
第Ⅱ卷 (非选择题部分共86分)
三、(本题包括2小题,共23分)
17.下列实验操作方法,其中正确的是 。
①CO2中含有CO可用点燃的方法除去。
②NaCl固体中含少量氯化铵可用加热的方法除去。
③检验碳酸钠溶液中是否混有氢氧化钠:可向其中滴入酚酞试液,若溶液变红,则说明有氢氧化钠。
④酸碱中和滴定时,先用待测液润洗锥形瓶,后加入一定体积的待测液。
⑤除去FeCl3酸性溶液中少量的FeCl2,加入稍过量双氧水后放置。
⑥配制50克质量分数为5%NaCl溶液:将47.5mL水加入到盛有2.5克NaCl的烧杯中,搅拌溶解。
⑦配置硫酸铜溶液时应向溶液中加入少量的铜粉。
⑧除去K2CO3固体中少量NaHCO3:置于坩埚中加热。
18.以下是测定食醋中醋酸浓度的实验:
①首先配0.10mol·L-1NaOH溶液1L
②取5mL食醋稀释至50mL
③取稀释后的食醋10mL放入锥形瓶中,滴入指示剂
④用NaOH标准液进行滴定
⑤滴定重复进行三次,求出滴定中所用标准液体积的平均值。根据以上操作,回答下列问题:
(1)从下列选项中选出①、③操作中需要仪器,用序号回答:① ;③ 。
a.表面皿 b.容量瓶 c.碱式滴定管 d.移液管 e.烧杯
f.烧瓶 g.胶头滴管
(2)设⑤中所得平均值为7.50mL,则食醋中醋酸的物质的量浓度为 mol·L-1;若食醋的密度为1.0g·cm-3,则食醋的质量分数为 。
(3)如果滴定管用水洗净后,未用标准液润洗,则食醋的浓度 ;如果锥形瓶用水洗净后,用待测液润洗,则食醋的浓度 (填“偏高”“偏低”或“无影响”)。
(4)该实验选用的指示剂最合适的是 。
A.甲基橙 B.酚酞 C.石蕊
(5)滴加的指示剂溶液的量是 。
A.1~2mL B.2~3mL C.2~3滴
19.在两支试管中分别加入3mL2mol·L-1的稀盐酸,将两个各装有0.3gNaHCO3和0.3g Na2CO3粉末的小气球分别套在试管口。将气球内的NaHCO3或Na2CO3同时倒入试管中,观察到的现象如下:
(1)试管中(填产生沉淀或气体及反应速率等相关现象)
。
(2)盛 的试管中气球变得更大,大小气球体积之比约为
(填最简单整数比)。
(3)甲同学用手触摸试管,发现盛NaHCO3粉末的试管变冷,而盛Na2CO3的试管温度有所升高。由此他得出:不管其状态如何,NaHCO3和HCl反应为吸热反应,而Na2CO3和HCl反应为放热反应。类似如中和热,甲同学写出了下列热化学方程式:
HCO3-(aq)
+ H+(aq)![]() H2O(l)
+ CO2(g);△H>0
H2O(l)
+ CO2(g);△H>0
CO32-(aq) + 2H+(aq)![]() H2O(l)
+ CO2(g);△H<0
H2O(l)
+ CO2(g);△H<0
甲同学下结论的方法是否正确 (填“正确”或“不正确”)。
(4)为研究上述反应是吸热还是放热反应,继续进行了下列实验(每次实验各做3次平行实验,取平均值):
| 序号 | 试剂1 | 试剂2 | 混合前温度 | 混合后最高或最低温度 |
| ① | 35mL水 | 2.5g NaHCO3固体 | 20℃ | 18.5℃ |
| ② | 35mL水 | 3.2 Na2CO3固体 | 20℃ | 24.3℃ |
| ③ | 35mL稀盐酸 | 含2.5g NaHCO3的饱和溶液32.5mL | 20℃ | 19℃ |
| ④ | 35mL稀盐酸 | 含3.2g Na2CO3的饱和溶液23.1mL+10ml水 | 20℃ | 24.2℃ |
| ⑤ | 35mL稀盐酸 | 2.5gNaHCO3固体 | 20℃ | 16.2℃ |
| ⑥ | 35mL稀盐酸 | 3.2g Na2CO3固体 | 20℃ | 25.1℃ |
请你帮助填写相关内容:
该研究报告的题目是《 》;
该实验中所用的仪器除试管、药匙(或V型纸槽)、气球、玻璃棒、烧杯、量筒、保温瓶外,还需要的仪器名称为 和 ;
通过上述实验可得出五条结论:
a:NaHCO3的溶解是 (填“吸热”或“放热”,下同)过程;
b:Na2CO3的溶解是 过程;
c:NaHCO3的饱和溶液和盐酸的反应是 反应;
d:Na2CO3的饱和溶液和盐酸的反应是 反应;
e:NaHCO3固体与稀盐酸反应的反应热是由 (填a→d的字母)的热效应之和。
四、(本题包括2小题,共22分)
20.A、B、C、D均为短周期不同主族的元素,分别属于三个不同的周期且原子序数依次增大。A、C可形成原子个数比分别为1∶1和2∶1的两种化合物。A与B能形成一种使湿润红石蕊试纸变蓝的气体X,A与D能形成酸性气体Y。A、B、C能形成一种离子化合物,其水溶液成弱酸性,请写出:
(1)D的元素符号 ,X跟Y反应的化学方程式 。
(2)用化学用语解释A、B、C形成的化合物水溶液呈弱酸性的原因
。
(3)铋(Bi)跟D元素能形成化合物(BiD3),其水解生成难溶于水的(BiOD)。
①BiD3水解反应的化学方程式为 。
②把适量的BiD3溶于含有少量Y的水中,能得到澄清溶液,试分析可能的原因。
。
③医药上把BiOD叫做“次某酸铋”,分析这种叫法是否合理? 。若认为不合理,请说明理由, 。(若认为合理,此空可不作答)。
21.下图为一些物质间的转化关系,其中一些转化过程的条件和某些生成物已略去。已知B为无色液体,C、D、H、N……等为单质,反应③是工业上制取单质H的反应。
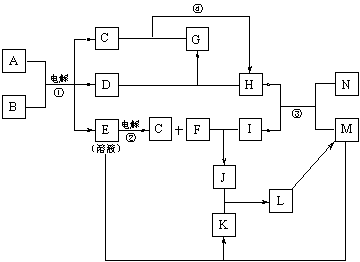
(1)写出反应③、④的化学方程式: 、
。
(2)在固态时,物质E、H、M、I、G、K中,与A的晶体类型相同的有
(写相应的化学式)。
(3)物质G的电子式为 。
(4)用离子方程式表示物质K溶液不显中性的原因 。
(5)上述物质的转化中,有一些对生产科技的发展有着重要的意义,请简单加以说明。
。
五、(本题包括2小题,共22分)
22.请根据以下题目的要求,完成相关问题:
(1)在BaCl2溶液中通入SO2气体无沉淀产生,然后将另一种气体A通入BaCl2溶液中,产生白色沉淀,则A可以是 、 、 、 (要求填二种化合物和二种单质的化学式)。写出一种化合物A与上述溶液反应的化学反应方程式 。
(2)已知可溶性硫化物在溶液中能与硫单质反应生成可溶性的多硫化物(如Na2Sn)。在浓Na2S溶液中滴入少量氯水,经振荡,未发现生成沉淀物,其原因是(只要求写出反应的离子方程式,下同) , ;
在足量氯水中,滴入少量Na2S溶液,经振荡,也未发现生成沉淀物,若再加用盐酸酸化的BaCl2溶液,即可产生白色沉淀,其原因是 。
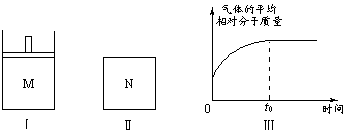 |
23.如图Ⅰ,在恒压密闭容器M中加入2 molA和2 molB,起始时容器体积为VL,发生如下反应并达到化学平衡状态:2A(?) + B(?)
(1)根据题中数据计算,x = 、y = ;
(2)如图Ⅱ,在体积为VL的恒容密闭容器N中发生上述反应(其它条件相同),测得反应过程中气体的平均相对分子质量随时间的变化如图Ⅲ(t0时达平衡),平衡时容器中C的物质的量为z mol。由于反应物A、B的状态未知,则z和y的大小也不确定,请在下表中填入A、B的状态与z、y的大小之间的关系(仿照情形①、可不填满):
| 可能的情形 | A、B是否为气态 | z与y的大小关系 | M(B)与M(C)的大小关系 (M表示摩尔质量) | |
| A | B | |||
| ① | 是 | 不是 | z = y | 前面的结论与此无关 |
| ② | ||||
| ③ | ||||
| ④ | ||||
六、(本题包括2小题,共19分)
24.已知5.000g样品内含Fe3O4、Fe2O3与惰性物质,此样品用过量的KI溶液处理后,能使所有的铁还原成Fe2+。然后把溶液稀释到50.00mL,从50.00mL此溶液中取出10.00mL溶液,其中的碘要用5.50mL1.000mol·L-1的Na2S2O3溶液滴定(I2+2Na2S2O3=2NaI+Na2S4O6)。另取25.00mL上述溶液,先除去碘,然后溶液中的Fe2+可以被3.20mLl.000mol·L-1的酸性KMnO4溶液滴定。
(1)KMnO4在酸性溶液中滴定Fe2+的离子方程式为 。
(2)原样品中Fe3O4、Fe2O3的质量分数分别为 和 。
25.有NH4HCO3、NH4Cl、Na2CO3·xH2O的混合物11.62g,加入44mL5mol·L-1NaOH溶液(过量),共热充分反应,让放出的气体通过碱石灰,结果收集到的气体是3.36L(标准状况)。向溶液中加入30mL2.5mol·L-1硫酸,并稍加热,使气体完全放出,收集到的气体是1.344L(标准状况)。把反应后的溶液稀释到100mL,测得溶液的pH为1。求:
(1)x值。
(2)混合物中各物质的质量。
高三化学期中质量检测答题卷
相对原子质量:Ar(H)=1 Ar(C)=12 Ar(O)=16 Ar(N)=14 Ar(Na)=23 Ar(Al)=27 Ar(S)=32 Ar(Fe)=56 Ar(Sn)=119
一、选择题(共32分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
二、选择题(共32分)
| 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
三、(本题包括2小题,共23分)
17.
18.(1)① ;③ 。
(2) ; 。
(3) ; 。
(4) 。
(5) 。
19.(1) 。
(2) , 。
(3) 。
(4)《 》;
、 ;
a: ; b: ; c: ; d: ; e: 。
四、(本题包括2小题,共22分)
20.(1) , 。
(2) 。
(3)① 。
② 。
③ , 。
21.(1) 、 。
(2) 。
(3) 。
(4) 。
(5)
。
五、(本题包括2小题,共22分)
22.(1) 、 、 、 。
。
(2) , ;
。
23.(1) 、 ;
(2)
| 可能的情形 | A、B是否为气态 | z与y的大小关系 | M(B)与M(C)的大小关系 (M表示摩尔质量) | |
| A | B | |||
| ① | 是 | 不是 | z = y | 前面的结论与此无关 |
| ② | ||||
| ③ | ||||
| ④ | ||||
六、(本题包括2小题,共19分)
24.(1) 。
(2) 、 。
25.
高三化学期中质量检测参考答案
一、选择题(共32分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| C | D | C | D | D | C | A | B |
二、选择题(共32分)
| 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| C | B | AC | B | D | BC | AD | C |
三、(本题包括2小题,共23分)
17.②⑤⑥
18.(1)beg dg (2)0.75 4.5% (3)偏高 偏高 (4)B (5)C
19.(1)两支试管中都产生大量气泡,但盛NaHCO3的试管中反应速率要快得多
(2)NaHCO3 53/42 (3)不正确
(4)《NaHCO3、Na2CO3 和盐酸反应过程中热效应的研究》(或相关内容)
托盘天平、温度计 a:吸热 b:放热 c:吸热 d:放热 e:a、c
四、(本题包括2小题,共22分)
20.(1)Cl NH3 + HCl![]() NH4Cl
NH4Cl
(2)NH4+ + H2O![]() NH3·H2O + H+ (3)①BiCl3 + H2O
NH3·H2O + H+ (3)①BiCl3 + H2O![]() BiOCl + 2HCl
BiOCl + 2HCl
|
|
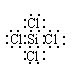 21.(1)2C + SiO2
21.(1)2C + SiO2![]() Si +
2CO↑ SiCl4 + 2H2
Si +
2CO↑ SiCl4 + 2H2![]() Si +
4HCl (2)NaOH Na2SiO3
Si +
4HCl (2)NaOH Na2SiO3
(3)
(4)SiO32- + 2H2O![]() H2SiO3
+ 2OH-
H2SiO3
+ 2OH-
(5)反应①是氯碱工业电解食盐水制取氯气和烧碱;反应④用于工业上粗硅的提纯以制取高纯硅;M(SiO2)可用于光导纤维。
五、(本题包括2小题,共22分)
22.(1)NH3 NO2 ClO2 Cl2 、O3 O2 NO2+SO2+BaCl2+H2O = BaSO4+NO+2HCl
(2)S2-+Cl2 = 2Cl-+S↓ (n-1)S+S2- = Sn2- S2-+4Cl2+4H2O = 8Cl-+SO42-+8H+
23.(1)x=2 y=1.6
(2)②是 是 z < y 前面的结论与此无关
③不是 是 z < y M(B)<M(C)
六、(本题包括2小题,共19分)
24.(1)5Fe2+ + MnO4- + 8H+![]() 5Fe3+ + Mn2+ + 4H2O (2)20.88% 29.6%
5Fe3+ + Mn2+ + 4H2O (2)20.88% 29.6%
25.(1)x = 7
(2)m(NH4HCO3) = 3.95g m(NH4Cl) = 5.35g m(Na2CO3·xH2O) = 2.32g