高三化学上学期每周试卷(3)
可能用到的原子量:H 1 C 12 N 14 O 16 Na 23 Mg 24 S 32 Cl 35.5 Ca 40 Ba 137
第一部分 选择题(共70分)
一、选择题(本题包括10小题,每小题3分,共30分。每小题只有一个选项符合题意)
1、下列不符合当今化学研究方向的是
A.发现新物质 B.合成新材料
C.研究化学反应的微观过程 D.研究化学反应中原子守恒关系
2、下列有关叙述中正确的是
A、难溶于水的电解质一定是弱电解质
B、强电解质的水溶液导电能力一定比弱电解质水溶液的导电能力强
C、易溶于水的电解质一定是强电解质
D、强电解质在水溶液中的电离过程是不可逆的
3、用3克块状大理石与30毫升3摩/升盐酸反应制取CO2气体,若要增大反应速率,可采取的措施是
①再加入30毫升3摩/升盐酸 ②改用30毫升6摩/升盐酸
③改用3克粉末状大理石 ④适当升高温度
A.①②④ B.②③④ C.①③④ D. ①②③
4、.化合物HIn在水溶液中因存在以下电离平衡,故可用作酸碱指示剂
![]() HIn(溶液)
H+(溶液)+In-(溶液)
HIn(溶液)
H+(溶液)+In-(溶液)
红色 黄色
浓度为0.02 mol·L-1的下列各溶液
①盐酸 ②石灰水 ③NaCl溶液 ④NaHSO4溶液 ⑤NaHCO3溶液 ⑥氨水
其中能使指示剂显红色的是
A.①④⑤ B.②⑤⑥ C.①④ D.②③⑥
5、下列各式中,属于正确的电离方程式的是
A.HCO3- + H2O ![]() H2CO3
+ OH- B.HCO3- +OH- ====
H2O + CO32-
H2CO3
+ OH- B.HCO3- +OH- ====
H2O + CO32-
C.NH3 + H+ === NH4+ D.NH3·H2O ![]() NH4+ +
OH-
NH4+ +
OH-
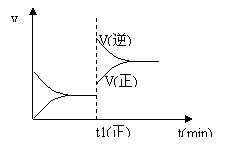 6、下图为某化学反应的速率与时间的关系示意图。在t1 时刻升高温度或增大压强,速率的变化都符合示意图的反应是
6、下图为某化学反应的速率与时间的关系示意图。在t1 时刻升高温度或增大压强,速率的变化都符合示意图的反应是
A.4NH3(g)+5O2(g) ⇌ 4NO(g)+6H2O(g) ΔH<0
B.2SO2(g)+O2(g) ⇌ 2SO3(g) ΔH<0
C.H2(g)+I2(g) ⇌ 2HI(g) ΔH>0
D.C(s)+H2O(g) ⇌ CO(g)+H2(g) ΔH>0
7、下列离子方程式书写不正确的是
A.Cl2与NaOH溶液反应:Cl2+2OH-=Cl-+ClO-+H2O
B.硫酸铝中加入过量氨水 Al3++3OH—=Al(OH)3↓
 C.K2S溶液显碱性的原因:S2-+2H2O=H2S+2OH-
C.K2S溶液显碱性的原因:S2-+2H2O=H2S+2OH-
D.AgNO3溶液中加入过量氨水:Ag++2NH3·H2O=Ag(NH3)2++2H2O
8、如右图所示,在一U型管中装入含有紫色石蕊的![]() 试液,
试液,
通直流电,一段时间后U型管内会形成一个倒立的三色 “彩虹”,
从左到右颜色的次序是
A.蓝、紫、红 B.红、蓝、紫
C.红、紫、蓝 D.紫、红、蓝
9、氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质, 被广泛应用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过如下反应合成:Al2O3 + N2 +3 C 高温 2 AlN + 3 CO 下列叙述正确的是
A.在氮化铝的合成反应中,N2是还原剂,Al2O3是氧化剂
B.氮化铝中氮元素的化合价为—3
C.上述反应中每生成2 mol AlN,N2得到3 mol电子
D.氮化铝晶体属于分子晶体
10、向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液。下列对此现象说法正确的是
A.反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变
B.沉淀溶解后,将生成深蓝色的配合离子[Cu(NH3)4] 2+
C.向反应后的溶液加入乙醇,溶液将不会发生变化,因为[Cu(NH3)4] 2+不会与乙醇发生反应
D.在[Cu(NH3)4] 2+离子中,Cu2+给出孤对电子,NH3提供空轨道
二、选择题(本题包括10小题,每小题4分,共40分,每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得4分,但只要选错一个,该小题就为0分)
11阿佛加德罗常数约为6.02×1023mol—1,下列叙述正确的是
A.标准状况下,2.24L苯中约含有3.612×1023 个碳原子
B.常温常压下,氧气和臭氧的混和物16g中约含有6.02×1023 个原子
C.25℃时,1L pH=13的氢氧化钠溶液中约含6.02×1023个氢氧根离子
D.0.5molCH4中约含有3.01×1023个电子
12、一定温度下,将2mol A、2mol B、2mol C的气体混合物充入一体积不变密闭容器中,充分反应后恢复到起始温度,测得容器内的压强比起始时增大了20%,则容器中可能发生的反应是
A.2A+B![]() 3C B.A+B
3C B.A+B![]() 2C
2C
C.2A+B![]() C D.A+B
C D.A+B![]() 3C
3C
13、下列实验操作中错误的是
A.分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
B.蒸馏时,应使温度计水银球靠近蒸烧瓶支管口
C.滴定时,左手控制滴定管活塞,右手握持锥形瓶,边滴边振荡,眼睛注视滴定管中的液面
D.称量时,称量物放在称量纸上,置于托盘天平的左盘,砝码放在托盘天平的右盘中
14.下列物质中,其水溶液能导电,溶于水时化学键被破坏,且该物质属于非电解质的是
A.SO2 B.BaSO4 C.Cl2 D.C2H5OH
![]() 15、常温下,浓度为0.1 mol/L的一元酸HA溶液的pH=2.0,浓度为0.1 mol/L的一元碱BOH溶液中
=1.0×10-12。将此两种溶液等体积混合后,所得溶液中离子浓度大小关系正确的是
15、常温下,浓度为0.1 mol/L的一元酸HA溶液的pH=2.0,浓度为0.1 mol/L的一元碱BOH溶液中
=1.0×10-12。将此两种溶液等体积混合后,所得溶液中离子浓度大小关系正确的是
A.c(OH-)>c(H+)>c(B+)>c(A-) B.c(B+)>c(A-)>c(H+)>c(OH-)
C.c(B+)>c(A-)>c(OH-)>c(H+) D.c(B+)>c(A-)>c(H+)>c(OH-)
16.下列关于电解质溶液的叙述中正确的是
A.Na2CO3、NaHCO3两种盐的溶液中,离子种类相同
B.在CH3COONa溶液中c (CH3COO-) > c(Na+) > c(OH-) > c(H+)
C.溶质的物质的量浓度相同的NH4Cl和NH4HSO4两种溶液中,c(NH4+)前者小于后者
D.常温下,某溶液中由水电离出的c(H+)为10-5 mol/L,则此溶液可能是盐酸
17、.将NaOH溶液逐滴加入到醋酸溶液中,使溶液为中性,则此时
A.c (CH3COO-)=c (Na+) B.c (CH3COO-)> c (Na+)
C.c (CH3COO-)<c (Na+) D.c (CH3COO-)与c (Na+)之间关系不确定
18、25℃时,0.1mol·L-1的某碱MOH溶液pH=13,将它和某一元酸HA的溶液等体积混合,混合后的溶液恰好为中性。下列判断正确的是
A.HA溶液的pH.一定为1 B.盐MA可能水解
C.HA物质的量浓度一定为O.1 mol·L-1 D.混合后的溶液中c(M+)一定等于c(A-)
19、.取2aL醋酸和aL盐酸分别与物质的量浓度为cmol/L的NaOH溶液混合,都恰好完全中和,则下列说法中正确的是
A. 完全中和后两溶液的pH相等
B. 盐酸和醋酸所含的阴离子的物质的量相等
C. 盐酸物质的量浓度是醋酸物质的量浓度的2倍
D. 盐酸中由水电离出来的c(H+)比醋酸溶液中水电离出来的c(H+)大
20、下列物质的分离、提纯和鉴别的方法中(必要时可加热),可行的是
A.以AgNO3溶液和稀盐酸检验溶液中是否含有Cl-
B.用升华法分离碘和氯化铵的混合物
C.以粗铜为阴极,精铜为阳极,CuSO4溶液为电解液,精炼铜
D.用NaOH溶液、蒸馏水和红色石蕊试纸检验溶液中是否含有NH4+
高三化学上学期每周试卷(3)
姓名: 座号: 分数:
第一部分 选择题(共70分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | ||||||||||
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 |
高三化学上学期每周试卷答案
一、二选择题答案表(70分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | D | D | B | C | D | A | C | C | B | B |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | B | CD | CD | AC | C | AC | A | BD | C | D |
中学2007年届化学每周专练(3)
姓名: 座号: 分数:
21、在足量的稀氯化亚铁溶液中,加入1~2滴液溴,振荡后溶液变为黄色。
(1)甲同学认为这不是发生化学反应所致,使溶液变黄色的物质是:____ __ __ (填粒子的化学式,下同);乙同学认为这是发生化学反应所致,使溶液变黄色的物质.
(2)现提供以下试剂:
A.酸性高锰酸钾溶液 B.氢氧化钠溶液 C.四氯化碳 D.硫氰化钾溶液
根据所学知识判断,___________同学(填甲或乙)的推断是正确的口用两种方法加以验证,写出选用的试剂编号及实验中观察到的现象:
| 选用试剂 | 实验现象 | |
| 第一种方法 | ||
| 第二种方法 |
22、(13分)向溴水中加入足量乙醛溶液,可以看到溴水褪色。对产生该现象的原因有如下三种猜想:①溴水与乙醛发生取代反应;②由于乙醛分子中有不饱和键,溴水与乙醛发生加成反应;③由于乙醛具有还原性,溴水将乙醛氧化为乙酸。为探究哪一种猜想正确,一研究性学习小组提出了如下两种实验方案:
方案一:检验褪色后溶液的酸碱性。
方案二:测定反应前溴水中Br2的物质的量和反应后Br-离子的物质的量。
(1)方案一是否可行? 理由是 。
(2)假设测得反应前溴水中Br2的物质的量为amol,若测得反应后n(Br—)= mol则说明溴水与乙醛发生取代反应。若测得反应后n(Br—)= mol则说明溴水与乙醛发生加成反应,若测得反应后n(Br—)= mol则说明溴水将乙醛氧化为乙酸。
(3)按物质的量之比为1∶5配制1000mL KBrO3一KBr溶液,该溶液在酸性条件下完全反应可生成0.5mol Br2。取该溶液10mL,加入足量乙醛溶液使其褪色,然后将所得溶液稀释为100mL,准确量取其中的10mL,加入过量AgNO3溶液,过滤、洗涤、干燥后称量得到固体0.188g。若已知CH3COOAg易溶解于水,试通过计算判断溴水与乙醛发生的反应为上述猜想中的 (填序号)。
(4)写出上述测定过程中反应的离子方程式。
①KBrO3与KBr在酸性条件的反应:
②溴水与乙醛反应:
(5)根据上述信息,试推测向酸性KMnO4溶液中滴加乙醛可能出现的现象:
23、(12分) 生产重铬酸钠的专业厂是用铬铁矿(主要成分是Cr2O3、FeO,还有一定量的Al2O3等)为原料的,其生产过程如下:
(1)Cr元素所在周期表中的位置
(2)在特制熔炉中将铬铁矿和过量纯碱混合,在1100℃左右通空气进行氧化:Cr2O3发生反应的化学方程式: Cr2O3 + Na2CO3 + O2 == Na2CrO4 + CO2↑
Al2O3发生反应的化学方程式: 。
(3)经上述过程后的反应料(称熟料),冷却后用水浸取,其中可溶性的物质主要有 ,不溶性杂质经过滤后除去。
(4)为了除去滤液中的铝元素,用稀硫酸将溶液中和至pH为7—8,其反应的离子方程式为 。
(5)除去铝元素后的滤液,再用稀硫酸调到pH为2—3,这时可得Na2Cr2O7溶液,其反应方程式为:
Na2CrO4 + H2SO4 —— + +
(6)请简述在实验室中可通过哪些操作可除去溶液中所混有的硫酸钠晶体,从而得到较纯的重铬酸钠溶液。(已知硫酸钠的溶解度随温度的变化较大,而重铬酸钠变化较小。)
24、.(10分)发射航天火箭常用氮的氢化物肼(N2H4)作燃料。试回答下列有关问题:
(1)写出N2的电子式
(2)液态NH3类似H2O,也能微弱电离且产生电子数相同的两种离子,则液态NH3电离方程式为_________________________________。
(3)25℃时,0.1 mol·L-1 NH4NO3溶液中水的电离程度____________ (填“大于”、“等于“或“小于”)0.1 mol·L-l NaOH溶液中水的电离程度。若将0.1mol·L-1NaOH和0.2mol·L-1 NH4NO3两溶液等体积混合,所得溶液中离子浓度由大到小的顺序为__________________________________________ _。
(4)在结构上N2H4和NH3的关系有如H2O2和H2O的关系。N2H4能发生下列反应:
N2H4+H3O+==N2H![]() +H2O N2H4+H2O
+H2O N2H4+H2O![]() N2H
N2H![]() +OH-
+OH-
N2H![]() +H2O
+H2O![]() N2H
N2H![]() +OH-
N2H
+OH-
N2H![]() + H2O
+ H2O![]() N2H4+H3O+
N2H4+H3O+
据此可得出的结论是______________________。
A.肼水解显酸性 B.肼在水中电离出H+离子
C.肼是二元弱碱 D.肼是二元弱酸
(5)完成下列反应方程式并配平:
______NH3+______NaClO==_________NaCl+_______N2H4+_____ _____
(6)发射火箭时胼(N2+H4)为燃料,二氧化氮作氧化剂,两者反应生成氮气和气态水。已知4gN2H4(g)在上述反应中放出71kJ的热量,写出该反应的转化学方程式
_______________________。
25.(8分)已知在25℃的水溶液中,AgX、AgY、AgZ均难溶于水,且Ksp(AgX)== 1.8×10-10,Ksp(AgY)== 1.0×10-12,Ksp(AgZ)== 8.7×10-17;
(1)根据以上信息,判断AgX、AgY、AgZ三者的溶解度(已被溶解的溶质的物质的量/1L溶液 表示)S(AgX)、S(AgY)、S(AgZ)的大小顺序为:
(2)若向AgY的饱和溶液中加入少量的AgX固体,则c(Y-)
(填“增大”、“减小”或“不变”)。
(3)在25℃时,若取0.188g的AgY(相对分子质量188)固体放入100mL水中(忽略溶液体积的变化),则溶液中Y-的物质的量浓度为
(4)由上述Ksp判断,在上述(3)的体系中,能否实现AgY向AgZ的转化,并简述理由:
中学2007年届化学每周试卷(3)
21、(每空1分,共4分)(1)Br2(1分);Fe3+(1分)(2)乙(1分)
|
| 选用试剂 | 实验现象 |
| 第一种方法 | C | 有机层无色 |
| 第二种方法 | D | 溶液变红 |
22、.(13分)(1)不可行 (1分)
溴水与乙醛发生取代反应和乙醛被溴水氧化都有HBr生成,溶液均呈酸性 (2分)
(2) a 0 2a (各1分) (3)③ (2分)
(4)BrO3—+5Br—+6H+==3Br2+3H2O CH3CHO+Br2+H2O→CH3COOH+2H++2Br—(各2分)
(5)溶液的紫色褪去 (1分)
23、(12分)(1) 第四周期第VIB族(2分)
(2) 2 Cr2O3 + 4 Na2CO3 + 3 O2 == 4 Na2CrO4 + 4 CO2↑(2分)
Al2O3 + Na2CO3 == 2NaAlO2 + CO2↑(1分)
(3)Na2CO3、Na2CrO4、NaAlO2 (1分)
(4)AlO2- + H+ + H2O == Al(OH)3(1分)CO32- + 2 H+ == CO2↑+ H2O(1分)
(5)2 Na2CrO4 + H2SO4 == Na2Cr2O7 + Na2SO4 + H2O (2分)
(6)加热、浓缩、冷却、结晶、过滤 (2分)
24、(10分).(1)N N(1分)(2)2NH3![]() NH
NH![]() +NH
+NH![]() (1分)
(1分)
(3)大于(1分);(NO![]() )> 4H
)> 4H![]() >(Na+)>(OH-)(2分)
(氢离子不写不扣分,排列错误0分)(4)C(1分)
>(Na+)>(OH-)(2分)
(氢离子不写不扣分,排列错误0分)(4)C(1分)
![]() (5)2NH3+NaClO N2H4+NaCl+H2O(2分) (水的化学式正确得1分,配平正确得1分,两者都正确得2分)
(5)2NH3+NaClO N2H4+NaCl+H2O(2分) (水的化学式正确得1分,配平正确得1分,两者都正确得2分)
![]() (6)N2H4(g)+NO2(g)
(6)N2H4(g)+NO2(g) ![]() N2(g)+2H2O(g);△H=-568KJ/mol(2分)
N2(g)+2H2O(g);△H=-568KJ/mol(2分)
25.(8分) (1)S(AgX)>S(AgY)>S(AgZ)(2分)
(2)减小(1分) (3)1.0×10-6mol·L-1(2分)
(4)能(1分) Ksp(AgY)=1.0×10-12>Ksp(AgZ)= 8.7×10-17(2分)