高三化学上学期第一次月考试卷
可能用到的相对厚子质量:H 1 C12 N14 O16 Na 23 Mg24 S 32 Cl 35.5 Fe 56 Cu64 Zn65 Br80 Ag 108 I 127 Pb 207
第一卷(选择题 共64分)
一、单项选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意)
1、下列有关共价化合物的说法中,一定正确的是
①具有较低的熔、沸点 ②不是电解质 ③固体时是分子晶体 ④都由分子构成 ⑤液态时不导电
A、①③④ B、②④⑤ C、①②③④⑤ D、只有⑤
2、 由下列各组的三种元素构成的化合物中,既有离子晶体,又有分子晶体的是
A、H、O、C B、Na、S、O C、H、N、O D、H、S、O
3、我国纳米专家发明的“WXP复合纳米材料”的主要化学成分是氨基二氯代戊二醛的含硅衍生物,它能保持长期杀菌作用,“WXP复合纳米材料”有望用于制造纸币。试推断以直链戊二醛(OHCCH2CH2CH2CHO)为母体的氨基二氯代戊二醛的可能结构有
A、6种 B、7种 C、8种 D、10种
4、下列离子中,最易结合质子的是
A、Cl- B、CH3CH2O - C、OH - D、C6H5O –
5、可以将反应Zn+Br2=ZnBr2设计成蓄电池,下列4个电极反应
①Br2+2e=2Br- ②2Br-—2e=Br2
③Zn-2e=Zn2+ ④Zn2++2e=Zn
其中表示充电时的阳极反应和放电时的负极反应的分别是
A.②和③ B.②和① C.③和① D.④和①
6、 将Mg、Cu组成的26.4g混合物投入到适量的稀硝酸中,固体完全溶解,收集到标准状况下的NO气体8.96L,向反应后的溶液中加入过量的4mol·L-1的NaOH溶液300mL,金属离子完全沉淀。则形成沉淀的质量是
A、43.2g B、46.8g C、53.6g D、63.8g
7、 反应NO+O2+NO2+H2O→HNO3是多组化学计量数的化学方程式,当氧气有![]() 被NO还原时,此方程式各物质的化学计量数依次为
被NO还原时,此方程式各物质的化学计量数依次为
A、4、9、24、14、28 B、1、1、1、1、2 C、8、9、12、10、20 D、任意比均可
8、 已知A2On2-可与B2-反应,B2-被氧化为B单质,A2On2-被还原为A3+,若100mL0.3mol·L-1的A2On2-溶液,与150mL0.6mol·L-1的B2-溶液恰好完全反应,则n的值为
A、5 B、6 C、7 D、8
二、不定项选择题(本题包括8小题,每小题4分,共32分。每小题有一个或二个符合题意。若正确答案只包括一个选项,多选时,该题为 0分;若正确的答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就为0分)
9、在pH为4~5的环境中,Cu2+、Fe2+不生成沉淀,而Fe3+几乎完全沉淀。工业上制CuCl2
是将浓盐酸用蒸汽加热到80℃左右,再慢慢加入粗氧化铜(含杂质FeO),充分搅拌使之溶解。欲除去溶液中的杂质离子,下述方法正确的是
A.加入纯Cu将Fe2+还原
B.向溶液中加入(NH4)2S使Fe2+沉淀
C.直接加水加热使杂质离子水解除去
D.在溶液中通入Cl2,再加入CuO粉末调节pH为4~5
10、有下列物质,正盐:钾盐、钠盐、铵盐、钡盐;酸:盐酸、硝酸、醋酸、稀硫酸。在水溶液中符合离子方程式:2H++SO32-=SO2↑+H2O的化学反应的组合共有
A、6个 B、7个 C、12个 D、15个
11、氯化铁溶液与Fe(OH)3胶体具有的共同性质是
A、 分散质粒子直径都在1nm~100nm
B、 能透过半透膜
C、 加热蒸干,灼烧后有氧化铁生成
D、呈红褐色
12、根据热化学方程式:S(s)+O2(g)=SO2(g);△H=-297.23kJ/mol。分析下列说法正确的是
A.S(g)+O2(g)=SO2(g);△H=-Q。Q的值不小于297.23
B.S(g)+O2(g)=SO2(g);△H=-Q。Q的值不大于297.23
C.1molSO2的总能量小于1molS和1molO2能量总和
D.1molSO2的总能量大于1molS和1molO2能量总和
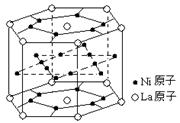 13、氢气是重要而洁净的能源,要利用氢气作能源,必须安全
13、氢气是重要而洁净的能源,要利用氢气作能源,必须安全
有效地储存氢气。有报道称某种合金材料有较大的储氢容
量,其晶体结构的最小单元如右图所示。则这种合金的化
学式为 ( )
A.LaNi6 B. LaNi3
C.LaNi4 D. LaNi5
14、下列反应的离子方程式书写正确的是
A.小苏打溶液与氢氧化钠溶液反应:HCO3-+OH-=CO32-+H2O
B.NaHSO4溶液与Ba(OH)2溶液混合后显酸性:Ba2++OH-+H++SO42-=BaSO4↓+H2O
C.氧化亚铁中滴加稀硝酸:FeO+2H+=Fe2++H2O
D.偏铝酸钠水解:AlO2-+2H2O![]() Al(OH)3↓+OH-
Al(OH)3↓+OH-
15、某无色溶液与NH4HCO3作用能产生气体,此溶液中可能大量共存的离子组是
A.Cl-、Mg2+、H+、Zn2+、SO![]() B.Na+、Ba2+、NO3-、OH
B.Na+、Ba2+、NO3-、OH![]() 、SO
、SO![]()
C.K+、NO![]() 、SO
、SO![]() 、OH-、Na+ D. MnO
、OH-、Na+ D. MnO![]() 、K+、Cl-、H+、SO
、K+、Cl-、H+、SO![]()
![]() 16、咖啡酸具有止血、镇咳、祛痰等疗效,其结构简式为 。下列有关咖啡酸的说法中,不正确的是
16、咖啡酸具有止血、镇咳、祛痰等疗效,其结构简式为 。下列有关咖啡酸的说法中,不正确的是
A.咖啡酸可以发生还原、取代、加聚等反应
B.咖啡酸与FeCl3溶液可以发生显色反应
C.1 mol咖啡酸可与4 mol H2发生加成反应
D.1 mol咖啡酸最多能消耗3 mol的NaHCO3
第二卷(非选择题 共86分)
三、(本题包括2小题,共18分)
17、(6分)⑴下列实验设计或操作合理的是_____________(填字母)。
a.中和热测定实验时,如果没有环形玻璃棒,可用环形铜质搅拌棒代替。
b.实验室制肥皂时,将适量植物油、乙醇和NaOH溶液混合,并不断搅拌、加热,直到混合物变稠,即可得到肥皂。
c.实验室制取乙烯时必须将温度计的水银球插入反应液中,测定反应液的温度。
d.向Na2CO3与NaOH的混合溶液中加入足量的CaCl2溶液,再滴加几滴酚酞试液,可检验NaOH的存在。
e.将10滴溴乙烷加入1mL10%的烧碱溶液中加热片刻后,再滴加2滴2%的硝酸银溶液,以检验水解生成的溴离子。
(2) 根据现有中学化学知识,判断下列有关实验描述正确的是 (填字母)。
A. 红砖中氧化铁成分检验用到的试剂是盐酸和硫氰化钾溶液
B. 用冰醋酸,蒸馏水和容量瓶等仪器配制pH为1的醋酸稀溶液
C. 中和滴定时,酸式滴定管用蒸馏水清洗3次后,即加入标准盐酸溶液进行滴定
D. 实验室用洁净的试管做银镜反应时不能将试管直接放在酒精灯火焰上加热
E.实验窜制备乙酸乙酯时吸收液为饱和碳酸钠溶液而不用饱和碳酸氢钠溶液
18、(12分)在测定硫酸铜结晶水的实验操作中:
⑴、加热前应将晶体放在 中研碎,加热是放在 中进行;加热失水后,应放在 中冷却。
⑵、判断是否完全失去结晶水定性实验是 。
⑶、做此实验,最少应进行称量操作 次。
(4)、下面是一位学生测定硫酸铜晶体中结晶水的质量分数的实验记录
| 坩埚质量 | 坩埚质量+硫酸铜晶体质量 | 坩埚质量+无水硫酸铜质量 |
| 15.0 g | 17.5 g | 16.6 g |
硫酸铜晶体的化学式是
四、(本题包括3小题,共30分)
19、(12分)(1)CuI是一种不溶于水的白色固体,它可以由反应:2Cu2+ + 4I– 2CuI↓+ I2而得到。现以石墨为阴极,以Cu为阳极电解KI溶液,通电前向电解液中加入少量酚酞和淀粉溶液。电解开始不久阴极区溶液呈红色,而阳极区溶液呈现蓝色,对这个现象解释正确的是:_____________(填序号)。
①阴极电极反应2H+ + 2e – H2↑,使c (OH – ) > c (H+)
②阳极2Cu + 4I – – 4e – 2CuI↓+ I2,I2遇淀粉变蓝
③阳极Cu – 2e – Cu2+,Cu2+ 显蓝色
④阳极2I – – 2e – I2,碘遇淀粉变蓝
(2)剪约6 cm长,2 cm宽的铜片和铝片各一片,分别用接线柱平行地固定在一块塑料板上(间隔2 cm),将铜片与铝片分别和电流表的“+”、“–”端相连结,电流表指针调到中间位置,取50 mL两只小烧杯,在一只烧杯中注入40 mL浓HNO3,另一只烧杯中注入40 mL稀硫酸,试回答下列问题:
①两电极同时插入稀H2SO4中,原电池的负极为______(填“铝”或“铜”)极,铝片上的电极反应式为:____________________________。电流表指针偏向________(填“铝”或“铜”)
②两电极同时插入浓HNO3中,原电池的负极为_________(填“铝”或“铜”)极,铝片上的电极反应式为:_____________________________。电流表指针偏向________(填“铝”或“铜”)
20、(8分)已知:氧化性:KMnO4>HNO3;Bi位于周期表中VA,+3价较稳定,NaBiO3溶液为无色。取一定量的Mn(NO3)2溶液依次进行下列实验,现象记录如下。
①滴加适量的NaBiO3溶液,溶液变为紫红色。
②继续滴加适量H2O2,紫红色褪去,并有气泡产生。
③再加入适量的PbO2固体,固体溶解,溶液又变为紫红色。
④最后通入足量的SO2气体,请回答下列问题:
(1)KMnO4、H2O2、PbO2氧化性由强到弱的顺序为________________;
(2)实验④中的现象为:_______________ ;
(3)实验②③反应的离子方程式分别是:______ _________________、___________________________ __。
21、(10分)已知反应:AgF+Cl2+H2O→AgCl+AgClO3+HF+O2(未配平),不必配平此方程式,判断:
(1)若Cl2的系数为a,则AgF的系数为 ,判断的依据是
。
(2)若AgClO3的系数为b,O2的系数为c,则AgCl的系数为 ,判断的依据
是 。
(3)在水溶液中N2H5+离子将Fe3+还原成Fe2+,发生如下反应:
N2H5++4Fe3+→4Fe2++Y+…,作为N2H5+的氧化产物Y可能是(填写化学式) 。
五、(本题包括2小题,共20分)
22、(8分)有机物X(![]() )广泛存在于水果中,尤以苹果、葡萄、西瓜、山楂内为多。
)广泛存在于水果中,尤以苹果、葡萄、西瓜、山楂内为多。
(1)在一定条件下有机物X可发生化学反应的类型有(填序号)_____。
A.水解反应 B.取代反应 C.加成反应 D.消去反应 E.加聚反应 F.中和反应
(2)写出X与金属钠发生反应的化学方程式: 。
(3)与X互为同分异构体的是(填序号)_ __________。
a.![]() b.
b.![]()
c.![]() d.H3COOC—COOCH3
d.H3COOC—COOCH3
e.![]() f.
f.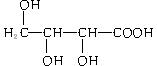
(4)写出X与O2在铜作催化剂加热的条件下发生反应所得到的可能产物的结构简式
。
23、(12分)有一种广泛用于汽车、家电产品上的高分子涂料,是按下列流程图生产的,图中M(C3H4O)和A都可以发生银镜反应,N和M的分子中碳原子数相等。A的烃基上的一氯取代位置有三种。
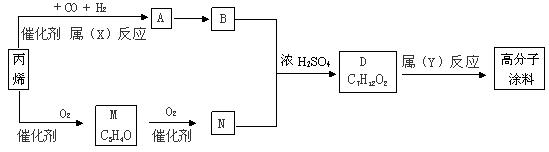 试写出:
试写出:
(1)物质的结构简式,A: ,M: ,物质A的同类别的同分异构体为: ;
(2)N+B®D的化学方程式为: ;
(3)反应类型:X ,Y: 。
六、(本题包括2小题,共18分)
24、(8分) 治理硝酸工业中的尾气中的氮氧化物(NO、NO2)的化学原理为:
2NO2+2NaOH=NaNO3+NaNO2+H2O; NO2+NO+2NaOH=2NaNO2+H2O。
现有标准状况下的a LNO2(其中N2O4的体积分数为20%)、b LNO的混合气体,恰好被200mL一定浓度的NaOH溶液完全吸收。
⑴根据上述条件可知,a∶b的值应在 范围中;
⑵设生成的NaNO3的物质的量为n1,NaNO2的物质的量为n2
①当产物全部为NaNO2时,求n2的值;
②当产物中兼有NaNO3和NaNO2时,求n1和n2的值;
③求上述NaOH溶液的物质的量浓度。
25、(10分)将15.68L(标准状况)的氯气通入70℃500mL4.0 mo1.L-1氢氧化钠溶液中,充分反应后,吸取此溶液25mL稀释到250mL。再吸取此稀释液25mL,用醋酸酸化后,加入过量碘化钾溶液充分反应。用浓度为0.20 mo1.L-1的硫代硫酸钠溶液滴定析出的碘,消耗了硫代硫酸钠溶液5.0mL时恰好到终点。将滴定后的溶液用盐酸调至强酸性,此时析出的碘用上述硫代硫酸钠溶液再滴定到终点,需要硫代硫酸钠溶液30mL。
已知:I2+2Na2S2O3==Na2S4O6+2NaI
(1)写出氯气通入氢氧化钠溶液后的总反应方程式。
(2)氢氧化钠溶液的体积在通入氯气前后的变化可忽略不计,计算通入氯气反应后溶液中各物质的物质的量浓度(稀释前)。
 高三化学第一次月考答题纸
高三化学第一次月考答题纸
 | ||||
 | ||||
选择题
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | ||||||||
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 |
|
|
|
|
 | |||
| |||
参考答案
一、二选择题
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | D | C | C | B | A | B | A | C |
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 | D | A | C | AC | D | A | AC | D |
17、 ⑴c d(3分) (2)ADE (3分)
18、(1)研钵;瓷坩埚;干燥器。(2)粉末蓝色最终变为白色。
(3)4。 (4)CuSO4·5H2O (每空2分)
19、(1)①② (4分)
(2)①Al作负极, Al – 3e – Al3+。铜
②铜作负极, 2NO3 – + 2e
– + 4H + 2NO2↑+ 2H2O。Al (8分)
20、⑴PbO2>KMnO4>H2O2 ⑵紫红色褪去,生成白色沉淀
⑶②2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H
③5PbO2+2Mn2++4H+=5Pb2++2MnO4-+2H2O(每空2分)
21、(1)2a;质量守恒 (2)5b+4c;得失电子数相等 (3)N2(每空2分)
22、(1)BDF
(2)![]()
![]() +3H2↑
+3H2↑
(3) bc (4)![]() (每空2分)
(每空2分)
23、(1)CH3CH2CH2CHO CH2=CHCHO CH3CH(CH3)CHO
(2)CH2=CHCOOH+CH3CH2CH2CH2OH→CH2=CHCOO CH2CH2CH2 CH3 +H2O
(3)加成反应 加聚(每空2分)
24、(8分,每小题2分)⑴ a∶b≥5∶6
⑵ ①n2=![]()
② n1=![]() n2=
n2=![]() ③
③ ![]()
25、7C12+14NaOH==NaClO+2NaClO3+11NaCl+7H2O((2分)
c(NaClO)=0.2mol·L-1;c(NaClO3)=0.4mol·L-1;c(NaOH)=1.2 mol·L-1;c(NaCl)=2.2 mol·L-1
(每个2分)