高三化学上学期第一次月考试题
相对原子质量:H-1 C-12 O-16 N-14 Na-23 Cl-35.5 K-39 S-32 Ar-40 F-19
第Ⅰ卷(选择题,共45分)
一、选择题(本题包括15小题,每小题3分,共45分。每小题只有1个正确选项符合题意。)
1、下列变化属于物理变化的是 ( )
A.O2在放电条件下变成O3 B.加热胆矾成无水硫酸铜
C.漂白的草帽久置于空气中变黄 D.氢氧化铁胶体加入MgSO4溶液产生沉淀
2、下列化合物中都属于弱电解质的一组是 ( )
A .CuSO4、NaCl、HNO3、K2SO4 B.H2CO3、CH3COOH、HClO、苯酚
C.K2S、BaSO4、AgCl、NaOH D.H2O、H3PO4、NH3·H2O、HBr
3、设NA为阿伏加德罗常数,下列说法正确的是 ( B )
A.标准状况下,22.4L乙醇完全燃烧后生成CO2的分子数为2NA
B.18g水中含有的电子数为10NA
C.在1L2mol/L的硫酸铵溶液中含有的NH4+离子数为4NA
D.1mol甲基(-CH3)中含有10NA个电子
4、1g炭与适量的水蒸气反应生成CO和氢气,需要吸收10.9KJ的热量,则下列热化学方程式正确的是: ( )
A.C+H2O=CO+H2;△H=+131.2KJ/mol
B.CO(g)+H2(g)=C(s)+H2O(g);△H= —131.2KJ/mol
C.C(s)+H2O(g)=CO(g)+H2(g);△H=+10.9KJ/mol
D.C(s)+H2O(g)=CO(g)+H2(g);△H= —131.2KJ/mol
5、下列离子组在pH=0的溶液里能大量共存的是
A.Na+、Fe2+、Cl—、NO3— B.K+、Al3+、HCO3—、SO42—
C.NH4十、Mg2十、Br—、SO42— D.K十、Na+、S2—、SO3 2一.
6、下列反应的离子方程式正确的是
A.钠与水反应: Na+2H2O==Na++H2↑+2OH-
B.氯气与石灰水反应:Cl2+2OH-==Cl-+ ClO-+ H2O
C.铁与足量稀硝酸反应:3Fe+8H++2NO3-==3Fe2++2NO↑+4H2O
D.铝与氢氧化钠溶液反应:Al+2OH-==AlO2-+H2↑
7、四种主族元素的离子aXm+、bYn+、cZn-、dRm-(a、b、c、d为元素的原子序数),
它们具有相同的电子层结构,若m>n,则下列叙述正确的是
A、a-b=n-m B、原子序数:a>b>c>d
C、元素非金属性:Z<R D、最高价氧化物对应水化物的碱性:X>Y
8、下列实验操作中,错误的是( )
A.配制5%食盐溶液时,将称量的食盐放入烧杯中加计量的水搅拌溶解
B.硫酸铜结晶水含量测定时,需用小火缓慢加热,防止晶体飞溅
C.测定未知NaOH溶液浓度时,酸式滴定管需用标准酸液润洗2~3次
D.配制0.1mol/L的H2SO4溶液时,将量取的浓H2SO4放入容量瓶中加水稀释
9、X、Y、Z均为短周期元素。已知X元素的某种原子核内无中子,Y元素的原子核外最外层电子数是其次外层电子数的2倍,Z元素是地壳中含量最丰富的元素。有下列含该三种元素的化学式:①X2Y2Z2 ②X2YZ3 ③X2YZ2 ④X2Y2Z4 ⑤X3YZ4 ⑥XYZ3,其中可能存在对应分子的是
A.② B.②④ C②⑤⑥ D.①②③④
10、已知35%NaOH溶液的密度为1.38g·cm-3,5%NaOH溶液的密度为1.05g·cm-3,若将上述两种溶液等体积混合,所得NaOH溶液的质量分数是 ( A )
A.大于20% B.等于20% C.小于20% D.无法确定
11、同温同压下,等体积的两容器内分别充满由14N、13C、18O三种原子构成的一氧化氮和一氧化碳。下列说法正确的是 ( A )
A.含有相同数目的中子、原子和分子 B. 含有相同的分子数和电子数
C. 含有相同的质子数和中子数 D. 所含分子数和质量均不相同
12、已知:t℃时,某物质的不饱和溶液ag中含溶质mg。若溶液蒸发bg水并恢复到t℃时,析出溶质m1g;若原溶液蒸发cg水并恢复到t℃时,则析出溶质m2g。若用S表示该物质在t℃时的溶解度,下式中正确的是C

13、下列说法正确的是 ( )
A、离子半径:Ca+<S2-,原子半径:Na>Cl
B、从上到下,卤素的非金属性逐渐减弱,故氢卤酸的酸性依次减弱
C、因为氧化性:HClO>稀H2SO4,所以非金属性:Cl>S
D、钠在反应中失去的电子比铝少,故钠的金属性小于铝的金属性
14、已知反应:①2K2CrO4+H2SO4=K2Cr2O7+K2SO4+H2O,②K2Cr2O7+6FeSO4+7H2SO4=
3Fe2(SO4)3+Cr2(SO4)3+K2SO4+7H2O,③Fe2(SO4)3+2HI=2FeSO4+I2+H2SO4。下列结论正确的是 ( )
A.①②③均是氧化还原反应
B.氧化性强弱顺序是:K2Cr2O7>Fe2(SO4)3>I2
C.反应②中氧化剂与还原剂的物质的量之比为6∶1
D.反应③中0.1mol还原剂共失去电子数为1.2×1022
15、在一定条件下,硫酸铵的分解反应为:4(NH4)2SO4=N2↑+6NH3↑+3SO2↑+SO3↑+7H2O,
当有nmol电子转移时,下列说法不正确的是 ( )
A.有![]() (NH4)2SO4分解 B.有
(NH4)2SO4分解 B.有![]() 原子被还原
原子被还原
C.生成![]() 氧化产物 D.生成7nmolH2O
氧化产物 D.生成7nmolH2O
化 学 试 题(答题卷)
第Ⅰ卷(选择题,共45分)
请将1至15题的答案写在下面对应的方框内。
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
第Ⅱ卷(非选择题,共55分)
二、填空题
16、(10分)下面所列的是中学化学实验室中几种常见的玻璃仪器:
①温度计 ②容量瓶 ③滴定管 ④烧杯 ⑤圆底烧瓶 ⑥量筒 ⑦玻璃棒
(1)在仪器上具体标明使用温度的是(不考虑温度计) (填写编号);可作反
应容器并可加热的是 (填写编号)
(2)需要用到温度计的实验是 (填写编号)
①用乙醇制取乙烯 ②石油分馏 ③浓硫酸稀释 ④测定硝酸钾的溶解度
(3)玻璃棒是化学实验中常用的仪器,其作用是用于搅拌、过滤或转移液体时引流。下列有关实验过程中,肯定不需要使用玻璃棒进行操作的是(填字母代号)_________________。
A. 一定溶质质量分数溶液的配制
B. 用适量的蔗糖、浓硫酸和水在小烧杯中进行浓硫酸的脱水性实验
C. 用普通漏斗组成的过滤装置进行过滤实验
D.用浓氨水和浓盐酸进行氨和氯化氢反应的实验
E. 用已知浓度的盐酸和未知浓度的氢氧化钠溶液进行中和滴定实验
F. 硫酸铜晶体里结晶水含量测定的实验
G.将适量氯化铁饱和溶液滴入沸水中制氢氧化铁胶体
(4)下列基本实验操作不正确的是 。(填写下列选项的序号)
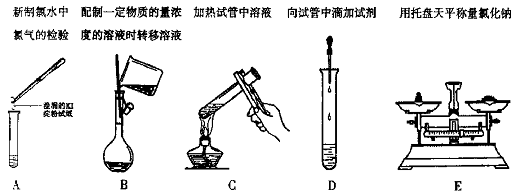
17、(10分)有A、B、C、D、E五种化合物,他们分别有Na+、Ba2+、Cu2+、Al3+、Cl—、 SO42—和OH—等七种离子中的两种组成。
(1)白色固体A既不溶于水,也不溶于稀硝酸。
(2)白色固体B不溶于水,但加入焰色反应为黄色的E溶液时,B溶解且生成无色的溶液。
(3)C与E具有相同的阴离子,C与稀硫酸反应可以生成A。
(4)D是一种棕黄色固体,溶解于水后形成绿色的溶液。D溶液与E溶液反应可以得到蓝色的沉淀。
请根据上述现象书写出A、B、C、D、E的化学式。
A B C D E
18、(15分)A、B、C、D、E、F均为短周期元素,原子序数依次增大。A元素原子核内无中子。B元素原子核外最外层电子数是次外层电子数的2倍。C元素是地壳里含量最多的元素。D是短周期元素中金属性最强的元素。E与D元素的质子数之和为27,最外层电子数之差为5。F元素的最高价氧化物的水化物为强酸。
(1)推断B元素在周期表中的位置:第 周期, 族。
(2)画出F元素的原子结构示意图: 。
(3)C、D元素可形成淡黄色的粉末,其电子式为: 。
(4)写出A与C元素形成10电子的微粒: 、 、 。
(5)D、E元素形成的正盐的水溶液中,阴离子的浓度大小顺序为:(从大到小排列)
。
(6)常温下,1molA元素的单质与C元素的单质化合,放出286kJ的热量。写出反应的热化学方程式 。
19、.(10分)A、B、C、D、E都是短周期元素,原子序数依次增大,B、C同周期,A、D同主族。A、B能形成两种液态化合物甲和乙,原子个数比分别为2∶1和1∶1。E的单质既能与强酸反应,也能与强碱反应。根据以上信息回答下列问题:
(1)甲、乙两分子中含有非极性共价键的物质的结构式是______________________,C元素在周期表中的位置是__________________。
(2)C和D的离子中,半径较小的是__________(填离子符号)。
(3)将D的单质投入甲中,待D消失后再向上述溶液中加入E的单质,此时发生反应的化学方程式是____________________________________________________。
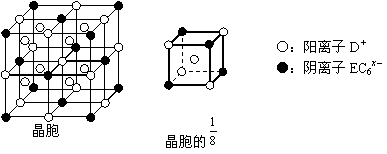 (4)C、D、E可组成离子化合物DxEC6,其晶胞结构如右图所示,阳离子D+位于正方体的棱的中点和正方体内部;阴离子EC6x-位于该正方体的顶点和面心。该化合物的化学式是____________。
(4)C、D、E可组成离子化合物DxEC6,其晶胞结构如右图所示,阳离子D+位于正方体的棱的中点和正方体内部;阴离子EC6x-位于该正方体的顶点和面心。该化合物的化学式是____________。
三、计算题(10分)
20、 16.8g某单质A能从一定量盐酸中置换出0.6gH2,同时生成ACl2;另一种元素B,它的最高价氧化物的化学式BO3。在B的氢化物中,B的质量分数为94.1%。
(1) 计算A、B两种元素的相对原子质量,写出相应的元素符号。
(2) 写出A、B反应的化学方程式,标出反应中电子转移的情况,指出氧化剂和还原剂。
化 学 试 题
答案
第Ⅰ卷(选择题,共45分)
一、选择题
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| 答案 | D | B | B | B | C | B | B | D | D | A | A | C | A | B | D |
第Ⅱ卷(非选择题,共55分)
二、填空题
16、(1)②③⑥;④⑤ (2)①②④ (3) EG (2) B C D E
17、BaSO4 Al(OH)3 Ba(OH)2 CuCl2 NaOH
18、(1) 二 IVA (2)氯原子结构示意图
(3)过氧化钠的电子式 (4)H2O、H3O+、OH-
(5)c(S2-)>c(OH-)>c(HS-)
(6)H2(g)+1/2O2= H2O (l);△H=-286kJ/mol
19、(1)H-O-O-H 第二周期、第ⅦA族
(2)Na+
(3)2Al+2NaOH+2H2O=2NaAlO2+3H2↑
(4)Na3AlF6
20、(1)A、B分别为F、S,相对原子质量为56、32
(2) F e + S = FeS(转移电子2e-)
还原剂 氧化剂