高三化学上册第二次阶段考试
相对原子质量:H:1; He:4; C:12;N:14; O:16; F:19; Na:23; S:32;
K:39; Fe:56; Cu:64; Cl:35.5; Li:7; Mg:24; Ag:108; Mn:55
第I卷(共64分)
一、单项选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意)
1.简单原子的原子结构可用右下图表示方法形象表示:其中●表示质子或电子,○表示中子,则下列有关①②③的叙述正确的是
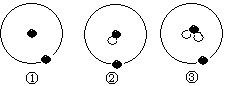 A.①②③互为同位素
A.①②③互为同位素
B.①②③互为同素异形体
C.①②③是三种化学性质不相同的粒子
D.①②③具有相同的质量数
 2.下列化学用语表达正确的是
2.下列化学用语表达正确的是
A.S2—的结构示意图: B.乙炔的结构简式CHCH
![]()
![]() C.NaCl的电子式 :
D.硝基苯的结构简式:
C.NaCl的电子式 :
D.硝基苯的结构简式:
3.有反应M2O7n-+S2-+H+→M3++S↓+H2O,其中氧化剂与还原剂的物质的量之比为1∶3,
则M2O7n-中M的化合价是
A.+2 B.+4 C.+6 D.+7
4.下列各组离子中,在强酸性溶液里能大量共存,且溶液为无色透明的是
A.Na+、NH![]() 、I-、NO
、I-、NO![]() B.K+、Cu2+、Cl-、SO
B.K+、Cu2+、Cl-、SO![]()
C.Ag+、H+、NO![]() 、F-
D.Al3+、NH
、F-
D.Al3+、NH![]() 、Cl-、SO
、Cl-、SO![]()
5.下列有关说法正确的是
A.CaCl2、聚苯乙烯、HD均为化合物
B.CH2O2、C3H6O2、C4H8O2互为同系物
C.明矾、冰醋酸、硫酸钡均为电解质
D.SiO2、NaCl、S8、Cu均能表示物质分子组成
6.进行下列实验肯定不能获得成功的是
A.用pH试纸鉴别浓硫酸与浓硝酸
B.用硝酸银溶液区分二氧化氮和溴蒸气
C.用酸性高锰酸钾溶液除去二氧化碳中混有的少量二氧化硫
D.用溴水除去苯中溶有的少量苯酚
7.下列说法中错误的是
A.将SO2和Cl2分别通入石蕊试液后,石蕊试液都是先变红后褪色
B.向溴水和碘水中分别加入少量CCl4后,下层的颜色都比上层深
C.铜丝和铁丝分别在氯气中燃烧时,都产生棕黄色的烟
D.硫酸和硝酸分别溶解铁锈时,都会有黄色溶液出现
8.在一密闭容器中有CO、H2、O2共16.5g,用电火花引燃,使其完全燃烧,再将燃烧后的气体用Na2O2充分吸收,Na2O2增重7.5g,则原混合气体中O2的质量分数是
A.36% B.54.5% C.40% D.33.3%
二、不定项选择题(本题包括8小题,每小题4分,共32分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给满分,但只要选错一个该小题就为0分。)
9.青石棉(cricidolite)是一种致癌物质,是《鹿特丹公约》中受限制的46种化学品之一,其化学式为:Na2Fe5Si8O22(OH)2。青石棉用稀硝酸溶液处理时,还原产物只有NO,下列说法不正确的是
A.青石棉可能是一种硅酸盐
B.青石棉中含有一定量的石英晶体
C.青石棉能和18molHNO3反应
D.青石棉的化学组成可表示为:Na2O·3FeO·Fe2O3·8SiO2·H2O
10.向NaBr、NaI、Na2SO3混合液中,通入一定量氯气后,将溶液蒸干并充分灼烧,得到固体剩余物质的组成可能是
A.NaCl、Na2SO4 B.NaCl、NaBr、Na2SO4
C.NaCl、Na2SO3 D.NaCl、NaI、Na2SO4
11.现有t℃时质量分数为a %的KNO3溶液m g,将其分成质量比为1∶2的甲、乙两份溶液。甲溶液蒸发5 g水,恢复到原温度时析出晶体2 g;乙溶液蒸发12 g水,恢复到原温度时析出晶体5 g。则t℃时,KNO3溶解度为
A.41.7 g B.50 g C.40 g D.60 g
12.下列离子反应方程式正确的是
A.KHCO3的水解:HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
B.碳酸钡中加入稀硫酸:BaCO3+2H+=Ba2++CO2↑+H2O
C.将少量铁粉加入到过量的稀硝酸中:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O
D.碳酸氢钙溶液中加入足量石灰水:Ca2++HCO3—+OH-= CaCO3↓+H2O
13.NA代表阿伏加德罗常数的值,下列说法正确的是
A.4 g重水(D2O)中所含质子数为0.2NA
B.在通常状况下,22.4 LH2和4 gHe均含有NA个分子
C.8.0 g Cu2S和CuO的混合物中约含有铜原子数为0.1NA
D.常温常压下,0.1mol铁与0.1molCl2充分反应,转移的电子数约为0.3NA
14.2004年4月30号出版的《Science》杂志报道了中国科学家郑兰荪院士首次成功合成新型稳定小富勒烯C50Cl10,外侧有10个氯原子,其形状酷似太空船。有关C50Cl10的说法正确的是
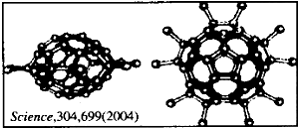
A.C50Cl10摩尔质量为955 g/mol B.C50Cl10晶体是原子晶体
C.C50Cl10分子中含有25个碳碳双键 D.C50Cl10分子中共用电子对数目为105个15.下列物质的制备,符合工业生产实际的是
A.将氯气通入澄清石灰水中制漂白粉
B.用离子交换膜法电解饱和食盐水制备烧碱、氢气和氯气
C.将氢气和氯气混合后点燃,产物用水吸收制备盐酸
D.将SO2和O2的混合气加高压后,通过接触室,制备SO3
16.将2.4 g Fe 、Mg合金投入到一定量的稀硝酸中,金属与硝酸恰好完全反应,共收集到标准状况下的气体V L(硝酸被还原成NO),若向反应后的溶液中加入足量的NaOH溶液,待金属元素全部沉淀后,再将沉淀过滤、洗涤、灼烧后称量,质量为3.6 g。则收集到的气体体积V值可为
A.0.986 B.1.12 C.3.36 D.6.72
第II卷(共86分)
三、(本题包括2小题,共18分)
17.(6分)⑴可以验证镁、铝的金属性强弱的实验是 。
(a)将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b)将这两种元素的单质粉末分别和同浓度的盐酸反应
(c)将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
(d)比较这两种元素的气态氢化物的稳定性
(2)现有MgCl2溶液、AlCl3溶液、NaOH溶液、氨水、盐酸等几种物质,试设计实验方案证明镁、铝的金属性强弱。
18.(12分)(1) 下列有关实验操作或判断不正确的是 _________(填有关序号,选错倒扣分)。
A.用10 mL量筒量取稀硫酸溶液 8.0 mL
B.用干燥的pH试纸测定氯水的pH
C.用碱式滴定管量取KMnO4溶液 19.60 mL
D.使用容量瓶配制溶液时,俯视液面定容后所得溶液的浓度偏大
E.圆底烧瓶、锥形瓶、蒸发皿加热时都应垫在石棉网上
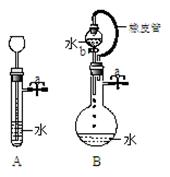 (2)根据右图描述回答下列问题:
(2)根据右图描述回答下列问题:
①关闭图A装置中的止水夹a后,从长颈漏斗向试管
中注入一定量的水,静置后如图所示。试判断:A装置是否漏气? (填“漏气”、“不漏气”或“不能确定”)
②关闭图B装置中的止水夹a后,开启活塞b,水不断
往下滴,直至全部流入烧瓶。试判断:B装置是否漏气?
 (填“漏气”、“不漏气”或“不能确定”)。
(填“漏气”、“不漏气”或“不能确定”)。
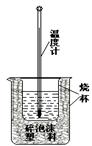
(3)实验室利用如右图装置进行中和热的测定。
回答下列问题:
①该图中有两处未画出,它们是 、
;
②在操作正确的前提下提高中和热测定的准确性的关键是 ;
③如果用0.5mol/L的盐酸和氢氧化钠固体进行实验,则实验中所测出的“中和热”
将 (填“偏大”、“偏小”或“不变”);原因是 。
四、(本题包括4小题,共50分)
19.(8分)称取等质量(均为ag)胆矾两份。把一份溶于bg水中,测知其溶解时吸收Q1kJ热量;把另一份脱水后溶于bg水中,测得其溶解时放热Q2kJ。
(1)胆矾的溶解热为______kJ·mol—1;
(2)无水硫酸铜的溶解热为______kJ·mol—1;
(3)从以上数据可知,胆矾脱水是______过程,1mol胆矾脱水需______kJ·mol—1热量。
20.(12分)已知A、B、C、D的组成元素都属于短周期,其中A、D为单质,B、C为化合物,它们之间的简单转化关系如图所示。请按要求写出有关反应式,是离子反应的只写离子方程式:
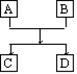 (1)若A、D的组成元素同主族:
(1)若A、D的组成元素同主族:
①B是水:__________________________________________。
②B、C均为氧化物(反应有重要的工业价值):
____________________________________________,工业价值是:_________________。
(2)若A、D的组成元素不同主族:
①B是水且水是还原剂:__________________________________________;
B是水且水是氧化剂(反应有重要的工业价值):
____________________________________________,工业价值是:_________________。
②B、C均为氧化物:____________________________________________。
21.Ⅰ.(10分)下表是元素周期表的前三周期,用相应的化学用语回答下列问题:
| a | b | c | d | e | |||
| f | g |
(1)g的单质能与f元素的最高价氧化物对应的水化物的溶液反应,请写出该反应的离子方程式 。
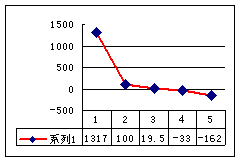
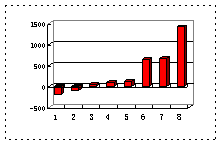
(2)第三周期8种元素按单质熔点(℃)大小顺序的柱形图(上左图),其中序列“2”代表 ,“8”代表 。
(3)a、b、c、d、e的氢化物的沸点直角坐标图(上右图),序列“5”氢化物的化学式为 ,序列“1”的氢化物的电子式: 。
Ⅱ.(10分)已知氨分子内键与键的夹角约为107º18’。从反应NH3 +H+→NH4+可知:NH4+中有一根键比较特殊,其结构可表示为A式。但是,虽然有一根键形成过程与众不同,而其结果是完全相同的,都是N、H原子间共用一对电子,键与键的夹角均为109º28’。故NH4+的结构也可表示为B式。
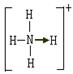
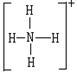
A式 B式
(1)还有一些你熟悉的分子或离子中,也存在上述特殊共价键,如: 等。
(在下列微粒中选择填空:[Ag(NH3)2]+,PCl5,Fe(SCN)3,NH3·H2O ,H3O+)
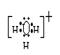
(2)写出H3O+的电子式 ;
你认为H3O+中键与键的夹角与下列哪个角度最接近?
A.120º B.109º28’ C.107º18’ D.60º
(3)氮化硼(BN)是一种新型无机非金属材料,它有两种晶型:金刚石晶型和石墨晶型。其中,金刚石晶型的氮化硼材料具有硬度大、熔点高等特性,它的结构中也含有上述特殊共价键。则:在金刚石晶型的氮化硼中,每个硼原子与 个氮原子以B─N键连接,原子间相互连接的最小的环上有 个氮原子和 个硼原子。
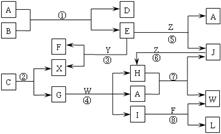
22.(10分)下图表示各物质之间的转化关系。已知:
Ⅰ.A是无色液体,L是不溶于稀硝酸的白色沉淀,E、F、H、J、X、Y、Z是气体;
Ⅱ.G、X、Y、Z是单质,其它是化合物,其中Y呈黄绿色、H呈红棕色,E和F都极易溶解于水,二者相遇会有白烟生成;
|
请按要求填空:
(1)写出下列物质的化学式:B___________,C___________;
(2)上述反应中属于置换反应的是_________;不属于氧化还原反应的是__________;(填写反应代号)
(3)反应④的离子方程式为:_____________________________________________。
五、(本题包括2小题,共18分)
23.(8分)将一定量的氯酸钾与3.48g二氧化锰组成的混合物加热一段时间后共收集到氧气0.336L(标准状况),然后将残留固体加入到足量浓盐酸中共热,使之与浓盐酸充分反应,再将生成的气体全部通入到100ml 1mol/L的溴化亚铁溶液中,有一半的溴离子被氧化成单质。求氯酸钾的分解率。
24.(10分)将Na2O2和NaHCO3固体混合物置于密闭容器中加充分反应,放出气体后冷却。加热时可能发生的反应如下:
2 Na2O2+2NaHCO3![]() 2NaOH+2Na2CO3+O2↑
2NaOH+2Na2CO3+O2↑
2 Na2O2+4NaHCO3![]() 4Na2CO3+O2↑+2H2O
4Na2CO3+O2↑+2H2O
2NaHCO3![]() Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
(1)若固体混合物的质量为m,反应后冷却再称其质量减少了△m。设NaHCO3、Na2O2的物质的量分别为a,b,试确定下列条件下△m的取值范围(用含m的代数式表示)。
①当a/b≤1时,△m取值范围是
②当1<a/b≤2时,△m取值范围是
③当a/b>2时,△m取值范围是
(2)若m=14.52g,△m=1.28g时,向反应后的残留固体内滴加2.00mol/L盐酸140.0mL,可产生标准状况下的气体 L。
![]()
![]() 化学试题答题卷
化学试题答题卷
第I卷(共64分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | ||||||||
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 |
第II卷(共86分)
三、(包括17、18两小题,共18分)
17、(6′)(1)
(2)
18、(12′) (1)
(2)① ,②
(3)① 、
②
③
四、(包括19-22四小题,共50分)
19、(8′)(1) 、(2)
(3) 、
![]() 20、(12′) (1) ①
20、(12′) (1) ①
② ,
(2)①
② ,
(3) 。
21、Ⅰ.(10′)(1)
(2) 、
(3) 、
Ⅱ.(10′)(1)
(2) 、
(3) 、 、
22、(6′) (1) B___________,C___________;
(2) 、
(3)反应④的离子方程式为:_____________________________________________。
六、(包括23、24两小题,共18分)
23、(8′)
24、(10′)
第I卷(共64分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | A | D | C | D | C | D | A | B |
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 | B | AB | B | D | C | AD | B | AB |
第II卷(共86分)
17.(1)bc (3分)
(2)分别取适量MgCl2溶液、AlCl3溶液于两支试管中,分别向两支试管中加入适量NaOH溶液或氨水,将所得沉淀分别等分为两份,分别向一份Mg(OH)2、Al(OH)3中加入适量NaOH溶液,Mg(OH)2不溶解,Al(OH)3溶解;再分别向另一份Mg(OH)2、Al(OH)3中加入适量盐酸,全部溶解,说明Mg的金属性比Al强。(3分)
18.(1)BCE
⑵ ①不漏气②不能确定
(3)① 环形玻璃棒 烧杯上方的泡沫塑料盖或硬纸板
② 提高装置的保温效果
③偏大 固体NaOH溶于水放热
19.答案: (1)250Q1/a (2)-250Q2/a (3)吸热 250(Q1+Q2)/a
20.(12分)(1)①2Na+2H2O=2Na++2OH-+H2↑(2分)(写化学方程式得1分)
②2C+SiO2![]() Si+2CO↑(2分),生产粗硅(1分),
Si+2CO↑(2分),生产粗硅(1分),
⑵①2F2+2H2O=4HF+O2(2分),C+H2O![]() CO+H2(2分),生产水煤气(1分),
CO+H2(2分),生产水煤气(1分),
②2Mg+CO2![]() 2MgO+C(2分)
2MgO+C(2分)
21.(1)2OH—+2Al+2H2O=2AlO2—+3H2↑
(2)Cl2 Si ⑶ CH4 Li+[∶H]— (每空2分,共10分)
Ⅱ:[Ag(NH3)2]+, Fe(SCN)3 H3O+
C 4 ,3, 3
22.(1)Mg3N2 AgN3 (2)③ ①⑧
(3)Ag+2H++NO3-(浓)=Ag++NO2↑+H2O (每空2分,共10分)
23.(8分) 33.33%
24.(1) ①△m≤8m/81②8m/81<△m≤17m/123③17m/123<△m<31m/84(每空2分,共6分)
(2)2.016L(4分)