高三化学上学期11月月考试卷
班级 姓名 座号
一.选择题(每小题只有一个选项符合题意,每小题3分,本题60分)
1.据报道,科学家用激光将置于铁室中石墨靶上的碳炸松,与此同时用射频电火花喷射氮气,此时碳、氮原子结合成碳氮化合物薄膜.这种化合物比金刚石更坚硬,其原因可能是( )
A.该化合物为离子晶体 B.碳氮键比金刚石中碳碳键更短
C.碳氮的单质化学性质均不活泼 D.氮原子最外层电子数比碳原子多
2.关于电解NaCl水溶液,下列叙述正确的是( )
A.电解时在阳极得到氯气,在阴极得到金属钠
B.若在阳极附近的溶液中滴入KI溶液,溶液呈棕色
C.若在阴极附近的溶液中滴入酚酞试液,溶液呈无色
D.电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液呈中性
3.Na3N是离子化合物,它和水作用可产生NH3,下列说法正确的是( )
A.Na+和N3-的电子层结构都与氖原子相同 B.Na+的半径大于N3-的半径
C.Na3N与盐酸反应可生成两种盐 D.Na3N和水反应时,Na3N是还原剂
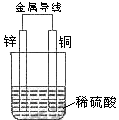
4. 关于如右图所示装置的叙述,正确的是( )
A 铜是阳极,铜片上有气泡产生
B 铜片质量逐渐减少
C 电流从锌片经导线流向铜片
D 氢离子在铜片表面被还原
5.已知在酸性溶液中,下列物质氧化Fe2+时,自身发生如下变化HNO3→NO;Br2→2Br-;ClO-→Cl-;MnO4-→Mn2+ 如果分别用等物质的量的这些物质氧化足量的FeCl2溶液,得到Fe3+最多的( )
A.HNO3 B.Br2 C.ClO- D.MnO4-
6. 下列离子方程式正确的是( )
A.醋酸铵和盐酸反应CH3COONH4+H+ CH3COOH+NH4+
B.氢氧化钡与碳酸氢镁反应Ba2++OH-+HCO3- BaCO3↓+H2O
C.偏铝酸钠和过量盐酸AlO2-+4H+ Al3++2H2O
D.钠跟水反应Na+2H2O Na++2OH-+H2↑
7.下列实验操作会导致实验结果偏低的是( )
(1)配制100 g 10%的CuSO4溶液,称取10g CuSO4晶体溶于90 g水中
(2)测定CuSO4晶体中结晶水的百分含量时,所用的晶体已经受潮.
(3)配制一定物质的量的浓度的H2SO4溶液,定容时仰视容量瓶的刻度线.
(4)用98%的浓H2SO4配制1∶5稀H2SO4时,把14 g98%的浓H2SO4溶于54 g水中
A.只有(1) B.只有(2) C.(2)(3)(4) D.(1)(3)(4)
8.下列说法中正确的是(NA表示阿伏加德罗常数)( )
A.28 g氮气含有的原子数目为NA
B.4 g金属钙变成钙离子时失去的电子数目为0.1NA
C.1 mol甲烷的质量与NA个甲烷分子的质量之和相等
D.22.4 L甲烷与乙炔的混合物所含分子数为NA
9.某物质经分析知其中仅含一种元素,此物质是( )
A.一定是一种单质 B.一定是一种纯净物
C.一定是混合物 D.可能是纯净物也可能是混合物
10.下列在指定溶液中的各组离子,能够大量共存是( )
A.无色溶液中:HCO![]() 、Na+、Cl-、OH-
、Na+、Cl-、OH-
B.pH=11的溶液中:S2-、K+、CO![]() 、Cl-
、Cl-
C.pH=1的溶液中:Fe2+、NH![]() 、Mg2+、NO
、Mg2+、NO![]()
D.水电离的c(H+)=10-12mol·L-1的溶液中:Fe3+、SO![]() 、K+、SCN-
、K+、SCN-
11. 据环保部门测定,我国一些大城市的酸雨pH=3.5。在酸雨季节铁制品极易腐蚀,则在其腐蚀中正极发生的反应是( )
A.Fe-2e=Fe2+ B.2H2O+O2+4e-=4OH-
C.2H++2e-=H2↑ D.4OH-+4e-=2H2O+O2↑
12.关于氢键,下列说法正确的是( )
A.氢健比范德华力强,所以它属于化学键
B.分子间形成的氢键使物质的熔点和沸点降低
C.由于氨与水分子之间可形成分子间氢键,使氨在水中溶解度增大
D.H2O是一种非常稳定的化合物,这是由于氢键所致
13. 两种元素原子的核外电子层数之比与它们的最外层电子数之比相等,在周期表的前
10号元素中满足上述关系的元素有( )
A 1对 B 2对 C 3对 D 4对
14. 2000年1月底,罗马尼亚——金矿污水处理池因降暴雨而发生裂口,10万升含氰化物和铅、汞等重金属的污水流入蒂萨河(多瑙河支流),造成该河90%以上的动植物死亡。这是继切尔诺贝利核泄漏以来,欧洲最严重的环境污染事件。氰气(CN)2和氰化物都是剧毒性物质,氰分子的结构式为![]() ,性质与卤素相似,下列叙述错误的是( )
,性质与卤素相似,下列叙述错误的是( )
A. 氰分子中四个原子共直线,是非极性分子
B. 氰分子中C与N之间的距离大于C与C之间的距离
C. 氰气能与强碱溶液反应得到氰化物和次氰酸盐
D. 氰化氢在一定条件下能与烯烃发生加成反应
15.最近,意大利一所大学的科学家制造出了由4个氧原子构成的一种新型氧分子.若该氧分子具有空间对称结构,则下列说法正确的是( ).
A.该分子是氧元素的一种同位素 B.该物质与氧气互为同素异形体
C.该物质是一种氧化物 D.该分子是由极性键构成的极性分子
16.国际化学组织已将周期表中原主、副族的族号去掉而改称列,如碱金属为第1列,稀有气体为第18列.按此规定属于第13列的元素有( ).
A.硼、铝、镓 B.氮、磷、砷 C.铜、银、金 D.锌、镉、汞
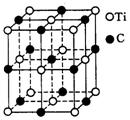
17.最近发现一种由钛(Ti)原子和碳原子构成的气态团簇分子,分子模型如图所示,其中圆圈表示钛原子,黑点表示碳原子,则它的化学式为( ).
A.TiC B.Ti13C14 C.Ti4C7 D. Ti14C13
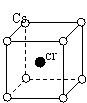 18.如图是氯化铯晶体的晶胞,已知晶体中2个最近的Cs+离子核间距离为a cm,氯化铯的式量为M,NA为阿氏常数,则氯化铯晶体的密度为( )
18.如图是氯化铯晶体的晶胞,已知晶体中2个最近的Cs+离子核间距离为a cm,氯化铯的式量为M,NA为阿氏常数,则氯化铯晶体的密度为( )
|
| ||||||
|
| ||||||
A.—— g/cm3 B.—— g/cm3 C.—— g/cm3 D.—— g/cm3
19.用足量MnO2与VmL10mol·L-1的盐酸共热制Cl2,在标准状况下,产生2.24LCl2,则V值应为( )
A、V=20 B、V=40
C、40>V>20 D、V>40
20.浓盐酸和次氯酸钙能发生如下反应Ca(ClO)2+4HCl(浓)=CaCl2+Cl2↑+2H2O,用贮存较久的的漂粉精与浓盐酸反应制得的氯气中,含有的杂质为( )
A.可能有CO2 、HCl 、H2O (g) 三种 B. 只有HCl 、H2O、O2三种
C.只有HCl和H2O(g)二种 D.只有CO2和O2二种
二.填空题
21.(12分)已知X、Y、Z、L、M、N是元素周期中前20号的五种元素,它们的原子序数依次增大。X和Y可形成常见化合物YX4,一个YX4分子电子总数为10。Z单质在通常状况下为无色无味气体。L原子的最外层电子数是核外电子总数的3/4。NY2加水生成Y2X2和化合物D。试回答:
(1)X单质和Z单质在一定条件下可生成化合物E。
①用电子式表示E的形成过程 ,化学键类型为 ,晶体类型为 。
②工业上制取E的化学方程式为: 。
③实验室制取E的化学方程式为 。
(2)由M、Y、L三种元素组成的物质焰色反应显紫色,向其溶液中滴入酚酞溶液,溶液显红色,原因是(用离子方程式表示) ;若再向溶液中滴入过量的氯化钙溶液,观察到的实验现象是 ,原因是 。(3)NY2与水反应生成Y2X2和化合物D的化学方程为 。
22. (9分) 如下图所示,甲、乙、丙是三种常见单质,X、Y、Z是常见化合物。它们之间有如下转化关系:
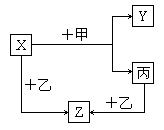
试回答下列问题:
(1)若甲是具有还原性的金属单质,X、Y、Z中有一种白色固体,丙是具有还原性的非金属单质,试推断:
①X、Y、Z中含有丙单质中元素的是_____________________(填写物质的化学式);
②Z是________________气的主要成分;
③X与甲反应的化学方程式是________________________________。
(2)若甲是具有氧化性的黄绿色气体单质,丙通常是深红棕色的液体,Y和Z具有相同的阳离子,X与Z含有相同的阴离子。试推断:
①写出甲、乙、丙三种物质的化学式__________、__________、__________。
②写出X与足量的甲在溶液中完全反应的离子方程式_____________________________________________。
23. (7分)某溶液由Na+、Cu2+、Ba2+、Fe3+、AlO2-、CO32-、SO42-、Cl-中的若干种离子组成.取适量该溶液进行如下实验:
①向其中加入过量盐酸,有气体生成,并得到无色透明溶液;
②在①所得溶液中加入过量氨水,产生白色沉淀,过滤;
③在②所得滤液中加入过量氢氧化钡溶液,产生白色沉淀,过滤;
④在③所得的滤液中加入过量稀硝酸,再加入硝酸银溶液,产生白色沉淀.
根据上述实验回答下列问题:
(1)原溶液中一定不存在的离子是 ;
(2)原溶液中一定存在的离子是 。
24.(4分)(1)某同学将甲烷气体长时间通入溴水中,溴水颜色 (填写“变深”、“变浅”、“不变”)主要原因是 。
(2)在试管中装有四氯化碳和水两种液体,静置分层后,如果不知道哪一层液体是“水层”,试设计一种最简便的判断方法。
三.实验题
25.(4分)某化学课外小组用海带为原料制取了少量碘水.现用![]() 从碘水中萃取碘并用分液漏斗分离两种溶液.其实验操作可分解如下几步:
从碘水中萃取碘并用分液漏斗分离两种溶液.其实验操作可分解如下几步:
A.把盛有溶液的分液漏斗放在铁架台的铁圈中;
B.把50 mL碘水和![]() 加入分液漏斗中,并盖好玻璃塞;
加入分液漏斗中,并盖好玻璃塞;
C.检验分液漏斗活塞和上口的玻璃塞是否漏液;
D.倒转漏斗用力振荡,并不时施开活塞放气,最后关闭活塞,把分液漏斗放正;
E.旋开活塞,用烧杯接收溶液;
F.从分液漏斗上口倒出上层水溶液;
G.将漏斗上口的玻璃塞打开或使塞上的凹槽或小孔对准漏斗口上的小孔;
H.静置、分层.
就此实验,完成下列填空:
(1)正确操作步骤的顺序是:(用上述各操作的编号字母填写)________→_______→________→A→G________→E→F
(2)能选用![]() 从碘水中萃取碘的原因是_______________.
从碘水中萃取碘的原因是_______________.
(3)下列物质,不能作为从溴水中萃取溴的溶剂的是________.
A.热裂汽油 B.苯 C.酒精 D.正庚烷
26. (6分)在实验室里制取某些有毒气体时,为了尽量防止毒气逸散造成空气污染,有人设计了如下图所示的装置[Ⅰ]。并设想用[Ⅱ]或[Ⅲ]两种简易装置代替[Ⅰ]的b~c部分,以求达到同样的目的。
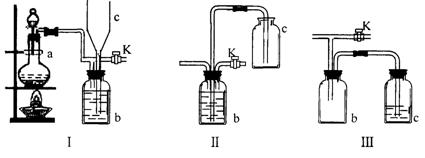
试回答:
(1)若用[Ⅰ]取氯气,b瓶加入的液体一般为 ______________。在选取试剂正确且适量的前题下,反应开始后,当关闭活塞K时如若发现c中液面不明显上升,你分析可能的原因是__________________,检查的简单方法是_________________________
(2)装置[Ⅰ]中b能防止多余气体逸散的原因是:____________________________
四.计算题
27.(9分)某元素Y,0.5molY的离子得到6.02×1023个电子被还原为中性原子,0.4gY的氧化物恰好与100mL0.2mol/L的盐酸完全反应,Y原子核内质子数与中子数相等。写出(1)Y的名称及它在元素周期表中位置。(2)Y的氧化物与盐酸反应的离子方程式。
28.(9分)过氧化钙是一种安全无毒的物质,带有数量不等的结晶水,通常还含有部分CaO。
(1)称取0.542g过氧化钙样品,灼热时发生如下反应:
2CaO2·XH2O![]() 2CaO+O2↑+2XH2O,得到的O2在标准状况下体积为67.2mL,求该样品中CaO2的物质的量。
2CaO+O2↑+2XH2O,得到的O2在标准状况下体积为67.2mL,求该样品中CaO2的物质的量。
(2)另取同一样品0.542g,溶于适量的稀盐酸中,然后加入足量的Na2CO3溶液,将溶液中Ca2+ 全部转化为CaCO3沉淀,得到干燥的CaCO3 0.70g。
①试计算样品中CaO的质量。
②试计算样品中CaO2·XH2O的X值。
高三化学第三次月考试卷参考答案
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | B | B | A | D | D | C | D | C | D | B |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | C | C | B | B | B | A | D | C | D | A |
二.填空题
21.①H:N:H,极性共价键,分子晶体
|
![]() ②N2+3H2
2NH3
②N2+3H2
2NH3
|
③2NH4Cl+Ca(OH)2
2NH3+CaCl2+2H2O
![]() (2)CO
(2)CO![]() +H2O
HCO
+H2O
HCO![]() +OH- 产生白色沉淀,且溶液的红色褪去,加入CaCl2后,Ca2++ CO
+OH- 产生白色沉淀,且溶液的红色褪去,加入CaCl2后,Ca2++ CO![]() = CaCO3↓使水解平衡向左移动,OH-离子浓度减少,使溶液褪色。
= CaCO3↓使水解平衡向左移动,OH-离子浓度减少,使溶液褪色。
![]()
![]()
![]() (3)CaC2+2H2O→Ca(OH)2+HC
CH↑
(3)CaC2+2H2O→Ca(OH)2+HC
CH↑
22. (1)①![]() ②水煤气③
②水煤气③![]()
(2)①![]() ;Fe;
;Fe;![]()
②![]()
23. ⑴Ba2+、Fe3+、Cu2+ ⑵Na+、AlO2-、CO32-、SO42-
24.(7分)(1)变浅(2分) 溴水中的溴随着甲烷气体逸出(2分) (2)向试管中加入少量水(1分)
体积增加的液体是水层(2分)
三.实验题
25.(1)C→B→D→A→G→H→E→F
(2)![]() 与水不互溶;而且碘在
与水不互溶;而且碘在![]() 中的溶解度比在水中大很多.
中的溶解度比在水中大很多.
(3)A、C
26. (1) 饱和食盐水;装置漏气;用湿润的碘化钾淀粉试纸先靠近各边接口处检验,漏气处试纸变蓝 (涂肥皂水等合理方法均可)
(2) 关闭活塞后,若a中仍有气体发生,气体压强增大。将b中液体压入c中,整个装置成为储气装置,不会有气体逸出。
四.计算题
27.解析 0.5molY的离子得到6.02×1023个电子(即1mol电子)被还原为中性原子,所以1molY应得到2mol电子还原为中性原子,即Y离子应带2个带电D荷,则其氧化物的化学式应为YO。
YO + 2HCl=YCl2+H2O
Y+16g 2mol
0.4g 0.2mol/L×100×10-3L
∴![]() =
=![]()
∴Y=24
又∵Y核中质子数等于中子数,∴Y的质子数为12,应是Mg,位于第三周期ⅡA族。
MgO+2H+=Mg2++H2O
28.(1)0.006mol
(2)①n(CaO2)=0.006moln(Ca2+)=0.007molm(CaO)=0.056g
②n(H2O)=0.003mol X=1/2