高一化学第一学期阶段学习认证试题
(一)(月考卷)
高一化学试题
(试题范围:苏教版必修Ⅰ专题一)
本试卷分第Ⅰ卷(选择题 共54分)和第Ⅱ卷(非选择题 共46分)两部分。考试时间为90分钟。满分为100分。
可能用到的相对原子质量是:H:1 He:4 C:12 O:16 Cl:35.5 S:32 Cu:64
第Ⅰ卷(选择题 共54分)
注意事项:
1.答第Ⅰ卷前,考生务必将密封线内的项目填写清楚。
2.每小题选出答案后,填入第Ⅰ卷答题栏中。
3.考试结束,考生只将第Ⅱ卷交回,第Ⅰ卷自己保留。
一、选择题(本大题共18个小题,每小题3分,共54分。每小题只有一个选项符合题意)
1.通过化学反应不能实现的是
A.生成一种新离子 B.生成一种新分子
C.生成一种新核素 D.生成一种新单质
2.下列物质的分类、名称(或俗名)、化学式都正确的是
A.碱性氧化物氧化铁FeO
B.酸性氧化物碳酸气CO
C.酸硫酸H2S
D.盐纯碱Na2CO3
3.下列关于化学反应类型的叙述中,正确的是
A.凡是生成盐和水的反应都是中和反应
B.复分解反应一定没有单质参加
C.生成一种单质和一种化合物的反应一定是置换反应
D.分解反应的生成物一定有单质
![]() 4.在反应A2+2AB2 4AB中,1 g A2与足量的AB2反应生成5 g AB,则A2与AB2的相对分子质量之比为
4.在反应A2+2AB2 4AB中,1 g A2与足量的AB2反应生成5 g AB,则A2与AB2的相对分子质量之比为
A.3∶4 B.4∶3 C.1∶2 D.2∶1
5.![]() He 可以作为核聚变材料,下列关于
He 可以作为核聚变材料,下列关于![]() He的叙述正确的是
He的叙述正确的是
A. ![]() He 和
He 和![]() H 互为同位素
H 互为同位素
B. ![]() He 原子核内中子数为2
He 原子核内中子数为2
C. ![]() He 原子核外电子数为2
He 原子核外电子数为2
D. ![]() He 代表有2个质子和3个中子的氦原子
He 代表有2个质子和3个中子的氦原子
6.下列微粒的个数比为2∶1的是
A.Be2+中的质子和电子
B. ![]() H中的中子和质子
H中的中子和质子
C.Ca(OH)2溶液中的阳离子和阴离子数
D.氧原子的最外层和次外层电子
7.下列说法正确的是
A.32 g O2占的体积约为22.4 L
B.22.4 L N2 含阿伏加德罗常数个 N2 分子
C.在标准状况下,22.4 L H2O 的质量约为 18 g
D.22 g CO2 与标准状况下11.2 L HCl 含有相同分子数
8.相同物质的量的 CO 和 CO2 相比较,下列叙述正确的是
(1)分子数之比为1∶1
(2)所含氧原子数之比为1∶2
(3)原子总数之比为2∶3
(4)碳原子数之比为1∶1
(5)电子数之比为7∶11
(6)体积之比为1∶1
A.(1)(4) B.(2)(3)
C.(1)(2)(4)(6) D.(1)(2)(3)(4)(5)
9.已知 2.2 g 某气体中所含的分子数目约为 3.01×1022,则此气体的相对分子质量是
A.22 B.44 g C.44 D.44 g/mol
10.下列各物质中所含原子个数由大到小的顺序排列正确的是
(1)0.5 mol NH3 (2)1 mol Ne (3)9 g H2O (4)0.2 mol Na3PO4
A.(1)(4)(3)(2) B.(4)(3)(2)(1)
C.(2)(3)(4)(1) D.(1)(4)(2)(3)
11.下列实验中,(1)配制一定物质的量浓度的溶液(2)pH试纸的使用(3)过滤(4)蒸发,均需用到的仪器是
A.试管 B.容量瓶
C.玻璃棒 D.漏斗
12.相同温度和压强下,3体积X2气体和6体积Y2气体化合生成6体积气态化合物,则生成物的化学式为
A.XY B.X3Y2 C.X2Y3 D.XY2
13.将200 ml 0.5 mol/L 的 BaCl2 溶液和 300 ml 0.2 mol/L 的 CaCl2溶液混合,得到 500 ml 混合液,其中 Cl- 的浓度是
A.0.9 mol/L B.0.64 mol/L
C.0.5 mol/L D.0.32 mol/L
14.下列物质中,本身属于非电解质,溶于水与水反应的生成物属于电解质的物质是
A.氯化钠 B.氯气
C.三氧化硫 D.乙醇
15.用特殊方法把固体物质加工为纳米级(1~100 nm,1 nm=10-9m)的超细粉末粒子,然后制得纳米材料。下列分散系中的分散质的微粒直径和这种粒子具有相同数量级的是
A.溶液 B.悬浊液
C.胶体 D乳浊液
16.V L Al2(SO4)3
溶液中含有 N mol Al3+,则该溶液中SO![]() 的物质的量浓度为
的物质的量浓度为
A.N/V mol·L-1 B.2 N/3 V mol·L-1
C.N/2 V mol·L-1 D.3 N/2 V mol·L-1
17.实验室里配制 480 mL 0.1 mol/L 的硫酸铜溶液,现选取 500 mL 的容量瓶进行配制,以下操作正确的是
A.称取 7.68 g 硫酸铜,加入 500 mL 水
B.称取 12.0 g 胆矾配成 500 mL 溶液
C.称取 8.0 g 硫酸铜,加入 500 mL 水
D.称取 12.5 g 胆矾配成 500 mL 溶液
18.在无土栽培中,需配制一种含 50 mol NH4Cl、16 mol KCl 和24 mol K2SO4的营养液。若用 KCl、NH4Cl 和 (NH4)2SO4 三种固体为原料来配制,其物质的量分别为
A.2 mol、64 mol、24 mol
B.64 mol、2 mol、24 mol
C.32 mol、50 mol、12 mol
D.16 mol、50 mol、24 mol
绝密★启用前
高一化学第一学期阶段学习认证试题
高一化学试题
(试题范围:苏教版必修Ⅰ专题一)
| 题号 | 一 | 二 | 三 | 四 | 总分 |
| 得分 |
第Ⅰ卷答题栏
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 |
第Ⅱ卷(非选择题 共46分)
注意事项:
1.用钢笔或圆珠笔将答案直接答在试题卷上。
2.答卷前将密封线内的项目填写清楚。
| 得分 | 评卷人 |
二、填空题(26分)
19.(10分)设 NA 代表阿伏加德罗常数的数值,请完成下列填空。
(1)20 g 重水 (D2O, ![]() H2O)中含有_____ NA个电子;
H2O)中含有_____ NA个电子;
(2)1 mol C-12 原子中含有_____ NA个中子;
(3)在标准状况下,11.2 L 氮气中约有_____ NA个原子;
(4)若氯化钙溶液中含 111 g 氯化钙,则该溶液中约有_____ NA个氯离子;
(5)含有8个质子,10个中子的某核素9 g,则原子个数为_____ NA。
20.(8分)选择下列方法分离物质,将分离方法的序号填在横线上。
A.萃取分液 B.升华
C.结晶 D.分液
E.蒸馏 F.层析
G.过滤
(1)_____分离饱和食盐水和沙子的混合物。
(2)_____从硝酸钾和氯化钠的混合物中获得硝酸钾。
(3)_____分离水和汽油的混合物。
(4)_____分离 CCl4(沸点为 76.75℃)和甲苯(沸点为110.6℃)的混合物。
21.(4分)对物质进行鉴别时,往往需要最少的试剂和最简单的程序。实验室里有三瓶失去标签的无色溶液,且知它们分别是NaOH溶液、Na2CO3溶液和Ba(OH)2溶液,只用一种试剂就能将它们鉴别开来,该试剂是____________________,有关反应的化学方程式为__________________,__________________,__________________。
22.(4分)人造空气(氧气和氦气的混合气体)可用于减轻某些疾病或供深水潜水员使用。在标准状况下,5.6 L“人造空气”的质量是2.4 g,其中氧气与氦气和体积比是______,氧气的质量是______。
| 得分 | 评卷人 |
三、实验题(11分)
23.要配制0.2 mol/L的稀H2SO4 500 mL
(1)若使用质量分数为98%、ρ=1.84 g/cm3的浓H2SO4时,所需浓硫酸的体积V为____ mL。
(2)下面是某同学配制稀H2SO4的过程:①用100 mL量筒取浓H2SO4 ②另取一量筒加入适量蒸馏水,然后将V mL浓H2SO4缓慢倒入此量筒中稀释 ③将稀释后的浓H2SO4立即直接倒入500 mL的容量瓶中 ④向500 mL容量瓶中加蒸馏水至离刻度线2~3 cm处 ⑤用胶头滴管加水至凹液面与刻度线相切⑥将配好的0.2 moL/L的H2SO4立即倒入干燥的试剂瓶中 ⑦在瓶上贴好标签
错误的操作:
①_______________________________________________________________
②_______________________________________________________________
③_______________________________________________________________
④_______________________________________________________________
(3)若实验遇到下列情况,对硫酸溶液的物质的量浓度有何影响?
(填写“偏高”“偏低”或“不变”)
①稀释浓硫酸后的烧杯未洗涤:______。
②未经冷却趁热将溶液注入容量瓶中:______。
③摇匀后发现液面低于刻度线再加水:______。
④容量瓶中原有少量蒸馏水:______。
⑤转移时有少量液体溅出:______。
⑥定容时观察液面俯视:______。
| 得分 | 评卷人 |
四、计算题(7分)
24.实验室使用的浓盐酸的溶质质量分数一般为36.5%,密度为1.19 g/cm3。
(1)将多少升氯化氢(标准状况下)通入1.00 L水中可得到36.5%的浓盐酸?
(2)求该盐酸的物质的量浓度。
参考答案
(试题范围:苏教版必修Ⅰ专题一)
一、选择题(本大题共18个小题,每小题3分,共54分。每小题只有一个选项符合题意)
1.C此题考查化学反应前后的物质变化情况,可用排除法解答。由质量守恒定律可知化学反应前后原子的种类不变,而A、B、D分别可用钠与水反应,NaOH与盐酸反应,KClO3分解来排除。
2.D此题属于对物质分类知识的考查,是对初中知识的巩固,A中氧化铁化学式为Fe2O3,B中碳酸气为CO2,C中硫酸分子式应为H2SO4。
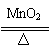 | |||
3.B用排除法,A中可用2NaHCO3 Na2CO3+CO2↑+H2O,C中2KClO3
2KCl+3O2↑,D用NH4HCO3 NH3↑+CO2↑+H2O排除。
![]() 4.C由质量守恒可知与1 g A2反应的AB2为4 g,由A2+2AB2 4AB可知参加反应的A2与AB2物质的量之比为1∶2,质量之比为1∶4,则摩尔质量之比为1∶2,即相对分子质量之比为1∶2。
4.C由质量守恒可知与1 g A2反应的AB2为4 g,由A2+2AB2 4AB可知参加反应的A2与AB2物质的量之比为1∶2,质量之比为1∶4,则摩尔质量之比为1∶2,即相对分子质量之比为1∶2。
5.C ![]() He表示的是质子数为2,质量数是3的氦原子。此题考查在原子中质子数+中子数=质量数。
He表示的是质子数为2,质量数是3的氦原子。此题考查在原子中质子数+中子数=质量数。
6.A
7.D本题重在考查气体摩尔体积,有一定的迷惑性。A、B中没有注明在标准状况下,C中在标况下水为液态。
8.D没有指明是否在相同条件下,物质的量相同的CO和CO2所占体积不一定相等,故(6)错误。
9.C此题考查阿伏加德罗常数及摩尔质量的计算,但要注意相对分子质量与摩尔质量的区别。![]() =44 g·mol-1 Mr=44。(相对分子质量无单位,故选C)
=44 g·mol-1 Mr=44。(相对分子质量无单位,故选C)
10.A本题考查对物质的量的应用N=n·NA,注题此题比较的是原子个数大小。
(1)中为0.5 mol×4×NA (2)中1 mol×1×NA (3)中![]() ×3×NA
×3×NA
(4)中0.2 mol×8×NA
11.C
12.D此题考查阿伏加德罗定律和质量守恒定律,由前者可知X2+2Y2=2XaYb,由后者可知a=1 b=2,即化学式为XY2。
13.B本题考查的知识点是有关混合液中某一离子浓度的计算。
c(Cl-)=![]() =0.64 mol/L。
=0.64 mol/L。
14.C判断一种物质是电解质还是非电解质时,一定要抓住两个概念的本质部分:物质——一定是化合物;条件——溶于水或受热熔化;性质——导电与否;实质——本身是否电离。
15.C
16.D C(SO![]() )=
)=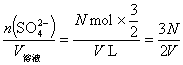 mol·L-1。
mol·L-1。
17.D此题的关键是要弄明白容量瓶的体积与所取药品的质量的关系,应照配制500 ml溶液来计算药品质量。A、C不对,不应加500 ml水,此时溶液体积不等于500 ml。m(CuSO4·5H2O)=0.1 mol·L-1×0.5 L×250 g·mol-1=12.5 g。因此应选D。
18.B此题考查元素守恒的有关知识,由题意可知营养液中含n(NH![]() )=50 mol n(Cl-)= 66 mol n(SO
)=50 mol n(Cl-)= 66 mol n(SO![]() )=24 mol,则可知后三种固体中含(NH4)2SO4为24 mol,NH4Cl为2 mol,KCl为64 mol。
)=24 mol,则可知后三种固体中含(NH4)2SO4为24 mol,NH4Cl为2 mol,KCl为64 mol。
二、填空题(26分)
19.解析:(1)20 g D2O的物质的量是1 mol,1个D2O中含10个e-。
(2)![]() C原子中有6个质子、6个中子,则1 mol 126C中含6NA个中子。
C原子中有6个质子、6个中子,则1 mol 126C中含6NA个中子。
(3)![]() ×2=1 mol,即含NA个N原子。
×2=1 mol,即含NA个N原子。
(4)N(Cl-)=n(Cl-)·NA=![]() ×2×NA=2 NA。
×2×NA=2 NA。
(5)该核素的相对原子质量为18,其物质的量为![]() =0.5 mol。
=0.5 mol。
答案:(1)10(2)6(3)1(4)2(5)0.5(每空2分)
20.答案:(1)G(2)C(3)D(4)E(每空2分)
![]() 21.答案:稀H2SO4(1分)2NaOH+H2SO4 Na2SO4+2H2O(1分)
21.答案:稀H2SO4(1分)2NaOH+H2SO4 Na2SO4+2H2O(1分)
![]() Na2CO3+H2SO4 Na2SO4+CO2↑+H2O(1分)
Na2CO3+H2SO4 Na2SO4+CO2↑+H2O(1分)
![]() Ba(OH)2+H2SO4 BaSO4↓+2H2O(1分)
Ba(OH)2+H2SO4 BaSO4↓+2H2O(1分)
22.解析:设氧气和氦气的物质的量分别为x、y,则有
![]() (x+y)×22.4 L·mol-1=5.6 L
(x+y)×22.4 L·mol-1=5.6 L
32 g·mol-1·x+4 g·mol-1·y=2.4 g
![]() 解之
解之
x=0.05 mol
y=0.20 mol
答案:1∶4,1.6 g(每空2分)
三、实验题(11分)
23.答案:(1)5.4(1分)
(2)①用100 mL量筒取浓H2SO4,应改为用10 mL量筒取浓H2SO4。(1分)
②将V mL浓H2SO4倒入量筒中稀释,应改为在烧杯中稀释。(1分)
③将稀释后的H2SO4立即转到500 mL容量瓶中,应待溶液冷却后再转移。(1分)
④向500 mL容量瓶中加水至刻度线2~3 cm处,应改为1~2 cm处。(1分)
(3)①偏低 ②偏高 ③偏低 ④不变 ⑤偏低 ⑥偏高(6分,每空1分)
四、计算题(7分)
24.解析:(1)36.5%=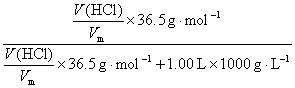
解之得V(HCl)=353 L(3分)
(2)解法1 c(HCl)=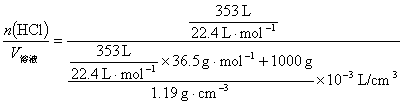 =11.9 mol·L-1(4分)
=11.9 mol·L-1(4分)
解法2由公式c=![]() 可知
可知
c(HCl)=![]() =11.9 mol·L-1
=11.9 mol·L-1
答案:(1)353 L(2)11.9 mol·L-1