高三上学期期中考试化学试卷
(时间120分钟,满分150分)
班级_______姓名_________学号________成绩_________
一、单选题
1、下列说法中,正确的是
A.非极性共价键只存在于单质中
B.离子键只能存在于化合物中
C.分子晶体里只存在分子间作用力,不存在化学键
D.具有正四面体结构的分子,如CH4、CCl4、P4等,其中键角都是109°28’
2、下列各组物质中,化学键类型和晶体类型都相同的是
A.KCl 和KOH B.Cl2和H2 C.CO2 和SiO2 D.NH4Cl 和KI
3、由中国学者和美国科学家共同合成了世界上最大的碳氢分子,其一个分子由1134个碳原子和1146个氢原子构成。关于此物质,下列说法肯定错误的是
A.属烃类化合物 B.常温下是固体
C.可发生氧化、加成反应 D.具有类似金刚石的硬度
4、据报道,科研人员应用电子计算机模拟出类似C60的物质N60 ,试推测该物质不可能具有的性质是
A.N60易溶于水 B.稳定性N60 < N2
C.等物质的量分解吸收的热量N60 > N2 D.熔点N60 > N2
5、在一定的温度下,100ml 6mol/L硫酸与过量锌粉反应,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量的
A.Na2CO3(固体) B.水 C.NaNO3溶液 D.硫酸铵固体
![]()
![]() 6、已知C+CO2 2 CO-Q,反应速率为v1;N2+3H2 2NH3+Q,反应速率为v2,对于上述反应,当温度升高时,v1和v2的变化情况为
6、已知C+CO2 2 CO-Q,反应速率为v1;N2+3H2 2NH3+Q,反应速率为v2,对于上述反应,当温度升高时,v1和v2的变化情况为
A.同时增大 B.同时减小 C.v1增大 ,v2减小 D.v1减小 ,v2增大
![]() 7、N2O4(g
) 2NO2(g
),若N2O4的浓度由0.1mol/L降到0.07mol/L需要15s,那么N2O4的浓度由0.07mol/L降到0.05mol/L时所需时间为
7、N2O4(g
) 2NO2(g
),若N2O4的浓度由0.1mol/L降到0.07mol/L需要15s,那么N2O4的浓度由0.07mol/L降到0.05mol/L时所需时间为
A.等于5s B.等于10s C.大于10s D.小于10s
![]() 8、在一密闭容器中,aA (g )
bB (g )达到平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则
8、在一密闭容器中,aA (g )
bB (g )达到平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则
A.平衡向逆反应方向移动了 B.物质A的转化率减小了
C.物质B的质量分数增加了 D.化学计量数关系a > b
![]() 9、乙酸蒸气能形成二聚分子:2CH3COOH
(CH3COOH )2(g ) +Q,现欲测定乙酸的分子量,应采取的条件为
9、乙酸蒸气能形成二聚分子:2CH3COOH
(CH3COOH )2(g ) +Q,现欲测定乙酸的分子量,应采取的条件为
A.高温、低压 B.低温、高压 C.低温、低压 D.高温、高压
10、已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,下列有关叙述正确的是
①生成物的百分含量一定增加 ②生成物的产量一定增加 ③反应物的转化率一定增大 ④反应物的浓度一定降低 ⑤正反应的速率一定大于逆反应的速率 ⑥使用了合适的催化剂
A.① ② B.② ⑤ C.③ ⑤ D.④ ⑥
![]() 11、某温度下,在固定容积的密闭容器中发生可逆反应A(g)+3B(g) 2P(g),测得平衡时,nA︰nB︰nP = 3︰3︰1,保持温度不变,以3︰3︰1的体积比再充入A、B、P,下列变化正确的是
11、某温度下,在固定容积的密闭容器中发生可逆反应A(g)+3B(g) 2P(g),测得平衡时,nA︰nB︰nP = 3︰3︰1,保持温度不变,以3︰3︰1的体积比再充入A、B、P,下列变化正确的是
A.刚充入时,v正增大,v逆减小 B.充入后,混合物密度比原来大
C.P的体积分数减小 D.充入后,体系压强减小
![]() 12、已知工业上熔融真空炼铷的原理如下:2RbCl+Mg MgCl2
+2Rb(g),对于此反应的进行能给予正确解释的是
12、已知工业上熔融真空炼铷的原理如下:2RbCl+Mg MgCl2
+2Rb(g),对于此反应的进行能给予正确解释的是
A.铷的金属活动性不如镁强,故镁可以置换铷
B.铷的沸点比镁低,把铷蒸气抽出时,平衡右移
C.MgCl2对热稳定性不如RbCl强
D.铷的单质状态较化合态更稳定
13、硫燃烧的主要产物是SO2,但也有少量的SO3生成,若取一定质量的硫在两个容积相同分别充有相同体积的空气和纯氧的密闭容器中完全燃烧,混合气体中SO3的体积分数分别为a和b,则a和b的关系正确的是
A.a>b B.a<b C.a=b D.无法确定
![]() 14、NO2溶于水制硝酸的反应为:3NO2(g)+H2O(g) 2HNO3
+NO(g)(正反应为放热反应),为了提高硝酸的产率,硝酸工厂实际生产中采用的措施是
14、NO2溶于水制硝酸的反应为:3NO2(g)+H2O(g) 2HNO3
+NO(g)(正反应为放热反应),为了提高硝酸的产率,硝酸工厂实际生产中采用的措施是
A.升温 B.加压 C.通入过量的O2 D.降温
![]() 15、把Ca(OH)2放入一定量的蒸馏水中,一定温度下达到如下平衡:Ca(OH)2(固) Ca2+ +2OH— 。当向悬浊液中加入少量生石灰后,若保持温度不变,下列判断正确的是
15、把Ca(OH)2放入一定量的蒸馏水中,一定温度下达到如下平衡:Ca(OH)2(固) Ca2+ +2OH— 。当向悬浊液中加入少量生石灰后,若保持温度不变,下列判断正确的是
A.溶液中Ca2+数量减少 B.Ca2+的浓度增大 C.OH—的浓度减小 D.溶液pH增大
![]() 16、在一个密闭容器中充入1molCO2和3molH2,在850℃时,气体混合物达到平衡: CO2+H2
CO+H2O。已知达到平衡时生成0.75molCO。如果最初充入H2为9mol,在上述条件平衡时,生成CO与水蒸气的物质的量之和可能为
16、在一个密闭容器中充入1molCO2和3molH2,在850℃时,气体混合物达到平衡: CO2+H2
CO+H2O。已知达到平衡时生成0.75molCO。如果最初充入H2为9mol,在上述条件平衡时,生成CO与水蒸气的物质的量之和可能为
A.1.2mol B.1.5mol C.1.8mol D.2.5mol
17、某温度下,将氯气通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合液,经测定ClO—与ClO3—浓度之比为1︰3,则Cl2与NaOH溶液反应时,被还原的氯元素与被氧化的氯元素的物质的量之比为
A.21︰5 B.11︰3 C.3︰1 D.4︰1
18、下列物质中既能与盐酸反应,又能与KOH溶液反应的是
A.![]() B.
B.![]()
C. ![]()
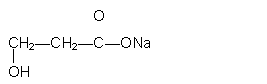 D.
D.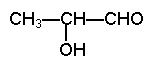
19、芬必得是一种性能优良,使用广泛的具有解热、镇痛、抗炎作用的长效缓释药物,其主要成分的结构简式如下:
![]()

下列对芬必得的叙述正确的是
A.芬必得应在饭后服用,以免刺激肠胃 B.芬必得含苯环结构,但不属于苯的同系物 C.芬必得含有羧基,极易溶于水中 D.一定条件下芬必得可与乙醇发生酯化反应
20、扑热息痛是一种优良的解热镇痛药,其结构如图所示,它可能具有的化学性质是
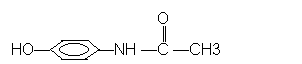

A.不与氢氧化钠溶液反应 B.能与浓溴水发生加成反应
C.不能被氧化 D.遇三氯化铁溶液呈现紫色
二、填空题
21、KClO3和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯。其变化可表述为:
![]() ____KClO3+_____HCl(浓) ____KCl +____ClO2↑+____(
)+______Cl2↑
____KClO3+_____HCl(浓) ____KCl +____ClO2↑+____(
)+______Cl2↑
(1) 请完成该化学方程式并配平(未知物化学式和系数填入括号和空格)。
(2) 浓盐酸在反应中显示出的性质是______________________________。
(3) 每产生0.1mol Cl2,则转移的电子的物质的量为__________________。
(4) ClO2具有很强的氧化性,因此常被用作消毒剂,其消毒的效率(以单位质量得到的电子数表示)是Cl2的__________倍。
22、元素周期表中位于对角线的两种元素其性质相似称之为对角线规律,根据周期表对角线规律,金属Be与Al的单质及其化合物的性质相似。又知AlCl3熔沸点较低,易升华。根据题目所给信息,试回答下列问题:
(1)写出Be与NaOH溶液反应的离子方程式(生成物之一是Na2BeO2):
_______________________________________________________
(2 ) Be(OH)2和Mg(OH)2可用试剂____________鉴别,其化学方程式为:
________________________________________________________________________
(3 )BeCl2是____________(填“离子”或“共价”)化合物,其电子式为___________________。
BeCl2水溶液呈酸性,其水解的离子方程式为___________________________________。
![]() 23、在一定条件下,可逆反应A2(g)+B2(g) 2C(g)达到平衡时,各物质的浓度为:A2 0.5mol/L,B2 0.1mol/L,C 1.6mol/L,若用a、b、c分别表示A2、B2、C的初始浓度(mol/L),则:(1)a、b应满足的关系式是____________________________;
23、在一定条件下,可逆反应A2(g)+B2(g) 2C(g)达到平衡时,各物质的浓度为:A2 0.5mol/L,B2 0.1mol/L,C 1.6mol/L,若用a、b、c分别表示A2、B2、C的初始浓度(mol/L),则:(1)a、b应满足的关系式是____________________________;
(2)a的取值范围是___________________________________。
![]() 24、298K时,合成氨反应的热化学方程式为N2(g)+3H2(g) 2NH3(g)+92.4KJ/mol
24、298K时,合成氨反应的热化学方程式为N2(g)+3H2(g) 2NH3(g)+92.4KJ/mol
在该温度下,取1mol N2和3mol H2放在一密闭容器中,在催化剂催化下进行反应,测得反应放出的热量总是小于92.4KJ,其原因是__________________________________________。
![]() 25、在10.0℃和2×105Pa的条件下,反应aA(g) dD(g)+eE(g)建立平衡后,再逐步增大体系的压强(维持温度不变),下表列出了不同压强下反应建立平衡时物质D的浓度(压强增大到一定程度时,E可能会发生状态的改变):
25、在10.0℃和2×105Pa的条件下,反应aA(g) dD(g)+eE(g)建立平衡后,再逐步增大体系的压强(维持温度不变),下表列出了不同压强下反应建立平衡时物质D的浓度(压强增大到一定程度时,E可能会发生状态的改变):
| 压强(Pa) | 2×105 | 5×105 | 1×106 |
| D的浓度(mol/L) | 0.085 | 0.20 | 0.44 |
根据表中压强和浓度变化的数据关系,回答下列问题:
(1) 压强从2×105增加到5×105Pa时,平衡向______(正或逆)反应方向移动,理由是_________________________________________________。
(2) 压强从5×105增加到1×106Pa时,平衡向________(正或逆)反应方向移动,理由是________________________________________,这可能是由于__________________。
26、具有强烈催化作用的有机物质二乙烯酮,是由单体乙烯酮(CH2=C=O)聚合而成的。已知乙烯酮可与含活泼氢原子的化合物在不同的条件下发生加成反应(见图示),生成各种化合物(加成的取向完全一样),如与氯化氢加成生成乙酰氯。
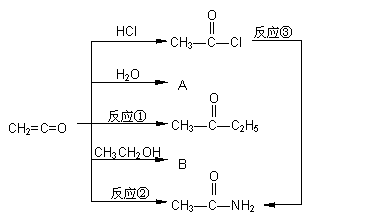

回答下列问题:
(1) 写出A、B的结构简式:A___________________,B__________________。
(2) 反应①的化学方程式______________________________________;
反应②的化学方程式______________________________________;
反应③是乙酰氯与过量氨水混合而发生的,其化学方程式为
______________________________________。
27、化合物A(C8H8O3)为无色液体,难溶于水,从A开始,可发生图示的一系列反应,图中H的化学式为C6H6O,G能发生银镜反应,A硝化时可生成两种一硝基取代物。
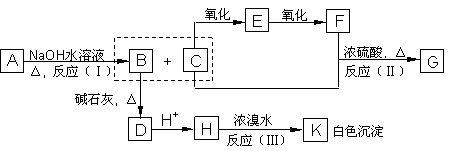

(1) 写出下列化合物可能的结构简式:
A___________________,E___________________。
(2) 写出反应类型:(Ⅰ)__________(Ⅱ)__________(Ⅲ)__________
(3)
![]() 写出化学方程式:H K
___________________________________________;
写出化学方程式:H K
___________________________________________;
![]() C E
_____________________________________________;
C E
_____________________________________________;
![]() C+F G___________________________________________。
C+F G___________________________________________。
三、计算题
![]() 28、在一定条件下可发生反应:2SO2(g)+O2 (g)
2SO3(g)。现取8L
SO2和6L O2混合,当反应达到平衡后,测得混合气体的体积减小10% 。求:
28、在一定条件下可发生反应:2SO2(g)+O2 (g)
2SO3(g)。现取8L
SO2和6L O2混合,当反应达到平衡后,测得混合气体的体积减小10% 。求:
(1)SO2的转化率。
(2)平衡混合气体中SO3的体积分数。
29、某金属锡样品的纯度可通过下述方法分析:将试样溶于酸,反应方程式为:
![]() Sn+2HCl SnCl2+H2↑ 再加入过量 FeCl3 溶液,发生如下反应:
Sn+2HCl SnCl2+H2↑ 再加入过量 FeCl3 溶液,发生如下反应:
![]() SnCl2+2 FeCl3 2 FeCl2+SnCl4 ,最后用已知浓度的 K2Cr2O7 溶液滴定生成的Fe2+,反应式为:
SnCl2+2 FeCl3 2 FeCl2+SnCl4 ,最后用已知浓度的 K2Cr2O7 溶液滴定生成的Fe2+,反应式为:
![]() 6FeCl2+K2Cr2O7 +14HCl 6FeCl3 +2KCl+2CrCl3+7H2O
6FeCl2+K2Cr2O7 +14HCl 6FeCl3 +2KCl+2CrCl3+7H2O
现有该金属试样0.613克,经上述各步反应后,共用去0.100mol/L K2Cr2O7溶液16.0ml。
请列式求解试样中锡的质量分数(假定杂质不参加反应)。(相对原子质量 Sn-119)
参考答案:
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | B | B | D | A | A | A | C | C | A | D |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | B | B | C | C | A | C | D | B | C | D |
21.(1)2,4,2,2,2,1(2)酸性、还原性(3)0.2mol(4)2.63
22.略
23.(1)A=b+0.4 (2)0.4<a<1.3
24.该反应属于可逆反应
25.(1)逆,略(2)正,略
26.(1)CH3COOOH , CH3COOCOC2H5
(2)略
27.(1)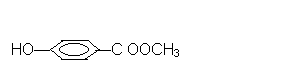
 ,HCHO
,HCHO
(2)取代,取代,取代
(3)略
28.35%,22.22%
29.93.18%