高三上学期第二次月考化学试题
时量:90min 满分:108分
命题:2007届高三化学备课组
可能用到的相对原子质量:H~1,C~12,N~14,O~16, Na~23,P~31,Cl~35.5,
第I卷(选择题,请将符合题意的选项填在答题卷的空格里,共48分)
一、选择题(本大题包括16个小题,共48分。每小题只有一个选项符合题意)
1.下列各项中表达正确的是
|
|
C.NaCl的电子式: D.N2的结构式:∶N≡N∶
2.下列叙述正确的是
A.强电解质都是离子化合物,因此NaCl是离子化合物
B.醋酸溶液的导电能力可能比稀硫酸强
C.SO3溶于水,其水溶液能导电,SO3是电解质
D.硫磺是单质,不导电,因此硫磺是非电解质
3.最近发现一种O4新微粒,有关这种新微粒的说法正确的是
A.它的结构与P4相同
B.它的摩尔质量为64
C.由该微粒构成的物质是氧的一种新的同素异形体
D.它是由两个氧分子通过分子间作用力结合而成的新微粒
4.向一小烧杯中分别加入等体积的水和煤油,片刻后再向该烧杯中轻缓地加入绿豆大小的金属钠,可能观察到的现象是

5. 已知pH=1的某溶液中存在较多的Ba2+、NO3-,则该溶液中还可能大量存在的离子组
是
A.Fe3+、S2O32-、Cl- B.Mg2+、SO42-、Br-
C.Mg2+、Cl-、Fe2+ D.Na+、NH4+、Cu2+
6.下图中曲线粗略表示原子序数在前18号中的某些元素的原子序数(按递增顺序连续排列)和相应单质沸点的关系,其中A点表示的元素是
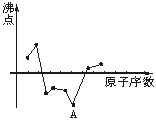
A.C B.Na C.Ne D.N
7.下列热化学方程式中△H的绝对值能表示可燃物的燃烧热的是
A.H2(g)+Cl2(g)=2HCl(g);△H=-184.6kJ/mol
B.CH4(g)+2O2(g)=CO2(g)+2H2O(g);△H=-802.3kJ/mol
C.2H2(g)+O2(g)=2H2O(l);△H=-571.6kJ/mol
D.CO(g)+1/2O2(g)=CO2(g);△H=-283kJ/mol
8. 现有Na2CO3、H2SO4、Ba(OH)2三种物质的量浓度与体积都相等的溶液,若以不同顺序将它们中的两种混合起来,出现沉淀后过滤,再将滤液与第三种溶液混合起来,最终所得的溶液
A.可能呈中性 B.一定呈碱性
C.一定呈酸性 D.一定呈中性
9. 阿伏加德罗常数约为6.02×1023 mol-1,下列叙述中正确的是:
A.常温常压下,20 g D2O和足量的金属钠反应产生气体的分子数为0.5×6.02×1023
B.1 mol Na2O2与足量的水反应,转移的电子数为2×6.02×1023
C.6.02×1023个SO3分子在标准状况下的体积为22.4 L
![]() D.常温常压下,62g白磷分子( )中的共价键数为6×6.02×1023
D.常温常压下,62g白磷分子( )中的共价键数为6×6.02×1023
10. 下列说法正确的是
A. 在3NO2+H2O=2HNO3+NO中,氧化剂和还原剂的质量比为1:2
B. SO2气体使品红溶液褪色,表现了SO2的氧化性
C. 浓盐酸和MnO2反应时,浓盐酸中的HCl全部被氧化
D. 当7.8 g Na2O2与H2O完全反应时,有0.2 mol电子发生了转移
11. 下列关于晶体的说法一定正确的是
下列关于晶体的说法一定正确的是
A.分子晶体中都存在共价键
B.CaTiO3晶体中每个Ti4+和12个O2—相紧邻
C.SiO2晶体中每个硅原子与两个氧原子以共价键相结合
D.金属晶体的熔点都比分子晶体的熔点高
 12.云溪一中某研究性学习小组在老师指导下做了一个如图所示的实验,发现烧杯中酸性KMnO4溶液褪色。若将烧杯中的溶液换成含有少量KSCN的FeCl2溶液,溶液显红色。判断下列说法中正确的是
12.云溪一中某研究性学习小组在老师指导下做了一个如图所示的实验,发现烧杯中酸性KMnO4溶液褪色。若将烧杯中的溶液换成含有少量KSCN的FeCl2溶液,溶液显红色。判断下列说法中正确的是
A.该条件下生成的水分子化学性质比较活泼
B.该条件下H2被冷却为液态氢,液氢的水溶液具有还原性
C.该条件下H2燃烧生成了具有还原性的物质
D.该条件下H2燃烧的产物中可能含有一定量的H2O2
13.下列离子方程式正确的是
A.向Ba(OH)2溶液中滴加NH4HSO4溶液至沉淀刚好完全:
Ba2+ + 2OH- + 2H+ + SO42- = BaSO4↓+ 2 H2O
B.过量铁粉与氯化铁溶液反应,溶液变浅绿色:
Fe + Fe3+ == 2Fe2+
C.向碳酸氢钙溶液中加入过量氢氧化钠
Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32-
D.将少量SO2气体通入NaClO溶液中:
SO2 + H2O + ClO—=SO42-+ Cl- + 2H+
14.现有简易洗气瓶(如右图),正放在桌面上,可分别实现下列实验目的,其中适用于从y口进入的是:
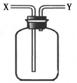 ①瓶内盛一定量液体干燥剂,用于干燥气体
①瓶内盛一定量液体干燥剂,用于干燥气体
②瓶内盛一定量液体洗涤剂,用于除去气体中的某些杂质
③瓶内盛水,用于测量难溶于水的气体体积
④瓶内贮存难溶于水的气体,加入水使气体排出
⑤用于收集密度大于空气的气体
⑥用于收集密度小于空气的气体
A.①③ B.②④ C.③⑤ D.③⑥
15.在四个密闭容器中分别装有下表所示的一定量的物质,将它们加热至300oC,经充分
反应后排出气体,则残留固体及其物质的量不正确的是
| A | B | C | D | |
| 反应前 | 1molNaOH、1molNaHCO3 | 1molNa2O、1molNaHCO3 | 1mo1Na2O2、lmolNaHCO3 | 1molNa2O2、1molNH4HCO3 |
| 反应后 | 1molNa2CO3 | 1molNaOH、0.5molNa2CO3 | 1molNaOH、1molNa2CO3 | 1molNa2CO3 |
16. 短周期元素 X 和 Y 可以形成 XY4 型化合物, 若 X 的原子序数为 m , Y 的原子序数为 n , 则 m 和n 的相互关系为:
A. m – 13 = n B. n + 5 = m
C. m + 8 = n D. n – 11 = m
 高三上学期第二次月考化学试题
高三上学期第二次月考化学试题
答 卷
时量:90min 满分:108分
一、选择题(本大题包括16个小题,共48分。每小题只有一个选项符合题意)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | |||||||||
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 评 分 | |
| 答案 | 分 | ||||||||
第II卷(非选择题,共60分)
二、(本大题包括三个小题,共30分)
17.(11分)(1)分别写出由氧气在一定条件下生成下列物质的化学方程式(须注明反应条件)。
①![]() :___________
②
:___________
②![]() ___________
③
___________
③![]() ___________
___________
(2)指出氧元素在下列各物质中的化合价。
①![]() :___________ ②CaO2___________ ③OF2___________
:___________ ②CaO2___________ ③OF2___________
(3)人体O22-离子对健康有害,使人过早衰老,但在催化剂SOD存在下可发生如下反应,请完成该反应离子方程式:
![]()
18.(8分)X、Y、Z、W均为短周期元素,且原子序数依次递增。现有A、B、C、D、E五种物质均含元素W,有的还可能含有元素X、Y、Z。
① X与Z是同族元素,Y与W也是同族元素,X的电子层数与核外电子总数相同。
② 常温常压时,B、C为气体,B与C混合时有淡黄色固体A析出。
③ 元素W在D中呈现最高正价,D的稀溶液与盐E的溶液反应时,产物中有A和B生成。
④ 经过氯水漂白的布,为了除去多余的氯气,可在碱性条件下(如氢氧化钠溶液),加放E物质,其产物中有一种含元素W的物质,W在该物质中呈现最高正价。
(1) 元素W是_______________(写元素符号),物质C的电子式是_________________;
(2) 写出②中反应的化学方程式______________________________________;
(3) 写出④中反应的离子方程式_______________________________________。
19.(11分) 在周期表中,同一主族元素化学性质相似。目前也发现有些元素的化学性质和它在周期表中左上方或右下方的另一主族元素性质相似,称为对角线规则。据此回答:
①锂在空气中燃烧,除生成 外,也生成微量的 。
②铍的最高价氧化物对应的水化物的化学式是 ,属两性化合物,证明这一结论的有关离子方程式为 _____________________________________、
_________________________________________________.
③已知反应Be2C + 4H2O=2Be(OH)2 +CH4↑,则Al4C3遇强碱溶液反应的离子方程式为
④科学家证实,BeCl2属共价化合物,设计一个简单实验证明,其方法是
.
三、实验题(本大题包括两个小题,共20分)
20. (8分)2004年12月23日重庆开县发生了震惊世界的井喷事件,造成了两百多人死亡的悲剧。井喷产生的剧毒气体H2S是通过呼吸道等途径进入人体的,因此,在毒气现场必须穿戴防护衣和防毒面具。有一种生氧防毒面具,它由面罩、生氧罐、呼气管和吸气管等组成。使用时,人体呼出的气体经呼气管进入生氧罐,干燥后,二氧化碳与罐中的过氧化钠反应,产生氧气和碳酸钠,氧气沿吸气管进入面罩。请在下图的方框中补充上述防毒面具的工作原理图,并写出产生氧气的化学方程式。
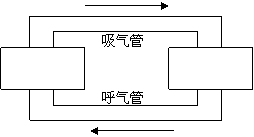

⑴写出产生氧气的化学方程式 。
⑵另写出两种能和水反应生成氧气的化学方程式
|
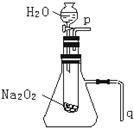
21.(12分)用脱脂棉包住约0.2 g过氧化钠粉末,置于石棉网上,
往脱脂棉上滴水,可观察到脱脂棉剧烈燃烧起来。
(1)由实验现象所得出的有关Na2O2和H2O反应的结论是:
a.有氧气生成;b.__________________________________,
Na2O2和H2O反应的化学方程是:
__ ____________________________________________________。
(2)某研究性学习小组拟用右图装置进行实验,以证明上
述结论。用以验证结论a的实验方法及现象是: _________________________。
用以验证结论b的实验方法及现象是:___________________________________。
(3)实验(2)中往试管内加水至固体完全溶解且不再有气泡生成后,取出试管,往试管中滴入酚酞试液,发现溶液变红,振荡后,红色消褪。为探究此现象,该小组同学查阅有关资料得知:Na2O2与H2O反应可生成H2O2,H2O2具有强氧化性和漂白性。请设计一个简单的实验,证明Na2O2和足量H2O充分反应后的溶液中有H2O2存在。(只要求列出实验所用的试剂及观察到的现象)
试剂:______________________________________________________。
现象:______________________________________________________。
四、计算题(本大题包括一个小题,共10分)
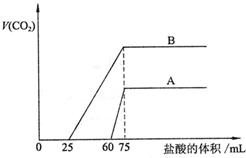
|
(1)曲线A表明,原溶液中通入CO2后,所得溶液中的溶质为(写化学式)
,各种溶质的物质的量之比为 ;加盐酸后产生CO2体积的最大值为 mL。
(2)曲线B表明,原溶液中通入CO2后,所得溶液中的溶质为(写化学式)
;加盐酸后产生CO2体积最大值 mL。
(3)通过计算求出原NaOH溶液的物质的量浓度。
【化学参考答案及评分标准】
一、3×16=48分
1. A 2. B 3. C 4. B 5. D 6. C 7. D 8. A 9. A 10. A 11.B 12. D 13. C
14. D 1 5. B 16.D
二、(共29分)
17.(8分)(1)①![]() (1分) ②
(1分) ②![]() (1分)
(1分)
③![]() (1分)
(1分)
(2)①0 ②-1 ③+2(各1分)(3)![]() (1分)
(1分)
18.(9分)(1)3、2、8、3、2、2、8H2O(3分) (2)K2Cr2O7(1分)CO2(1分)
(3)A(2分) (4)6.02×1023(2分)
19.(2分)时间(2分) 催化效果的对照研究(2分,合理均给分)
20. (8分)(11分) (1) Li2O Li3N (2分)
(2) (5分) Be(OH)2
Be(OH)2 + 2 OH- = BeO22- + 2H2O
Be(OH)2 + 2H+ = Be2+ + 2H2O
(3) Al4C3+4OH—+4H2O==4AlO2— +3CH4 (2分)
(4) 加热至熔融态不导电(2分)
三、实验题(共18分)
21.(9分)
22.(9分)(1)该反应是一个放热反应;2Na2O2+2H2O =4NaOH+O2↑(2分)
(2)将带火星的木条靠近导管口p处,木条复燃; 将导管q放入水中,反应过程中导管口有气泡冒出。(2分)
(3)Na2S溶液 ;溶液变浑浊(其他合理答案也可) (2分)
四、计算题(20分)
23.(7分)(1)(3分) NaOH、Na2CO3 3∶1 33.6 (2)(2分)Na2CO3、NaHCO3 112
(3)(2分)解:图示表明,向溶液中滴加0.1mol/L的盐酸至不再放出CO2气体时,消耗盐酸的体积为75mL。所以原NaOH溶液的物质的量浓度为:
![]() (其它合理解法可得分)
(其它合理解法可得分)