高三化学10月联考试题
命题人 宜昌市一中 管俊宏 审题人宜昌市一中 杨子秀 荆州中学
可能用到的原子量:H-1 C-12 O-16 Na-23 K-39 Cl-35.5 Br-80 Ag-108
一、选择题(本题共18个小题,每小题只有一个选项符合题意,每小题3分,共54分)
1、为我国化学工业作出重大贡献的科学家是
A、邓稼先 B、李四光 C、华罗庚 D、侯德榜
2、t℃时A和B在水中的溶解度相同,则在t℃时A和B的饱和溶液
A、密度相同 B、物质的量浓度相同
C、溶质的质量分数相同 D、溶质的摩尔质量相同
3、发生下列变化时,需要吸收能量的是( )
A、NH4NO3溶于水 B、H++OH-=H2O C、CaO→Ca(OH)2 D、Cl2→Cl-
![]() 4、体积相同的甲乙两个容器中,分别都充有相同物质的量的SO2和O2,在相同温度下发生反应:2SO2(g)+O2(g) 2SO3(g)并达到平衡。在这个过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为P%,则乙容器中SO2的转化率为 ( )
4、体积相同的甲乙两个容器中,分别都充有相同物质的量的SO2和O2,在相同温度下发生反应:2SO2(g)+O2(g) 2SO3(g)并达到平衡。在这个过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为P%,则乙容器中SO2的转化率为 ( )
A、等于P% B、大于P% C、小于P% D、无法判断
5、下列说法错误的是( )
A、分子数为a的某气体,其体积大小与温度有关
B、SO2和SO3中氧原子个数比为2:3
C、NA个16O的质量等于16g
D、相等物质的量的OH-和NH4+所含电子数相等
6、 A元素的原子的L层比B元素的L层少3个电子,B元素原子核外电子比A元素总电子数多5个,则A、B可形成( )
A、共价化合物B2A3 B、离子化合物B2A3
C、共价化合物B3A2 D、离子化合物B3A2
![]() 7、在等温等容条件下有下列气体反应:2A(气)+2B(气)
C(气)+3D(气),现分别从两条途径建立平衡:Ⅰ、A和B的起始浓度均为2mol/L;Ⅱ、C和D的起始浓度分别为2mol/L和6mol/L。下列途述正确的是( )
7、在等温等容条件下有下列气体反应:2A(气)+2B(气)
C(气)+3D(气),现分别从两条途径建立平衡:Ⅰ、A和B的起始浓度均为2mol/L;Ⅱ、C和D的起始浓度分别为2mol/L和6mol/L。下列途述正确的是( )
A、Ⅰ和Ⅱ两途径最终达到平衡时,体系内各气体的浓度相同
B、Ⅰ和Ⅱ两途径最终达到平衡时,体系内各气体的体积分数不同
C、达平衡时,Ⅰ途径的反应速率V(A)等于Ⅱ途径的反应速率V(A)
D、达平衡时,第Ⅰ条途径混和气体密度为第Ⅱ条途径混和气体密度的1/2
8、在一定条件下,分别以高锰酸钾、氯酸钾、过氧化氢为原料制取氧气,当制得同温同压下相同体积的氧气时,三个反应中转移的电子数之比为 ( )
A、1:1:1 B、2:2:1 C、2:3:1 D、4:3:2
9、某同学配制0.1mol·L-1NaOH溶液100mL,下列操作会造成实际浓度偏高的是( )
A、空盘时天平指针指向标尺左边就进行称量
B、把固体烧碱置于纸片上称量
C、定容时俯视容量瓶的刻度线
D、使用在空气中部分变质的NaOH
10、 下列各组中两溶液间的反应,其离子方程式一定相同的是 ( )
A、Ba(OH)2和H2SO4、Ba(OH)2和NaHSO4 B、Na2S和HCl、FeS和HCl
C、KOH和CH3COONH4、Ba(OH)2和NH4Cl D、Cl2和FeBr2、Cl2和MgBr2
11、下列叙述中正确的是( )
A、中和10mL0.1mol/L醋酸与中和100mol0.01mol/L醋酸所需同种碱液的量不同
B、体积相同、pH相等的盐酸和硫酸溶液中,H+的物质的量相等
C、pH=3的甲酸溶液中c(H+)与pH=11的氨水溶液中c(OH-)一定相等
D、锌跟pH=4的盐酸反应比跟pH=3的醋酸溶液反应剧烈
12、电解CuSO4溶液时,若要求达到如下三个目的:①阴极质量增加; ②阳极质量减少; ③电解液中c(Cu2+)不变,则可选取用的电极是( )
A、纯铜作阳极,含Zn.Ag的铜合金作阴极
B、含Zn.Ag的铜合金作阳极,纯铜作阴极
C、用纯铁作阳极,用纯铜作阴极
D、用石墨作阳极,用惰性电极(Pt)作阴极
13、将KCl和KBr混合物13.4 g,溶于水配成溶液,通入过量的氯气,充分反应后,蒸干溶液并灼烧,得到固体物质11.175 g,则配成的溶液中K+、Cl- 、Br-的个数比为
A、1:2:3 B、1:3:2 C、2:3:1 D、3:2:1
14、用铂作电极电解某种溶液,通电一段时间,溶液的pH变小,并且在阳极得到0.56L气体,阴极得到1.12L气体( 相同条件下测定)。由此可知溶液可能是 ( )
A、稀盐酸 B、KNO3溶液 C、CuSO4溶液 D、稀硫酸
15、有一瓶无色气体,可能含有H2S、CO2、HBr、HCl、SO2中的一种或几种。向其中加入过量氯水,得到无色透明溶液,把溶液分成两份;向其中一份中加入盐酸化的BaCl2溶液,出现白色沉淀;向另一份中加入硝酸酸化的AgNO3溶液,也有白色沉淀。则下列结论正确的是 ( )
A、原气体中一定有SO2 B、原气体中肯定有H2S和HBr
C、原气体中肯定有SO2和HCl D、原气体中肯定没有CO2
16、取0.2mol·L-1HX溶液与0.2mol·L-1NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH = 8,则下列说法(或关系式)正确的是 ( )
A、混合溶液中由水电离出的c(OH¯)小于0.2mol·L-1HX溶液中由水电离出的c(H+)
B、c(Na+) = c(X¯) + c(HX) = 0.2mol·L-1
C、c(Na+)-c(X¯) = 9.9×10-7mol·L-1
D、c(OH¯) = c(H+)+c(HX) = 1×10-8mol·L-1
17、标况下,aLCO2气体通过足量Na2O2所得气体与bLNO混合时,可得cL气体,以下表达式错误的是( )
A、若a<b,则![]() (a+b) B、若a<b,则
(a+b) B、若a<b,则![]() (a+b)
(a+b)
C、若a>b,则![]() (a+b) D、若a=b,则
(a+b) D、若a=b,则![]() (a+b)
(a+b)
18、等浓度等体积的NaCl、NaAc、Na2S溶液中阴离子的物质的量的分别为amol、bmol、cmol。则a、b、c的大小关系为( )
A、a=b=c B、c>a>b C、a=b>c D、c>b>a
二、填空题。
19、(10分)利用下列氧化还原反应:Zn+ Hg2+= Hg+ Zn2+,设计一个锌-汞原电池,要求:(1)画出原电池的装置图,注明电极材料和电解质溶液。
(2)写出电池的电极反应式和总反应式。
20、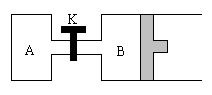 (8分)如图所示,B中隔板可自由滑动。关闭K并向A中充入1 mol X、1 mol Y,向B中充入2 mol X、2 mol Y,起始时,V(A)=V(B)=a L。在相同温度和有催化剂存在的条件下,两容器中各自发生反应:
(8分)如图所示,B中隔板可自由滑动。关闭K并向A中充入1 mol X、1 mol Y,向B中充入2 mol X、2 mol Y,起始时,V(A)=V(B)=a L。在相同温度和有催化剂存在的条件下,两容器中各自发生反应:
2X(g)+2Y(g)![]() Z(g)+2W(g);ΔH<0,
Z(g)+2W(g);ΔH<0,
达到平衡Ⅰ时,V(B)=0.8a L。
请计算:
⑴B中X的转化率α(X)=
⑵B中Z和A中W的物质的量比较:n(Z)B n(W)A
(选填:“>”、“<”或“=”);原因是 (限30个字内)。
⑶打开K,过一段时间重新达到平衡Ⅱ时,B的体积是 L(用含a的代数式表示,连通管中气体体积忽略不计)。
21、(6分)含有农药、染料、酚、氰化物,以及有色、有臭味的废水,常用化学氧化法进行处理。所用的氧化剂有氯类(如液氯、漂白粉、次氯酸钠等)和氧类(如空气、臭氧、过氧化氢、高锰酸钾等)。一个典型实例是用氯氧化法处理含有剧毒的氰化物(含CN—离子)的废水。在碱性条件下(pH为8.5~11),氯气可将氰化物中CN—氧化为比它毒性小1000倍的氰酸盐(含CNO—)。
(1)写出含CN—废水中用氯气氧化,生成氰酸盐的离子方程式 。
(2)若在含CNO—的废水中再通入氯气可使CNO—转化为无毒的气体等,写出这个反应的离子方程式 。
(3)在用液氯不便的地区,可用漂白粉处理含CN—的废水,若将其氧化为CNO—,其离子方程式为 。
22、(12分)海水占地球总储水量的97.2%。若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海洋资源。
(1)海水中含有大量的氯化钠。氯化钠中的金属元素位于元素周期表第 族。
(2)目前国际上实用的“海水淡化”主要技术之一是蒸馏法。蒸馏法是将海水变成蒸汽,蒸汽经过冷却而得高纯度淡水,由此可判断蒸馏法是 (填物理变化、化学变化)
(3)工业上利用电解饱和食盐水可制得重要化工产品,反应式为: 。
利用电解所得气体制36.5%的浓盐酸1000t,最少需要消耗食盐 t。
|
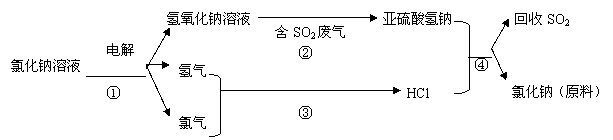 |
写出②④的化学反应方程式:
⑸ 上述亚硫酸氢钠与甲醛经过一定反应,可以合成俗称“吊白块”(雕白粉)的物质。因吊白块对人体有害,不能用于食品漂白。其结构简式为:HOCH2SO3Na,根据其结构特点,吊白块能发生的反应有:
A.皂化反应 B.聚合反应 C.与金属钠反应 D.氧化反应
三、实验题。
23、(9分)实验室为准确测定某盐酸的浓度,通常采用无水苏打(Na2CO3)配成的标准液滴定。其操作是:称取W克纯净无水苏打,放入锥形瓶中,加适量蒸馏水溶解,在酸式滴定管中加入待测盐酸滴定。
⑴ 锥形瓶应加2~3滴指示剂X,因CO2溶于其间会影响pH值,为了结果的准确性, 滴定终点的pH宜选在4~5之间,那么在常见的几种指示剂中宜选用的X是 ,当滴定至溶液颜色由 色变为 色时即表示达到了滴定终点。
⑵ 若滴定终点时,W克苏打消耗盐酸VmL,则盐酸物质的量浓度为
⑶ 若称取的W克无水苏打不纯,则所测盐酸的浓度就不准确。现设盐酸的准确浓度为C1 mol·L-1,滴定时测得盐酸浓度为C2mol·L-1,下列情况下C1与C2的关系是:(填上 >、< 或 = )
① 若苏打中含有小苏打,则C1 C2 ② 若苏打中含有苛性钠,则C1 C2
③ 若苏打中含有结晶水,则C1 C2 ④ 苏打中含有少量食盐,则C1 C2
四、计算题
24、(3分)加热3.24g碳酸钠和碳酸氢钠的混合物至质量不再变化,剩余固体的质量为2.51g。计算原混合物中碳酸钠的质量分数。
25、(6分)将两支惰性电极插入500 mL AgNO3溶液中,通电电解。当电解液的pH从6.0变为3.0时(设电解时阴极没有氢气析出,且电解液在电解前后体积变化可以忽略),电极上析出银的质量大约是多少毫克?
化学试题参考答案
一、选择题
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 选项 | D | C | A | B | B | D | D | B | C |
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 选项 | C | B | A | D | D | A | C | B | B |
二、填空题
| 19.(1)、 (略) (4分) (2)、 正极:Hg2++2e-= Hg (2分)
负极:Zn—2e-=Zn2+ (2分)
总反应:Zn+ Hg2+= Hg+ Zn2+ (2分) |
| 20.(1)、α(X)= 80℅ (2)、n(Z)B 〉 n(W)A ; 原因是 (略) (3)、 0.2a L (每空2分) |
| 21.(1)、 Cl2+CN-+H2O=CNO-+2Cl-+2H+ (2)、 2CNO-+3Cl2+2H2O=2CO2↑+N2↑+6Cl-+4H+ (3)、 ClO-+CN-=Cl-+CNO- (每空2分) |
| 22.(1)、 IA (1分 ) 。 (2)、 物理变化 (1分) 。 (3)、2NaCl+2H2O=2NaOH+H2↑+Cl2↑; 585 t。 (4)、反应② NaOH+SO2=NaHSO3 ;反应④NaHSO3+HCl=NaCl+H2Cl+SO2↑。 (5)、 C 、D 。(其余每空2分) |
三、实验题
| 23.(1)、X是 甲基橙 ; 由 黄 色变为 橙 色。 (2)、浓度为 W /(0.053V) (2分) (其余每空1分) ⑶、① C1 < C2 ; ② C1 > C2 ; ③ C1 < C2 ; ④ C1 < C2。 |
四、计算题
24、38.9℅(3分) 25、54mg(6分)