高三化学一轮复习综合模拟试题四
一、选择题(1——9题,每题2分,10——19题每题3分,共48分)
1. 下列变化过程中无化学键断裂或生成的是
A.石墨转化为金刚石 B.NaCl晶体溶于水 C.干冰升华 D.氮的固定
2.对于易燃、易爆有毒的化学物质,往往会在其包装上贴上危险警告标签。下面所列
物质,贴错了包装标签的是
| A | B | C | D | |
| 物质化学式 | 浓HNO3 | CCl4 | P4 | KClO3 |
| 危险警告标签 |
腐蚀性 |
易燃的 |
有毒的 |
爆炸性 |
3.某无色溶液中滴入酚酞试液显红色,该溶液中可以大量共存的离子组是
A.Mg2+、Al3+、HCO3-、SO32- B.K+、Ca2+、MnO4-、Cl-
C.Ba2+、Na+、AlO2-、NO3- D.NH4+、Fe3+、SO42-、SCN-
4.从海水中提取镁,可按如下步骤进行:
① 把贝壳制成石灰乳;②在引入的海水中加入石灰乳,沉降、过滤、洗涤沉淀物;3将沉淀物与盐酸反应,结晶过滤、在HCl气体氛围中干燥产物;④将得到的产物熔融电解得到镁。下列说法不正确的是
A.此法的优点之一是原料来源丰富 B.第④步电解时阴极产生氯气
C.①②③步骤的目的是从海水中提取MgCl2
D.以上提取镁的过程中涉及化合、分解和复分解反应
5、 今有甲、乙、丙三瓶等体积的新制氯水,浓度均为 0 . 1 mol / L 。如果在甲瓶中加人少量的 NaHCO3 晶体( m mol ) ,在乙瓶中加人少量的 NaHSO3 晶体( m mol ) ,丙瓶不变。片刻后,甲、乙、丙三瓶溶液中 HC10 的物质的量的浓度大小关系是(溶液体积变化忽略不计)。
A 甲>乙>丙 B 甲>丙>乙 C 丙>甲>乙 D 乙>丙>甲
6、在一定温度下,向饱和烧碱溶液中放人一定质量的过氧化钠,充分反应后,使之恢复到原来温度。下列说法正确的是
A .溶液中 Na+浓度增大,有O2放出 B溶液 pH不变,有H2放出
C溶液中 Na+数目减少,有O2放出 D 溶液 pH 增大,有O2放出
7、能用离子方程式H++OH-=H2O表示的反应是
A 稀醋酸和稀氨水反应 B 稀硫酸和烧碱溶液反应
C 稀盐酸和氢氧化铜反应 D 稀硫酸和氢氧化钡溶液反应
8、下列有关试剂的保存方法,错误的是
A 碘化银保存在无色玻璃试剂瓶中 B 少量的钠保存在煤油中
C 氢氧化钠溶液保存在具橡胶塞的玻璃试剂瓶中
D 新制的氯水通常保存在棕色玻璃试剂瓶中
9.仅用一种试剂鉴别如下物质:苯、CCl4、NaI溶液、NaCl溶液、Na2SO3溶液,下列试剂中不能选用的是( )
A.溴水 B.FeCl3溶液 C酸性KMnO4 D.AgNO3溶液
10. 下图是周期表中短周期的一部分,若![]() 原子最外层的电子数比次外层少了3个,则下列说法正确的是
原子最外层的电子数比次外层少了3个,则下列说法正确的是
A.a、b、c的最高价氧化物对应水化物的酸性强弱的关系是c>b>a
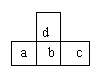 B.d的最高正价与b的最高正价相等
B.d的最高正价与b的最高正价相等
C.d与c不能形成化合物
D.原子半径的大小顺序是c>b>a>d
11. a、b、c、d、e分别是Cu、Ag、Fe、Al、Mg 5种金属中的一种。已知:(1) a、c均能与稀硫酸反应放出气体;(2) b与d的硝酸盐反应,置换出单质d;(3) c与强碱反应放出气体;(4) c、e在冷浓硫酸中发生钝化。由此可判断a、b、c、d、e依次为
A. Fe Cu Al Ag Mg B. Al Cu Mg Ag Fe
C. Mg Cu Al Ag Fe D. Mg Ag Al Cu Fe
12.法医检验指纹时,常在待检处喷洒少量某种溶液,自然干燥后用强光照射待检处即可显示指纹。此溶液是( )
A、CuSO4 B、KMnO4 C、FeCl3 D、AgNO3
13、溶液的配制过程能引起浓度偏高的是( )
1配制一定物质的量浓度的H2SO4溶液时,最后在容量瓶中加水至标线,塞好塞子倒转摇匀后,发现液面低于标线
2在100m L 无水乙醇中加入2g碘片溶解后配制2%的碘酒溶液
3在80m L水中加入18.4mol/LH2SO4溶液20m L,配制3.68mol/L的稀硫酸
410%H2SO4和90%H2SO4溶液等体积混合配制50%的H2SO4溶液
5质量分数为5x%和x%的两种氨水等体积混合配制3x%的氨水
A、1 2 4 B、234 C、1 3 5 D、3 4 5
14. 空气是人类生存所必需的重要资源。为改善空气质量而启动的“蓝天工程”得到了全民的支持。下列措施不利于“蓝天工程”建设的是
A.推广使用燃煤脱硫技术,防治SO2污染 B.实施绿化工程,防治扬尘污染
C.研制开发燃料电池汽车,消除机动车尾气污染
D.加大石油、煤炭的开采速度,增加化石燃料的供应量
15. 将5.4g Al 投入到200.0mL 2.0mol·L-1的某溶液中有氢气产生,充分反应后有金属剩余。该溶液可能为
A.HNO3溶液 B.Ba(OH)2溶液 C.H2SO4溶液 D.HCl溶液
16. X、Y、Z是3种短周期元素,其中X、Y位于同一主族,Y、Z处于同一周期。X原子的最外层电子数是其电子层数的3倍。Z原子的核外电子数比Y原子少1。下列说法不正确的是
A.元素非金属性由弱到强的顺序为Z<Y<X
B.Y元素最高价氧化物对应水化物的化学式可表示为H3YO4
C.3种元素的气态氢化物中,Z的气态氢化物最不稳定
D.原子半径由大到小的顺序为Z>Y>X
17.一定能在下列溶液中大量共存的离子组是
A.含有大量Al3+的溶液:Na+、NH4+、SO42-、Cl-
B.c(H+)=1×10-13mol·L-1的溶液:Na+、Ca2+、SO42-、CO32-
C.含有大量Fe3+的溶液:Na+、Mg2+、NO3-、SCN-
D.含有大量NO3-的溶液:H+、Fe2+、SO42-、Cl-
18.配制100m L1.0mol/LnNa2CO3溶液,下列操作正确的是( )
A、 称取10.6g无水碳酸钠,加入100m L容量瓶中,加水溶解、定容
B、 称取28.6Na2CO3·10H2O,加入100m L蒸馏水,搅拌、溶解、
C、 转移Na2CO3溶液时,未用玻璃棒引流,直接倒入容量瓶中
D、 定容后,塞好瓶塞,反复倒转、摇匀
19. 下表中,对陈述Ⅰ、Ⅱ 的正确性及两者间是否具有因果关系的判断都正确的
| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | 工业生产硫酸用水吸收SO3 | SO3可与水反应 | Ⅰ对,Ⅱ对,有 |
| B | Cl2与SO2混合后可用于漂白纸张 | Cl2和SO2有较好的漂白作用 | Ⅰ对,Ⅱ错,无 |
| C | 金属钠具有强还原性 | 高压钠灯发出透雾性强的黄光 | Ⅰ对,Ⅱ对,有 |
| D | 石墨常用作电解池的电极 | 石墨的化学性质稳定且导电性好 | Ⅰ对,Ⅱ对,有 |
二、简答题(共52分)
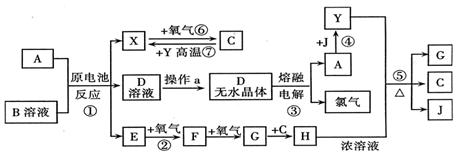
20.(16分)A、B、C、D、E、F、G、H、I、J均为中学化学中常见物质,其相互转化的关系如下所示:已知,A的焰色反应呈黄色,I是一种红褐色沉淀。
⑴写出下列物质的化学式:B:NaOH ;E:Fe ;D: H ;H: Fe(OH) 。
⑵常温下C是黄绿色气体:
①写出A的电极反应方程式:阴极: 2H++2e-=H↑(或2HO+2e-=H↑+2OH-) ;
阳极: 2Br--2e -=Br ;
②写出H→I的化学方程式:4Fe(OH)+O+2HO=4Fe(OH) ↓;
③G与足量Cl2反应的离子方程式:2Fe2++4Br-+3Cl=2Fe3++2Br+6Cl- 。
21.(12分)A、B、C、D、E、F六种物质的相互转化关系如图所示
(反应条件未标出):
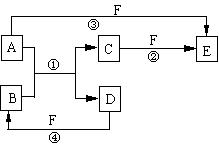
(1) 若A是常见的金属单质,D、F是短周期元素的气体单质,反应①在水溶液中进行,则反应②(在水溶液中进行)的离子方程式是 ;
F元素的原子结构示意图为 。
(2)若将E 的水溶液蒸干后再灼烧,最后得到的主要固体产物是 ;其理由是(用化学方程式表示,并配以必要的文字说明)
。
(3)将D与F可制成新型的化学电源(KOH做电解质溶液),两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电,则正极通入 气体;负极电极反应式为 。
(4)已知1 g D与适量F反应生成B时放出92.3 kJ热量,写出该反应的热化学方程式
。
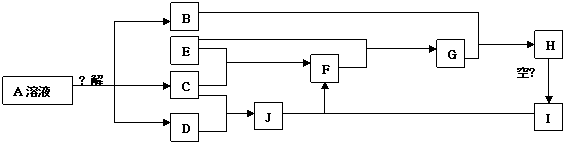
22.(11分)某研究性学习小组为测定某FeCl3样品(含少量FeCl2杂质)中铁元素的质量分数,设计了如下实验步骤:
①准确称量样品质量a g;
②向样品中加入10mL 6mol·L-1的盐酸,样品溶解后再加入蒸馏水配成100mL溶液;
③向上述溶液中加入3mL氯水,搅拌使其反应完全;
④加入10%的氨水至过量,充分搅拌,使沉淀完全;
⑤过滤,将沉淀洗涤后干燥;
⑥将沉淀移至坩埚中,灼烧、冷却、称重,并反复操作多次至固体完全反应。试回答问题:
(1)写出步骤④中产生沉淀的离子方程式:________________________。
(2)确认步骤④沉淀已经完全的方法是____________________________________。
(3)洗涤沉淀的操作方法是______________________________________________;
如何检验沉淀是否洗净,其方法是________________________________________。
(4)在步骤⑥中,判断固体反应完全的方法是:
(5)若空坩埚质量为b g,充分灼烧固体完全反应后,剩余固体和坩埚的总质量为
c g,则样品中铁元素的质量分数是______________________×100%
23.(13分)已知A为中学化学中的常见金属,X、Y为常见非金属,A、X、Y都位于周期表中短周期。其中A、Y常温下为固体,X、E、F、G、J常温下为气体,C为无色液体,B是一种盐,受热易分解,分解产物为E和HCl。现用A与石墨作电极,BCY的浓溶液作电解质,构成原电池。有关物质之间的转化关系如下图(部分反应的条件、生成物被略去):
|
请填写下列空白:
(1)金属A为 ;操作a是将D溶液在HCl气流中蒸干,原因是
。
(2)反应②的化学方程式为: ;
反应⑤的化学方程式为: 。
(3)原电池反应①中,正极反应式为: 。
答案:
20、(1)NaOH、Fe、H2、Fe(OH)2
(2)4Fe(OH)2 + O2 + 2H2O==4Fe(OH)3
2Fe2+ + Cl2 ==2Fe3+ + 2Cl—
21、(共12分)
(1) 2Fe2++Cl2 = 2Fe3++2Clˉ(2分) ;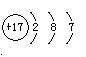 (1分)
(1分)
(2) Fe2O3(1分);FeCl3溶液中存在如下水解平衡:FeCl3 + 3H2O ![]() Fe(OH)
3 +3HCl (1分),在加热蒸干时HCl挥发上述平衡右移,最终全部生成Fe(OH) 3(1分),灼烧Fe(OH) 3分解,2Fe(OH) 3
Fe(OH)
3 +3HCl (1分),在加热蒸干时HCl挥发上述平衡右移,最终全部生成Fe(OH) 3(1分),灼烧Fe(OH) 3分解,2Fe(OH) 3 ![]() Fe2O3
+ 3H2O(1分),所以最后固体产物为
Fe2O3.
Fe2O3
+ 3H2O(1分),所以最后固体产物为
Fe2O3.
(3)Cl2(1分);H2 —2eˉ + 2OH-==2H2O(2分)
(4)H2 (g) +Cl2 (g) = 2HCl(g) ;△H =-184.6 kJ·mol-1(2分)
22. 【答案及评分标准】第(4)1分外,其余每空2分,共11分。
(1)Fe3++3NH3·H2O=Fe(OH)3↓+3NH4+,
(2)从滤液中取少量上层清液于小试管中,再滴加氨水,如果没有沉淀产生,则说明沉淀已经完全,否则就是沉淀没有完全。 (或:从滤液中取少量上层清液于小试管中,再滴加KSCN溶液,如果没有血红色出现,则说明沉淀已经完全,否则就是沉淀没有完全。)
(3)向过滤器中加入少量蒸馏水至水面没过沉淀,等水滤出后,重复操作数次;
取少量最后一次所得的洗涤液,加入少量AgNO3溶液,若有白色沉淀生成,表明沉淀未洗净,若无白色沉淀生成则表明沉淀已洗净。
(4)连续两次称重,质量没有变化。(5)
23. 
![]() (13分)(1)Mg,防止Mg2+水解(每空2分,共4分)
(13分)(1)Mg,防止Mg2+水解(每空2分,共4分)
(2)4NH3+5O2 4NO+5H2O C+4HNO3(浓) CO2↑+4NO2↑+2H2O
(3)2NH4++2e- →2NH3↑+H2↑(每空3分,共9分)