高三化学上册期中考试试卷
高三化学试题
第Ⅰ卷(选择题,共54分)
一 选择题(共18题每小题3分。每小题只有1个最佳选项符合题意,共54分)
1、若发现位于元素周期表第七横行. 第十七纵行列的元素的一种原子,该原子的质量数为280,则该原子核内的中子数为 ( )
A,163 B,164 C,165 D,166
2.通过分析周期表结构和各元素性质的变化趋势,判断砹(原子序数为85)及其化合物的叙述正确的是 ( )
A.由KAt的水溶液制备At的化学方程式为2KAt + Cl2 == 2KCl +At2
B.相同条件下,HAt比HI难分解
C.AgAt是一种易溶于水的固体
D.At在第五周期VIIA族
3.下列说法正确的是 ( )
A.含有离子键的化合物一定是离子化合物 B.共价化合物中只含有极性键
C.含有共价键的化合物一定是共价化合物 D.非极性键只存在于单质分子中
4.许多国家十分重视海水资源的综合利用。不需要化学变化就能够从海水中获得的物质是 ( )
(A)氯、溴、碘 (B)钠、镁、铝 (C)烧碱、氢气 (D)食盐、淡水
5.某溶液中含有的溶质是FeBr2、FeI2,若向该溶液中通入一定量的氯气,再向反应后的溶液中滴加少量的KSCN溶液,结果溶液变为血红色,则下列叙述正确的是: ( )
① 原溶液中的Br-一定被氧化②通入氯气后原溶液中的Fe2+一定被氧化
③不能确定通入氯气后的溶液中是否存在Fe2+
④若取少量所得溶液,加入CCl4,静置,向上层溶液中加入足量的AgNO3溶液,只产生白色沉淀,说明原溶液中的I-、Fe2+、Br-均被完全氧化
A.①②③ B.②③④ C.①③④ D.①②③④
6.在一定条件下,将钠与氧气反应的生成物1.5 g溶于水,所得溶液恰好能被 80 mL浓度为0.50 mol/L的HCl溶液中和,则该生成物的成分是( )
(A)Na2O (B)Na2O2 (C)Na2O和Na2O2 (D)Na2O2和NaO2
|
Al2O3 + N2 + 3 C === 2 AlN + 3 CO 下列叙述正确的是( )
A.在氮化铝合成反应中,N2是还原剂,Al2O3是氧化剂
B.氮化铝晶体属于分子晶体 C.氮化铝中氮元素化合价为—3
D.上述反应中每生成2 mol AlN,N2得到3 mol电子
8.下列叙述正确的是 ( )
(A)分子晶体中的每个分子内一定含有共价键
(B)原子晶体中的相邻原子间只存在非极性共价键
(C)离子晶体中可能含有共价键(D)金属晶体的熔点和沸点都很高
9.某无色气体可能含有H2S、SO2、CO2、HI、HCl气体中的一种或几种。将气体通入氯水后得无色溶液,向该溶液中滴加氯化钡溶液产生白色沉淀。则下列叙述正确的是 ( )
A.该气体中肯定含有H2S和SO2 B.该气体中肯定含有SO2
C.该气体中肯定含有CO2和SO2 D.该气体中肯定含有H2S、CO2和HI
10.有BaCl2和NaCl的混合溶液a L,将它均分成两份。一份滴加稀硫酸,使Ba2+离子完全沉淀;另一份滴加AgNO3溶液,使Cl-离子完全沉淀。反应中消耗x mol H2SO4、y mol AgNO3。据此得知原混合溶液中的c(Na+)/mol·L-1为: ( )
(A)(y-2x)/a (B)(y-x)/a (C)(2y-2x)/a (D)(2y-4x)/a
11.氢能是一种既高效又干净的新能源,发展前景良好,用氢作能源的燃料电池汽车倍受青睐。我国拥有完全自主知识产权的氢燃料电池轿车“超越三号”,已达到世界先进水平,并加快向产业化的目标迈进。氢能具有的优点包括( )
错误!未找到引用源。原料来源广 错误!未找到引用源。易燃烧、热值高 错误!未找到引用源。储存方便 错误!未找到引用源。制备工艺廉价易行
(A)错误!未找到引用源。错误!未找到引用源。 (B)错误!未找到引用源。错误!未找到引用源。 (C)错误!未找到引用源。错误!未找到引用源。 (D)错误!未找到引用源。错误!未找到引用源。
12.用6.02×1023表示阿伏加德罗常数(NA)的值,下列说法中正确的是: ( )
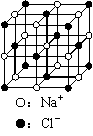 A.在SiO2晶体中,若含有1mol Si原子,则含Si—O
A.在SiO2晶体中,若含有1mol Si原子,则含Si—O
键数为2NA
B.6.8 g熔融的KHSO4中含有6.02×1022个阳离子
C.23.4 g NaCl晶体中含有6.02×1022个右图所示的结构单元
D.用含有0.1molFeCl3的饱和溶液制得的氢氧化铁胶体中,
胶粒数等于0.1 NA
13.四种主族元素的离子aXm+、bYn+、cZn-和dRm-(a、b、c、d为元素的原子序数),它们具有相同的电子层结构,若m > n,对下列叙述的判断正确的是: ( )
① a-b=n-m;② 元素的原子序数a > b > c > d;③ 元素非金属性Z > R;
④ 最高价氧化物对应水化物碱性X > Y。
A.②③正确 B.只有③正确 C.①②③④正确 D.①②③正确
14.有两种短周期元素X和Y,可以组成XY3,当Y的原子序数为M时,X的原子序数可能为 ① M—4② M+4 ③ M+8 ④ M-2 ⑤ M+6,其中正确的是( )
A.①②④ B.①②③⑤ C.①②③④⑤ D.①②⑤
15.下列具有特殊性能的材料中,由主族元素和副族元素形成的是( )
A.透明陶瓷材料硒化锌 B.吸氢材料镧镍合金
C.半导体材料砷化镓 D.新超导材料K3C60
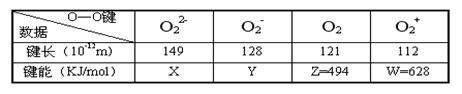 16.从实验测得不同物质中O—O之间的键长和键能的数据如下表所示:
16.从实验测得不同物质中O—O之间的键长和键能的数据如下表所示:
其中X、Y的键能数据尚未测定,但可根据规律性推导键能大小顺序为:
W>Z>Y>X。则该规律性是 ( )
A.成键时电子数越多,键能越大 B.键长越长,键能越小
C.成键所用电子数越少,键能越大 D.成键时电子对越偏移,键能越大
17.类推的思维方式在化学学习与研究中经常采用,但类推出的结论是否正确最终要经过实践的验证。以下类推的结论正确的是 ( )
A.由“Cl2+H2O=HCl+HClO”反应可推出 “F2+H2O =HF+HFO” 反应也能发生
B.NaCl与CsCl化学式相似,故NaCl与CsCl的晶体结构也相似
C.由“2Fe+3Cl2=2FeCl3”反应可推出“2Fe+3I2=2FeI3”反应也能发生
D.Na.K具有强还原性,Na常温下与水剧烈反应,故K常温下也能与水剧烈反应
18.最新研究表明生命起源于火山爆发,是因为火山爆发产生的气体中含有1%的硫化羰(COS),已知硫化羰分子中所有原子均满足八电子结构,结合所学元素周期表知识,下列说法正确的是 ( )
A.硫化羰分子中三个原子不在同一直线上 B.硫化羰属于非极性分子
![]() C.硫化羰沸点比CO2低
D.硫化羰的电子式为
C.硫化羰沸点比CO2低
D.硫化羰的电子式为
第Ⅱ卷(非选择题,共46分)
二 填空题(本大题包括5小题,共46分)
19.(8分) 据著名网站-网易报道,意大利科学家使用普通氧分子和带正电的氧化离子作用,制出了新型的氧分子O4,它的结构很复杂,可能具有与S4相似的长方形结构。
(1)下列有关O4的说法正确的是
A.O4分子内存在极性共价键
B.合成O4的反应可看作核聚变反应,即不属于化学变化
C.O4与O3、O2都是氧的同素异形体
D.O4将来可用作更强有力的火箭推进的氧化剂
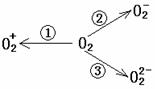 (2)制备O
(2)制备O![]() 、O
、O![]() 甚至O
甚至O![]() 的化合物是可能存在的,通常它们是在氧分子进行下列各种反应时生成的:
的化合物是可能存在的,通常它们是在氧分子进行下列各种反应时生成的:
上述反应中, (填序号)相当于氧分子的氧化; (填序号)相当于氧分子的还原。
(3)写出O22-的电子式:
。(4)O2[PtF6]是一种含有O![]() 的化合物,请写出一种含有O
的化合物,请写出一种含有O![]() 的氧化物的化学式:
的氧化物的化学式:
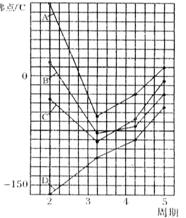 20.(6分)右图中A、B、C、D四条曲线是表示ⅣA、ⅤA、ⅥA、ⅦA族元素的气态氢化物的沸点变化曲线,其中A、D 分别表示 、 族元素气态氢化物的沸点变化;同一族中第3、4、5周期元素的气态氢化物沸点依次升高,其原因是
;
20.(6分)右图中A、B、C、D四条曲线是表示ⅣA、ⅤA、ⅥA、ⅦA族元素的气态氢化物的沸点变化曲线,其中A、D 分别表示 、 族元素气态氢化物的沸点变化;同一族中第3、4、5周期元素的气态氢化物沸点依次升高,其原因是
;
图中第2周期有三种元素的气态氢化物沸点显著高于相应的同族第3周期元素气态氢化物的沸点,其原因是
。
21.(10分)下表列出了前20号元素中的某些元素性质的有关数据:
| 元素编号 元素性质 | 错误!未找到引用源。 | 错误!未找到引用源。 | 错误!未找到引用源。 | 错误!未找到引用源。 | 错误!未找到引用源。 | 错误!未找到引用源。 | 错误!未找到引用源。 | 错误!未找到引用源。 | 错误!未找到引用源。 | 错误!未找到引用源。 |
| 原子半径(10-10m) | 1.52 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 0.71 |
| 最高价态 | +1 | +1 | - | +3 | +4 | +5 | +7 | +1 | +5 | - |
| 最低价态 | - | - | -2 | - | -4 | -3 | -1 | - | -3 | -1 |
试回答下列问题:(1)以上10种元素的原子中,失去核外第一个电子所需能量最少的是 (填写编号);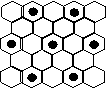 (2)上述错误!未找到引用源。、错误!未找到引用源。、错误!未找到引用源。三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质可能是 (写分子式)。某元素R的原子半径为1.02×10-10m,该元素在周期表中位于 ;若物质Na2R3是一种含有非极性共价键的离子化合物,请你写出该化合物的电子式 ;
(2)上述错误!未找到引用源。、错误!未找到引用源。、错误!未找到引用源。三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质可能是 (写分子式)。某元素R的原子半径为1.02×10-10m,该元素在周期表中位于 ;若物质Na2R3是一种含有非极性共价键的离子化合物,请你写出该化合物的电子式 ;
(3)元素错误!未找到引用源。的某种单质具有平面层状结构,同一层中的原子构成许许多多的正六边形,此单质与熔融的错误!未找到引用源。单质相互作用,形成某种青铜色的物质(其中的元素错误!未找到引用源。用“●”表示),原子分布如图所示,则该物质的化学式为 。
22.(10分)位于短周期的四种主族元素A、B、C、D原子序数依次增大,已知A、C位于同一主族,A在周期表中原子半径最小。B、D的最外层电子数相等,且B、D的原子序数之和为A、C原子序数之和的两倍。根据你的推断回答下列问题:
(1)写出元素符号:A 、B ;
 (2)A、B、D间可形成甲、乙两种微粒,它们均为负一价双原子阴离子,且甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为 ;
(2)A、B、D间可形成甲、乙两种微粒,它们均为负一价双原子阴离子,且甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为 ;
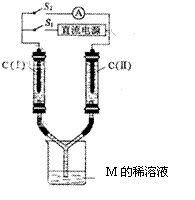
(3)如图所示装置,两玻璃管中盛满A、B、C三种元素组成的化合物M的稀溶液,C(Ⅰ)、C(Ⅱ)为多孔铂电极。接通S1后,两玻璃管中有气体生成,C(Ⅰ)极的玻璃管内的气体约是C(Ⅱ)的二分之一。一段时间后(两玻璃管中液面未脱离电极),断开S1 ,接通S2,电流表的指针发生偏转。此时:
① C(I)的电极名称是 (填写“正极”或“负极”);
② C(II)的电极反应式是 。
23.(12分)a、b、c、d、e是短周期元素,周期表中a与b、b与c相邻;a与e的最外层电子数之比为2:3,b的最外层电子数比e的最外层电子数少1个;常见化合物d2c2与水反应生成c的单质,且溶液使酚酞试液变红。
(1)e的元素符号是__________。
(2)a、b、c的氢化物稳定性顺序为(用分子式表示)__________________;b的氢化物和b的最高价氧化物的水化物反应生成Z,则Z中的化学键类型为__________________,Z的晶体类型为_____________;ab-离子的电子式为____________。
(3)由a、c、d形成化合物的水溶液显碱性,其原因是(用离子方程式表示)_____________________________________。
(4)一定量的d2c2与ac2反应后的固体物质,恰好与0.8 mol稀盐酸溶液完全反应,并收集到0.25 mol气体,则用物质的量表示该固体物质的组成为__________________、___________________。
高三化学试题答案
一,选择题(共18小题,每题3分,共54分)
1.A 2.A 3.A 4.D 5.B 6.C 7.C 8.C 9.B 10.D 11.B 12.A 13.A 14.C 15.A 16.B 17.D 18.D
二.非选题(共5小题,计46分)
19(8分)(1)CD (2)①;②③
(3)[: O : O :]2- (4)KO2
20.(6分)VIA(1分) ⅣA(1分)、随着相对分子质量增大,分子间作用力增大(2分)它们分子间存在氢键,分子间作用力增大(2分)
21.(10分)(1)②;(2)PCl3或CCl4、第三周期ⅥA族、![]() ;(3)KC8
;(3)KC8
22.(10分)(1)H 、O(2分); (2)HS- + OH- =S2-+ H2O(2分);
(3)正极(2分),H2 + 2OH--2e- == 2H2O(2分)
23(12分)(1)S
(2)CH4<NH3<H2O; 共价键和离子键; 离子晶体; ![]() 。
。
(3)CO32 -+H2O![]() HCO3- +OH- 或 C2O42 -+H2O
HCO3- +OH- 或 C2O42 -+H2O![]() HC2O4- +OH-。
HC2O4- +OH-。
(4)0.3 mol Na2O2、0.1 mol Na2CO3