高考理科综合课堂模拟练习化学部分试题2
可能用到的相对原子质量:H: 1 O: 16 N: 14 C:12 Na: 23 Cl: 35.5 Hg: 201
 C: 12 Zn:65 Cu:64 Mg:24 Fe:56
C: 12 Zn:65 Cu:64 Mg:24 Fe:56
一、选择题:(下列各题只有一个选项符合题意。共50分)
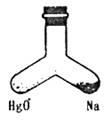
1.在右图支管中,一管装入2.3g 金属钠,一管装入HgO,同时加热两部分,Na完全烧烧,若加热后容器里空气成分基本未变,则HgO质量可能是
A.21.7g B.24g
C.43.4g D.10.85g
2.一定温度下,某容积不变的密闭容器中,反应2SO2(g)+O2(g)![]() 2SO3(g)达到平衡状态,此时测得各物质的浓度分别是:c(SO2)=2.0
mol/L、c(O2)=0.8
mol/L、c(SO3)=2.4
mol/L,则二氧化硫起始浓度的取值范围是
2SO3(g)达到平衡状态,此时测得各物质的浓度分别是:c(SO2)=2.0
mol/L、c(O2)=0.8
mol/L、c(SO3)=2.4
mol/L,则二氧化硫起始浓度的取值范围是
A.0~4.0 mol/L B.0.4 mol/L~4.0 mol/L
C.0.4 mol/L~ 4.4 mol/L D.无法确定
3.造纸工业中常用Cl2漂白纸浆,漂白后的纸浆用NaHSO3除去残留的Cl2,其反应为:Cl2+NaHSO3+H2O→ NaCl+H2SO4+HCl在这个反应中,氧化产物与还原产物的物质的量之比为
A.2:3 B.1: 1 C.2:1 D.1:2
4. 烧过菜的铁锅未及时洗涤(残液中含NaCl等),第二天便出现红棕色锈斑[Fe(OH)3失水的产物]。下列反应表示整个过程可能发生的变化,其中不符合事实的是
A.![]() B.
B.![]()
C.![]() D.
D.![]()
5..将20克NaOH与20克NH4NO3分别加入盛有50毫升水的两只烧杯中,充分搅拌,使它们溶解,然后把盛有少量乙醚液体的试管浸入新配制的NaOH溶液中,用明火接近试管口,能产生黄色火焰,再把此试管浸入新制的NH4NO3溶液中,发现黄色火焰由长变短,直至熄灭。与上述两实验有联系的选项是
①乙醚着火点低 ②NaOH溶于水能放出大量的热
③NH4NO3溶于水能吸收大量热 ④乙醚的沸点较低
A.①②③ B.①③④ C.②③④ D.①②③④
6.下列各组物质的熔点均由高到低的排列,其原因是键能逐渐减小排列的一组是
A.MgO、NaF、HF B.金刚石、晶体硅、碳化硅
C.Al、Na、干冰 D.HI、HBr、HCl
7.将一定量的钠、铝合金置于水中,合金全部溶解,得到20mlpH=14的溶液。然后用1mol/L的盐酸滴定到沉淀量达到最大时,消耗盐酸40ml,原合金中铝的质量为
A.0.92克 B.0.46克 C. 0.54克 D. 0.135克
8.工业上制备硝酸的尾气中,尚还有少量未被味收的NO和NO2,如果不加处理就排放到空气中,会造成污染。为消除氮的氧化物对大气的污染,变废为宝,常用碱液(NaOH)吸收尾气中的氮的氧化物,使之转化为相应的硝酸钠、亚硝酸钠和水,依据上述原理,判断下列混合气体不可能被NaOH溶液完全吸收的是
A.1mol O2和4mol NO2 B.1mol NO和4mol NO2
C.1mol O2和4mol NO D.4mol NO和1mol NO2
9. 某固体仅由一种元素组成,其密度为5.0g/cm3。用X射线研究该固体的结构时得知:在边长为10-7cm的正方体中含有20个原子,则此元素的相对原子质量最接近于下列数据中的
A.32 B.120 C.150 D.180
二、填空简答
10.(6分)在氯酸钾的分解反应里,关于二氧化锰的催化问题,到目前还没有肯定的解释。鉴于反应制得的氧气中有氯气的气味,生成的氯化钾又略带紫红色的客观事实,一种分析认为其反应过程如下:
①![]() ②
②![]() ③B+D=2KCl+
③B+D=2KCl+![]()
试判断:(1)氯酸钾分解的总反应方程式 ;
(2)反应①中的氧化剂是 ;
(3)反应③的化学方程式为 ;
(4)按上述的反应过程,若要制取1.5 mol氧气,总共有 mol电子转移。
11.(8分)在真空密闭容器内加入 amolPH4I固体,在一定温度下发生如下反应:
PH4I(固) ![]() PH3(气)+HI(气),4PH3(气)
PH3(气)+HI(气),4PH3(气) ![]() P4(气)+6H2(气),2HI(气)
P4(气)+6H2(气),2HI(气) ![]() H2(气)+I2(气)
H2(气)+I2(气)
以上三反应建立平衡后,测得HI为bmol、I2(气)为cmol、H2为dmol。求:
⑴平衡后,容器内P4(气)和PH3的物质的量(用代数式表示):
n(P4)= ;n(PH3)= ;
⑵a、b、c三者的关系服从a> (填含a、b、c的代数式);
b、c、d三者的关系服从b> (填含c、d的代数式)。
⑶平衡后,增大压强,容器内n(I2) ;n(PH3) (增加、减小、不变)。
12.(12分)阅读下文,并回答(1)~(4)小题。
20世纪90年代,国际上提出了“预防污染”的根本手段,它的目标是研究和寻找能充分利用的无毒害原材料,最大限度地节约能源,在化工生产各环节能都实现净化和无污染的反应途径。
(1)下列各项属于“绿色化学”的是( )。
A.处理废弃物 B.治理污染点 C.减少有毒物 D.杜绝污染源
(2)在我国西部大开发中,某省为筹建一大型化工基地,征集到下列方案,其中你认为可行的是( )。
A.建在西部干旱区可以脱贫致富
B.应建在水资源丰富和交通方便的远离城市的郊区
C.企业有权自主选择厂址
D.不宜建在人口稠密的居民区
(3)对聚丙烯酸废弃物(白色污染物中的一种)的降解,国际上最新采用了热聚门冬氨酸或其盐(TPA),它有效、廉价,且自身可被生物降解,从而减少对环境的污染。它是由单体MO—CO—CH2—CH(OH)—CO—NH2聚而成。请用键线式写出TPA的结
构: 。
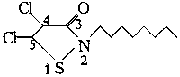 (4)1996年美国罗姆斯公司G.L.Willingham等人研制出对环境安全的船舶防垢剂——“海洋9号”而获得了美国“总统绿色化学挑战奖”。“海洋9号”的结构简式如右式。
(4)1996年美国罗姆斯公司G.L.Willingham等人研制出对环境安全的船舶防垢剂——“海洋9号”而获得了美国“总统绿色化学挑战奖”。“海洋9号”的结构简式如右式。
试回答下列问题:
①“海洋9号”的化学式为
;
②4,5位碳原子上连接的两个氯原子能否发生取代反应? (填“能”或“不能”),如能发
生,请举一例,用化学方程式表示 。
三、实验设计
13.(7分)有一瓶NaNO3溶液,混入少量的Ca(H2PO4)和NaBr,请设计一个实验方案,除去NaNO3溶液中混入的杂质
供选用的试剂:①稀盐酸 ②稀硝酸 ③稀硫酸 ④NaOH溶液 ⑤KOH溶液 ⑥Na2CO3溶液 ⑦AgNO3溶液 ⑧K2CO3溶液
要求:选用试剂不超过四种,同种试剂不得重复使用。
(1)请在下列操作顺序的括号内填入所加物质的化学式
![]() 加入( )
加入( ) 加入( )
加入( )
加入( )
加入( ) 加入( )
加入( )
过 滤 过 滤 过 滤 过 滤
(2)在加入某试剂除去![]() 溶液中的
溶液中的![]() ,如何检验
,如何检验![]() 已经沉淀完全?
已经沉淀完全?
14.(13分)实验室用燃烧法测定某种氨基酸(CxHyOzNp)的分子组成。取w g该种氨基酸放在纯氧中充分燃烧,生成CO2、H2O和N2。现用下图所示装置进行实验(铁架台、铁夹、酒精灯等未画出),请回答有关问题:
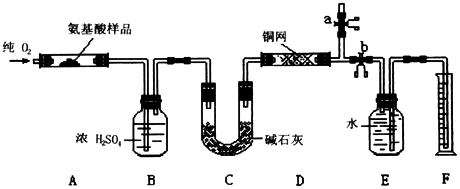
(1)实验开始时,首先打开止水夹a,关闭止水夹b,通一段时间的纯氧,这样做的目的是
;之后则需关闭止水夹 ,打开止水夹 。
(2)以上装置中需要加热的有(填装置代号) 。操作时应先点燃 处的酒精灯。
(3)装置A中发生反应的化学方程式为 ;
(4)装置D的作用是 ;
(5)为将![]() 所排水的体积测准,反应前应将连接E和F装置的玻璃导管中充满
(水、空气或氧气),简述理由
。
所排水的体积测准,反应前应将连接E和F装置的玻璃导管中充满
(水、空气或氧气),简述理由
。
(6)读取![]() 所排水的体积时,要注意:①
;
所排水的体积时,要注意:①
;
② 。
(7)实验中测得![]() 的体积为V mL(已换算成标准状况)。为确定此氨基酸的分子式,还需得到的数据有(填字母)
。
的体积为V mL(已换算成标准状况)。为确定此氨基酸的分子式,还需得到的数据有(填字母)
。
A.生成二氧化碳气体的质量 B.生成水的质量
C.通入氧气的体积 D.该氨基酸的摩尔质量
(8)如果将装置中B、C的连接顺序变为C、B,该实验的目的能否达到?简述理由
。
四、有机合成
15.下面是三种有机物的结构式和名称(数字为碳原子编号):
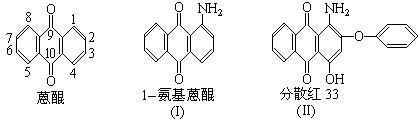
用化合物(I)为起始原料,经过3步主要反应可以得到化合物(II):
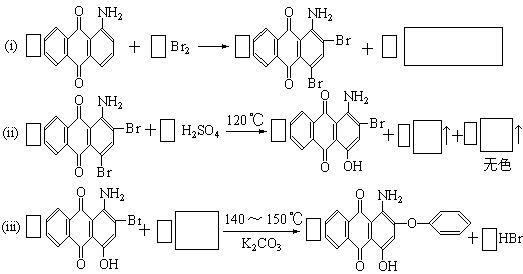
(1)请在以上三个化学方程式的方框内分别填入有关的化学式和化学式的化学计量数(即“系数”)
(2)从第(ii)步反应的化学原理图看,它既发生了取代反应又发生了氧化-还原反应,其中氧化剂是 ,配平后的化学方程式中共转移了 摩电子。
(3)请将反应式(iii)箭头下面的K2CO3改写在化学方程式的左端,重新另写出它的化学方程式,并配平之:
。
五、计算题
16.(6分)为了除去工业废气中的SO2,某化工厂采取下列措施:将经过初步处理的含有0.2%的SO2和10%的O2(均为体积分数)的废气,在400℃时,废气以5m3/h的速度通过V2O5催化剂层后与20L/h速度的NH3混合再喷水,此时气体温度由800℃降至200℃,在热的结晶装置中得到(NH4)SO4晶体(气体体积均已折算成标准状态),仔细阅读上文,回答下列问题:
(1)按反应理论值,SO2和O2和的物质的量之比为2:1。经过初步处理的废气中,SO2和
O2物质的量的比值为 。采用这样比值的原因是 。
(2)通过计算说明,为什么废气以5m3/h的速度与20L/h速度的NH3混合?
17.(8分)在标准状况下,取甲、乙、丙各30.0mL相同浓度的盐酸,然后分别慢慢加入组成相同的镁铝合金粉末,得下表中有关数据(假设反应前后溶液体积不发生变化):
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/mg | 255 | 385 | 459 |
| 气体体积/ mL | 280 | 336 | 336 |
请回答:
(1)甲组实验中,盐酸(选填“过量”“适量”或“不足量”,下同) ;乙组实验中盐酸 。
(2)盐酸的物质的量浓度为 。
(3)合金中Mg、Al的物质的量之比为 。
(4)丙实验之后,向容器中加入一定量1.00mol·![]() 溶液,能使合金中铝粉恰好完全溶解,再过滤出不溶性固体,求所得滤液中各溶质的物质的量浓度。(要求写出计算过程)
溶液,能使合金中铝粉恰好完全溶解,再过滤出不溶性固体,求所得滤液中各溶质的物质的量浓度。(要求写出计算过程)