高考理科综合课堂模拟练习化学部分试题3
化学部分试题(四)
可能用到的相对原子质量:H: 1 O: 16 N: 14 C:12 Na: 23 Cl: 35.5
C: 12 Zn:65 Cu:64 Mg:24 Fe:56
一、选择题:(下列各题只有一个选项符合题意。共45分)
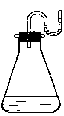 1.把下列物质分别加入装有水的锥形瓶里,立即塞紧带U形管的塞子,已知U形管内预先装有少量水(为使水容易观察,预先染成红色)如右图所示,则加入的物质可能是 ( )
1.把下列物质分别加入装有水的锥形瓶里,立即塞紧带U形管的塞子,已知U形管内预先装有少量水(为使水容易观察,预先染成红色)如右图所示,则加入的物质可能是 ( )
① NaOH固体 ②18 mol/L H2SO4溶液 ③ NH4NO3晶体
④Na2O2固体 ⑤生石灰
A. ①②④⑤ B. ①②③ C. ②③⑤ D. ③④⑤
2.以下现象与电化腐蚀无关的是 ( )
A.黄铜(铜锌合金)制作的铜锣不易产生铜绿
B.生铁比软铁芯(几乎是纯铁)容易生锈
C.铁质器件附有铜质配件,在接触处易生铁锈
D.银质奖牌久置后表面变暗
3.G、Q、X、Y、Z均为氯的含氧化合物,我们不了解它们的化学式,但知道它们在一定条件下具有如下的转换关系(未配平) ( )
(1) G®Q + NaCl
(2) Q + H2O![]() X + H2
X + H2
(3) Y + NaOH®G+Q+H2O (4) Z+NaOH®Q+X+H2O
这五种化合物中氯的化合价由低到高的顺序是
A.QGZYX B.GYQZX C.GYZQX D. ZXGYQ
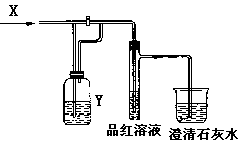 4.右图是一套检验气体性质的实验装置,向装置中缓慢通入气体X,若关闭活塞,则品红溶液无变化,而澄清石灰水变浑浊;若打开活塞,则品红溶液褪色。据此判断气体X和洗气瓶内溶液Y分别可能是
( )
4.右图是一套检验气体性质的实验装置,向装置中缓慢通入气体X,若关闭活塞,则品红溶液无变化,而澄清石灰水变浑浊;若打开活塞,则品红溶液褪色。据此判断气体X和洗气瓶内溶液Y分别可能是
( )
| A | B | C | D | |
| X | SO2 | H2S | CO2 | Cl2 |
| Y | 饱和NaHCO3溶液 | 浓硫酸 | Na2SO3溶液 | Na2CO3溶液 |
5.多硫化钠Na2Sx(x≥2)在结构上与Na2O2、FeS2、CaC2等有相似之处。Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,而NaClO被还原为NaCl,反应中Na2Sx与NaClO的物质的量之比为1∶16,则x值是
( )
A.5 B.4
C.3 D.2
6.NiO晶体在氧气中加热,部分Ni2+被氧化成Ni3+成为NixO(x<1).该晶体为NaCl型晶体,组成晶体基本单位是立方体.每个立方体中含4个NixO分子,今有一批NixO晶体,测得其密度为6.47g/cm3,立方体边长为4.157×10-8cm,则NixO的式量是 ( A)
A.70 B.280 C.75 D.45
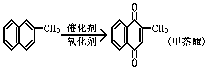 7.甲萘醌(维生素K)有止血作用,它可通过α-甲基萘的氧化制得,反应中常用乙酸作催化剂,该反应放热,其反应方程式如右图所示:
7.甲萘醌(维生素K)有止血作用,它可通过α-甲基萘的氧化制得,反应中常用乙酸作催化剂,该反应放热,其反应方程式如右图所示:
在某次合成反应中,用1.4g(0.01mol)的α-甲基萘,才制得0.17g(0.001mol)甲萘醌,已知该反应的速率是快的。试判断导致其产率低的原因是 ( )
A 使用了过量的催化剂 B 没有用乙酸,而是使用其它催化剂
C 把反应混合物加热 D 所生成的甲基醌是沉淀物
8.在室温下,某浓度的氯化铵溶液的pH为4,下列说法中正确的是 ( )
①由水电离出的H+浓度约为1×10-10mol·L-1
②溶液中〔CI-〕>〔NH4+〕>〔H+〕>〔OH-〕
③溶液中〔CI-〕>〔NH4+〕>〔OH-〕>〔H+〕
④溶液中〔H+〕·〔OH-〕=1×10-14
⑤溶液中水的电离度约为1.8×10-4%
A.①② B.④⑤ C.①③⑤ D.②④⑤
9.有一可逆反应:2A(g)+3B(g)![]() xC(g)+4D(g)若按下列两种配比在同温同体积的密闭容器中进行反应:
xC(g)+4D(g)若按下列两种配比在同温同体积的密闭容器中进行反应:
① 0.8molA,1.2molB,1.2molC,2.4molD
② 1.4molA,2.1molB,0.6molC,1.2molD
达到平衡后,C的质量分数相等,则反应方程式中x的值为 ( )
(A)l (B)2 (C)3 (D)4
二、填空简答
10.(4分)如右图所示实验中,把四根洁净的金属条A、B、C、D轮流放置在浸有盐溶液的滤纸上面并压紧。在每次轮流实验时,记录了电压表指针的移动方向和电压表的读数(如下表)。
| 金属 | 电子流动方向 | 电压 |
| A | A→Cu | +0.78 |
| B | Cu→B | -2.15 |
| C | C→Cu | +1.35 |
| D | +0.30 |
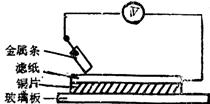 (1)金属D与Cu之间电子流动方向为
;
(1)金属D与Cu之间电子流动方向为
;
(2) 金属可能是最强的还原剂;
(3) 金属不能从硫酸铜溶液中置换出铜。
11.(10分)质子核磁共振谱(NMR)是研究有机化合物结构的最有力手段之一。在所研究化合物的分子中,每一种结构类型的等价(或称为等性)H原子,在NMR谱中都给出相应的峰(信号)。谱中峰的强度是与分子中给定类型的H原子数成比例的。例如,乙醇的NMR谱中有三个信号,其强度比为3:2:1。
(1)在常温下测得的某烃C8H10的PMR谱上,观察到两种质子给出的信号,其强度之比
为2:3,试确定该烃的结构简式 。该烃在光照下生成的一氯代物在PMR
谱中可产生几种信号 ,试确定强度比为 。
(2)在常温下测定相对分子质量为128的某烃的PMR,若观察到两种质子给出的信号,
且其强度之比为1:1,则该烃的结构简式为 。若观察到两种质子给
出的信号,且其强度之比为9:1,则该烃的结构简式为 。
12.(6分)下表数据是在某高温度下,金属镁和镍分别在氧气中进行氧化反应时,在金属表面生成氧化薄膜的实验记录:
| 反应时间t/h | 1 | 4 | 9 | 16 | 25 |
| MgO层厚y/nm | 0.25a | 0.20a | 0.45a | 0.80a | 1.25a |
| NiO层厚y’/nm | b | 2b | 3b | 4b | 5b |
注:a和b均为与温度有关的常数
请填空回答下列问题:
(1)金属高温氧化腐蚀速率可以用金属氧化膜的生长速率来表示,其理由是__________________________________________________________。
(2)金属氧化膜的膜厚y跟时间t所呈现的关系是(填直线、抛物线、对数或双曲线等类型):MgO氧化膜厚y跟t的关系属___ ___型,NiO氧化膜厚y’跟t的关系属 _____ ___ __型。
(3)Mg与Ni比较,哪一种金属更具有耐腐蚀性?_______,其理由是___ ___ __ _。
三、实验设计
13.(8分)把铁片投入浓硝酸溶液中看不到明显现象。为了验证铁与浓硝酸发生了钝化作用而不是铁与浓硝酸不反应,利用下列试剂,请设计一个合理的实验加以验证。
试剂:两块普通的铁片、浓硝酸、蒸馏水、1mol/L硫酸铜溶液、小刀、铜片、灵敏电流计、稀硫酸、NaOH溶液、KSCN溶液、导线。
(1)铁在浓硝酸发生钝化的实质是 .
(2)你设计的实验为(包括步骤、现象和结论):
14.(7分)“化学多米诺实验”即利用反应中气体产生的压力和虹吸作用原理,使若干化学反应一次发生,整个过程只需控制第一步反应,就好像多米诺骨牌游戏一样。下图就是一个“化学多米诺实验”。
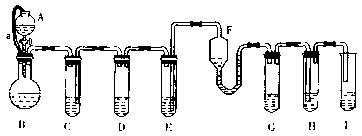
各装置中试剂或物质分别是:(A)2mol/LH2SO4 (B)Zn (C)2mol/LH2SO3+CuSO4 (D)Zn
(E) CuSO4溶液 (F)NH3·H2O(G)30%H2O2 (H)H2S溶液 (I)NaOH溶液.
已知:Cu2++4 NH3·H2O=[Cu(NH3)4]2++4H2O, 该反应的产物可作为H2O2分解的催化剂。请回答下列问题:
(1)进行实验前必须进行的操作是 。
(2)B与D两容器中反应速率相比较:B D(填大于、小于或等于)。其原因是
。
(3)H中的现象是 。
(4)I的作用是(用化学方程式表示) 。
(5)A和B之间的导管a的作用是 。
(6)在该反应中不涉及的反应类型是( )。
①化合反应 ②分解反应 ③置换反应 ④复分解反应
四、有机合成
15.(10分)最近某研究所成功地从石油裂解产物甲经过下述反应,合成了重要有机工业原料丙: 甲+CO+H2乙,乙+H2丙
⑴甲是一种烃,能与等摩尔的溴起加成反应,4.2g甲消耗的溴为16.0g,写出甲的名称_______________
⑵乙能发生银镜反应而丙不能,丙能进行酯化反应而乙不能,乙和丙经氧化后可得同一种直链羧酸,写出乙和丙的结构简式_______________,________________
⑶当实验室仅有CuCl2、CH3COOH、C2H5OH、NaOH和水等几种试剂时,如何判断丙中是否含有少量乙?________________________________________________
⑷在石油裂解时尚含有比甲少一个碳原子的同系物丁,试以丁为原料,合成乙和丙的同系物各一种。
①______________________________________________________________
②______________________________________________________________
五、计算题
16.(8分)美籍埃及人泽维尔用激光闪烁照相机拍摄到化学反应中化学键断裂和形成的过程,因而获得1999年诺贝尔化学奖。激光有很多用途,例如波长为10.3 微米的红外籍光能切断B(CH3)3分子中的一个B-C键,使之与HBr发生取代反应:
B(CH3)3+HBr![]() B(CH3)2Br+CH4
B(CH3)2Br+CH4
而利用9.6微米的红外激光却能切断两个B-C键,并与HBr发生二元取代反应。
(1)试写出二元取代的化学方程式:_____________________________
(2)利用5.6 g B(CH3)3和9.72 g HBr正好完全反应,则生成物中除了甲烷以外,其他两种产物的物质的量之比为多少?
17.(12分)已知高温下能发生如下反应:Si+C ![]() SiC。现有石英砂和碳粉的混合物a mol,在高温电炉中隔绝空气充分反应,反应完全后,冷却得到残留固体。
SiC。现有石英砂和碳粉的混合物a mol,在高温电炉中隔绝空气充分反应,反应完全后,冷却得到残留固体。
(1)写出可能发生反应的化学方程式。
(2)若石英砂与混合物的物质的量之比为x(0<x<1),试讨论x的取值范围,残留固体的成分和物质的量,并将结果填入下表中:
说明:①残留固体物质的量用a,x等表示,不必列出具体的计算式。
②每组空格填一种情况,有几种填几种,不必填满。
| x值 | 残留固体 | |
| 分子式(或化学式) | 物质的量/mol | |