高三化学(上学期)终结测试卷(一)
班级:_________ 姓名:_________
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,共150分,考试时间120分钟。
所需的相对原子质量:H:1 C:12 N:14 O:16 Ca:40
第Ⅰ卷(选择题 共74分)
一、选择题(本题包括8小题,每小题3分,共24分。每小题只有一个选项符合题意)
1.下列过程中,不涉及化学变化的是
A.甘油加水作护肤剂
B.用脂肪和烧碱加热制取肥皂
C.烹调鱼时加入少量料酒和食醋可减少腥味、增加香味
D.在燃料煤中添加氧化钙以减少二氧化硫的生成
2.“垃圾是放错了位置的资源”,应该分类回收利用,生活中废弃的塑料袋、医院的废输液管、废旧轮胎等可以归为一类加以回收利用。它们属于
A.糖类 B.有机物
C.氧化物 D.盐
3.(2000年全国)导致下列现象的主要原因与排放SO2有关的是
A.酸雨 B.光化学烟雾
C.臭氧空洞 D.温室效应
4.如果某托盘天平所用游码标尺最大量程为5 g,则此天平配套砝码中最小的砝码质量是
A.5 g B.10 g
C.1 g D.2 g
5.人体血红蛋白中含有Fe2+,如果误食亚硝酸盐,会使人中毒,因为亚硝酸盐会使Fe2+转变成Fe3+,生成高铁血红蛋白而丧失与O2结合的能力。服用维生素C可缓解亚硝酸盐的中毒,这说明维生素C具有
A.酸性 B.碱性
C.氧化性 D.还原性
6.在元素周期表短周期中的X和Y两种元素可组成化合物XY3,下列说法正确的是
A.XY3晶体一定是离子晶体
B.若Y的原子序数为m,X的原子序数一定是m±4
C.X和Y可属于同一周期,也可属于两个不同周期
D.X和Y一定不属于同一主族
7.实验室制备①氯化氢、②乙烯、③硝基苯、④硝化纤维、⑤乙酸乙酯、⑥硝酸时都用到浓H2SO4,其中利用其高沸点性质的是
A.只有① B.①④
C.①⑥ D.③⑤
8.氟气是氧化性最强的非金属单质。在加热条件下,等物质的量的氟气与烧碱完全反应。生成NaF、H2O和另一种气体,该气体可能是
A.H2 B.HF
C.O2 D.OF2
二、选择题(本题包括10小题,每小题5分,共50分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给5分,但只要选错一个,该小题就为0分)
9.在理论上不能用于设计原电池的化学反应是
A.HCl+NaOH===NaCl+H2O ΔH<0
B.2CH3O(l)+3O2(g) ![]() 2CO2(g)+4H2O(l) ΔH<0
2CO2(g)+4H2O(l) ΔH<0
C.4Fe(OH)2(s)+2H2O(l)+O2(g)===4Fe(OH)3(s) ΔH<0
D.2H2(g)+O2(g)===2H2O(l) ΔH<0
10.最近,科学家在实验室里成功地在高压下将CO2转化为类似于SiO2的原子晶体。下列有关这种CO2晶体的叙述中错误的是
A.晶体中C、O原子个数比为2∶1
B.晶体中存在直线型CO2分子
C.该晶体熔点、沸点高,硬度大
D.晶体中C、O原子的最外电子层都满足8电子结构
11.某固体化合物A不导电,但熔化或溶于水都能完全电离。下列关于物质A的说法中,不正确的是
A.A为易溶性盐 B.A是强电解质
C.A是离子化合物 D.A为非电解质
12.等体积、等物质的量浓度的Na2SO4和Na2CO3溶液,两份溶液中离子总数相比
A.前者多 B.后者多
C.一样多 D.无法判断
13.下列离子方程式中正确的是
A.向 Ba(OH)2溶液中滴加稀H2SO4
Ba2++2OH-+2H++SO===BaSO4↓+2H2O
B.将含有2 n mol NaOH的溶液与含有n mol Ca(HCO3)2的溶液混合
OH-+Ca2++HCO===CaCO3↓+H2O
C.在标准状况下将少量Cl2通入FeBr2溶液中
3Cl2+2Fe2++4Br-===6Cl-+2Fe3++2Br2
D.将等体积、等物质的量浓度的Ba(OH)2溶液和NaHCO3溶液混合
Ba2++2OH-+2HCO===BaCO3↓+CO+H2O
14.在某恒容的密闭容器中,可逆反应A(g)+B(g) xC(g)有如图所示的关系曲线,下列说法正确的是
A.温度:T1>T2 B.压强:p1>p2
C.该正反应是吸热反应 D.x的值是1
15.“绿色化学”是从经济、环保和技术上设计符合“原子经济性”(原子节约)要求的化学反应。理想的原子经济反应是原料分子中的原子全部转变成所需产物,不产生副产物,实现零排放。下列几种生产Mg(NO3)2的方法中,最符合“绿色化学”新理念的是
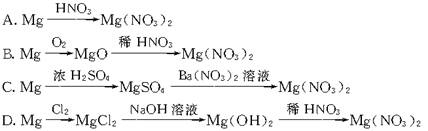
16.从海水中提取溴有如下反应:5NaBr+NaBrO3+3H2SO4===3Br2+3Na2SO4+3H2O与上述反应在氧化还原反应原理上相似的是
A.SO2+2H2O===3S+2H2O
B.CaCO3+H2O+CO2===Ca(HCO3)2
![]()
D.2FeCl3+Fe===3FeCl2
17.据报道,美国正在研究用锌电池取代目前广泛使用的铅蓄电池,它具有容量大的特点,其电池反应为2Zn+O2===2ZnO,其原料为锌粉、电解液和空气。则下列叙述正确的是A.锌为正极,空气进入负极
B.负极反应为Zn-2e-===Zn2+
C.电解液肯定不是强酸
D.正极发生氧化反应
18.室温时,向体积均为1 L pH为2的盐酸中分别加入0.02 mol金属M,反应完毕后再分别加入0.01 mol N。则两次加入金属的全过程中,放出气体最多的是
| A | B | C | D | |
| 第一次加入M | K | Na | Zn | Mg |
| 第二次加入N | Al | Mg | Al | Na |
第卷(非选择题 共76分)
三、(本题包括2小题,共24分)
19.(8分)下面是关于药物华素片(西地碘片)使用说明书中的部分内容:
| 华素片(西地碘片)使用说明书 [品名和组成] 品名:西地碘片 商品名:华素片 英文名:Cydiodine Tablets 化素片(西地碘片)的主要活性成分是分子碘,含是1.5 mg/片。 将碘利用分子分散技术制成分子态西地碘,并含适量薄荷脑等。 [贮藏]遮光、密闭、在凉处保存。 [有效期]二年 |
(1)根据上述说明和所学化学知识回答:
①华素片中含有的活性成分是__________(写分子式);
②请推断华素片__________(“是”或“不是”)白色。
(2)某学生为验证华素片中确实含有上述成分,完成实验如下,请填空:
①取一粒药片放入研钵中研碎,再将药粉装入试管并加入约2 mL蒸馏水;向该试管中再加入约2 mL______(填选项字母),并用力振荡;
A.酒精 B.热裂汽油
C.四氯化碳 D.甘油
②描述加入该液体后可能观察到的现象____________________________;
③选用该液体做实验的原因是____________________________________。
(3)请再设计另一种方法,验证华素片中的成分,(注意叙述实验原理、操作方法和实验结论)__________________________________________________________________________。
20.(16分)环境保护是我国的一项基本国策。含CN-的污水毒性和危害极大。治理含
CN-污水的方法之一是:在催化剂TiO2作用下,用NaClO将CN-氧化成CNO-,CNO-在酸性条件下继续被NaClO氧化成CO2、N2和H2O以及Cl-。其离子反应方程式为:CN-+
ClO-![]() CNO-+Cl-,2CNO-+3ClO-+2H+===N2↑+2CO2↑+3Cl-+H2O。某科研部门用下图装置进行模拟实验,以证明上述处理含CN-污水方法的有效性,并测定CN-被处理的百分率。下述实验装置是通过测定CO2的量来确定CN-的处理效果。
CNO-+Cl-,2CNO-+3ClO-+2H+===N2↑+2CO2↑+3Cl-+H2O。某科研部门用下图装置进行模拟实验,以证明上述处理含CN-污水方法的有效性,并测定CN-被处理的百分率。下述实验装置是通过测定CO2的量来确定CN-的处理效果。
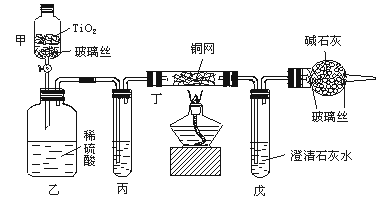
试根据要求回答下列问题:
(1)将浓缩后含CN-的污水(其中CN-浓度为0.05 mol/L)200 mL倒入甲装置中,再向甲装置中加入过量的漂白粉溶液,塞上橡皮塞,一段时间后,打开活塞,使溶液全部进入乙中,关闭活塞。
①乙装置中生成的气体除含有CO2、N2、HCl外还有副反应生成的Cl2等,写出生成Cl2的副反应的离子方程式:________________。
②丙中加入的除杂试剂是______________________。
A.饱和食盐水 B.饱和碳酸氢钠溶液
C.浓NaOH溶液 D.浓硫酸
③丁在实验中的作用是____________________。
④戊中盛有足量石灰水,若实验后戊中共生成0.8 g沉淀,则该实验中CN-被处理的百分率________80%(填“>”“=”“<”)
(2)上述实验中造成戊中碳酸钙质量测定值偏小的可能原因有(写出二点即可):____________________。
四、(本题包括2小题,共17分)
21.(6分)燃放鞭炮会对环境产生危害,同时也会对人造成一定的危险。因此我国一些地区规定禁止燃放鞭炮。黑火药是制造鞭炮的主要原料,其成分是硝酸钾、硫磺和木炭。若爆炸时产生硫化钾、二氧化碳和氮气。
则根据上述内容填空:
(1)写出黑火药爆炸时所发生的化学反应方程式:____________________。
(2)在这个反应中,被还原的元素是____________,氧化产物是________。
(3)当有3.6 g碳完全反应时,可生成气体的体积在标准状况下是_______L。这些气体若在1.01×105 Pa的压强和200℃的条件下的体积将是_________L。
22.(11分)A、B、C、D为常见的单质,E、F、G为熟悉的化合物。A、B为气体,C、D为固体,E为黑色固体,D、F均为淡黄色粉末,G为暗红色粉末。有关物质间转化关系如图所示(其他产物均已略去)。
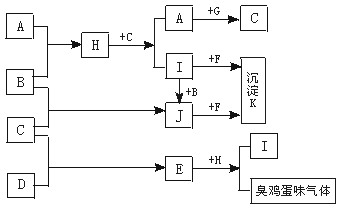
(1)写出下列物质的化学式:F________、G________、K________。
(2)写出下列反应的化学方程式:
①A+B![]() H__________________________。
H__________________________。
②C+D![]() E__________________________。
E__________________________。
(3)写出下列反应的离子方程式:
①I+B![]() J________________________________。
J________________________________。
②H+C![]() A______________________________。
A______________________________。
五、(本题包括2小题,共20分)
23.(10分)0.1 mol某种烯烃或两种烯烃的混合物(碳原子数均不超过5)充分燃烧后,生成的二氧化碳完全被300 mL 2 mol·L-1的氢氧化钠溶液吸收。所得溶液中含有两种物质的量相等的溶质。
(1)若为纯净物,试推断可能的烯烃分子式:
①________;②________;③________。(可以不填满,也可以补充)
(2)若为两种烯烃的混合物,试推断可能的组成及体积比(可以不填满,也可以补充):
| 序号 | 组成 | 体积比 |
| 1 | ||
| 2 | ||
| 3 |
24.(10分)乳酸是酸奶的成分之一,乳酸可以用化学方法合成,也可以由淀粉通过生物发酵法制备。利用乳酸可以合成多种具有生物兼容性和环保型的高分子材料。乳酸已成为近年来人们的研究热点之一。乳酸的结构简式为CH3CH(OH)COOH,以下是采用化学方法对乳酸进行加工处理的过程:
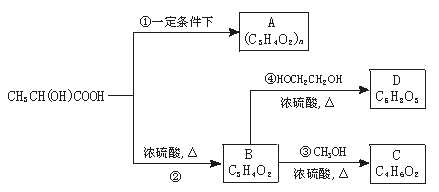
请根据乳酸的性质和上述信息填写以下空白:
(1)写出乳酸与NaOH溶液反应的化学方程式:________________________________。
(2)写出乳酸与硫酸共热生成C6H8O4的化学方程式:__________________________。
(3)②的反应类型是________;化合物A的结构简式是__________________________。
(4)作为制作隐形眼镜的材料,对其性能的要求除应具有良好的光学性能外。还应具有良好的透气性和亲水性。采用化合物D的聚合物而不是化合物C的聚合物作为隐形眼镜的制作材料的主要原因是________________________。请写出由化合物D合成高分子化合物的反应方程式:____________________。
六、(本题包括2小题,共15分)
25.(6分)有机物A和B由C、H、O三种元素组成,两者互为同系物,且知A分子的碳原子数较B分子少,A的相对分子质量不超过70。
现有等物质的量A和B的混合物,其中氧的质量分数为16/51。取一定量该混合物,与一定量的氧气混合点燃,在120℃ 101 kPa的条件下,将燃烧产物通入足量浓硫酸,气体体积减少为原来的二分之一;再将剩余气体通入碱石灰,气体全部被吸收。
(1)该混合物的平均相对分子质量为________;
(2)A的分子式为________,B的分子式为________。
26.(9分)实验室常用澄清石灰水检验CO2。在20℃时,每100 g水溶解Ca(OH)2 0.165 g即达饱和。
(1)在20℃ 500 g水中加入37.0 g Ca(OH)2粉末,经充分搅拌,若液体体积仍为500 mL。求OH-的物质的量浓度。
(2)若使原500 mL溶液中的c(Ca2+)降低至0.0100 mol·L-1,求需要通入标准状况下二氧化碳气体多少升?
参考答案
一、1.A 2.B 3.A 4.A 5.D 6.C 7.C 8.D
二、9.A 10.AB 11.D 12.B 13.A 14.AD 15.B 16.AD 17.BC 18.A
三、19.(1)①Ⅰ2 ②不是
(2)①C ②加入CCl4后可看到试管中物质分为两层,下层为紫色的CCl4层 ③CCl4与水互不溶,而且碘在CCl4中的溶解度比在水中的溶解度要大得多
(3)由于碘遇淀粉可呈现蓝色,可利用此反应验证碘的存在。取一粒华素片放入研钵中研碎,再将其装入试管并加入约2 mL水,向试管中加入几滴淀粉溶液,如看到试管中的物质呈蓝色,则证明有单质碘的存在
20.(1)①ClO-+Cl-+2H+===Cl2+H2O②A
③除去CO2气体中的Cl2杂质,防止对CO2测定产生影响 ④>
(2)甲装置中的CNO-未全部进入乙中;丙中溶解了少量的CO2;过滤干燥时CaCO3有损耗
四、21.(1)2KNO3+S+3C===K2S+N2↑+3CO2↑
(2)硫和氮 CO2
(3)8.96 15.5
22.(1)Na2O2 Fe2O3 Fe(OH)3
(2)①H2+Cl2![]() 2HCl
2HCl
②Fe+S![]() FeS
FeS
(3)①2Fe2++Cl2===2Fe3++2Cl-
②Fe+2H+===Fe2++H2↑
五、23.(1)①C2H4 ②C4H8
(2)①C2H4和C5H10;体积比1∶2
②C3H6和C5H10;体积比1∶1
24.(1)
![]()
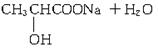
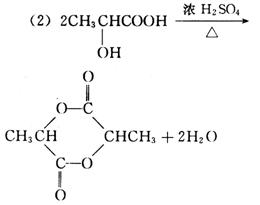
(3)消去反应 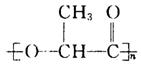
(4)在D化学物质中含有亲水基团(—OH),会使合成的隐形眼镜配戴时较为舒适。
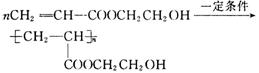
六、25.(1)51
(2)C2H4O C3H6O
26.(1)0.045 mol/L (2)0.14 L