高三化学元素化合物知识复习②别 __
_____________________
考试说明的要求:金属:
掌握典型金属和典型非金属在周期表中的位置及与其性质的关系.了解其他常见金属和非金属元素的单质及其化合物.
1.ⅠA和ⅡA族元素——典型的金属
(1)以钠、镁为例,了解典型金属的物理性质和化学性质.
(2)从原子的核外电子排布,理解ⅠA、ⅡA族元素(单质、化合物)的相似性和递变性.
(3)掌握最重要的两种碱性化合物(NaOH、Na2O2、Na2CO3和Na2CO3 )的性质和用途.
(4)了解硬水及其软化.
2.其他常见的金属(如:Fe、Al、Zn、Cu)
(1)了解Fe和Al的天然资源、冶炼原理、性质和用途.
(2)掌握若干常见金属的活动顺序.
(3)以Fe(Ⅱ)、Fe(Ⅲ)的相互转化为例,了解变价金属元素的氧化还原性.
(4)以AL2O3、AL(OH)3为例,了解两性氢氧化物和两性氢氧化物.
(5)了解钢铁的腐蚀和防护.
(6)以钢铁为例,了解合金的概念.
3.了解在生活和生产中常见的无机化合物的性质和用途.
一、金属概述
1.金属元素在元素周期表中的位置

在已发现的一百多种元素里,大约有五分之四是金属元素。它们位于元素周期表中每个周期的前部。ⅠA(除H外)、ⅡA、ⅢA(除B外)、ⅣA的_____________、ⅤA族的_________、VIA的____以及_____________皆为金属元素。重点金属元素为 Na、Mg、Al、Fe。
2.金属物理通性:
练习:下列有关金属元素特征的叙述正确的是:
A.金属元素的原子只有还原性,离子只有氧化性
B.金属元素在化合物中一定显正价
C.金属元素在不同的化合物中的化合价均相同
D.金属元素的单质在常温下均为金属晶体
E.金属性越强的元素相应的离子氧化性越弱
F.金属元素只有金属性,不可能形成酸根离子
G.价电子越多的金属原子金属性越强
H.离子化合物一定含金属元素
3.合金:
(1)概念:
(2)性质:
4.金属的冶炼方法:
二、元素化合物知识学习的主要方法
1. 抓典型、带整体;抓一般、带递变;
(1) 以代表性元素的学习带动一族元素的学习;
(2) 在“相似性”的基础上掌握“递变性”、记忆“特殊性”
递变主要表现为熔沸点的差异、金属性非金属性强弱的差异。递变规律的获得主在通过:
原子结构:
实验事实:
2. 典型元素的学习:先学习单质,再学习它的化合物;
3. 单质的学习:一般包括________、________、________、________;
4. 单质化学性质的学习
如果是金属单质
如果是非金属单质
5. 理论指导及学习主线
理论指导:____________
学习主线:(1)氧化还原知识(2)位置、结构、性质、用途之间的关系
碱金属元素
一.钠
(一).钠的物理性质为:________________________________
钠保存在煤油中的原因是__________________________________________________。
(钠保存在四氯化碳中、锂保存在煤油中行吗?)
(二).钠的化学性质:
1.与非金属单质的反应:
(1)与氧的反应:钠很容易被氧化,切开钠会看到______________现象,这是因为生成了_____。
钠在空气中长久放置最终生成_________。
产生反应物相同而产物不同情况的原因包括①反应条件不同,如___________
②_______________不同,如____________
③_______________不同,如____________
④_______________不同,如____________
(2)与其它非金属的反应:
2.与化合物的反应:
(1) 钠与水的反应: 离子方程式:
| 现象 | 结论 | |
| ① | ||
| ② | ||
| ③ | ||
| ④ |
(2)与盐溶液的反应:
(3)与某些有机物的反应:
钠还可以与其它某些含有__________官能团的物质发生反应生成氢气,如:______________________
钠与氢气的对应关系为________________,钠与此官能团的对应关系为_______________。
二.钠的化合物
1.钠的氧化物和过氧化物
| 名称 | 氧化钠 | 过氧化钠 |
| 化学式 | ||
| 氧元素价态 | ||
| 电子式 | ||
| 物质类别 | ||
| 化学键类型 | ||
| 颜色和状态 | ||
| 跟水的反应 | ||
| 跟CO2的反应 | ||
| 制法 | ||
| 用途 |
(1) 由Na2O2与H2O、CO2的反应回答:
①. Na2O2 与CO2或水的对应关系为: 与O2 的对应关系为:
②. 跟Na2O与H2O和CO2 的反应有何差别?
试写出过氧化钠与盐酸的反应:
练习1. 把4.48 L CO2 通入一定量的固体Na2O2后, 收集到3.36 L 气体( 均为标况),
则这3.36 L气体质量是
(A) 3.8 g (B) 5.6 g (C) 4.8 g (D) 6.0 g
(2) 有漂白作用的物质有哪些? 试比较它们漂白原理的异同.
(3) Na、 Na2O 、Na2O2 、NaOH与水作用后溶液浓度的比较.
练习2. 等质量的下列物质溶于等体积的水中, 最终得到的溶液物质的量浓度最大的
是 (A) NaOH (B) Na2O (C) Na2O2 (D) Na
练习3. 向各盛有1 L 水的A、B、C、D四个烧杯中分别加入等质量的钠、氧化钠、
过氧化钠和氢氧化钠固体, 完全溶解后, 各杯溶液中溶质的质量分数的顺序是_______
练习4. 在甲、乙、丙、丁四个烧杯中分别放入0.1 mol 的钠、氧化钠、过氧化钠和氢
氧化钠, 然后各加入100 mL水, 搅拌, 使固体完全溶解。则甲、乙、丙、丁溶液
溶质的质量分数大小顺序是
(A) 甲<乙<丙<丁 (B) 丁<甲<乙= 丙 (C) 甲=丁< 乙=丙 (D) 丁<甲<乙<丙
练习5. 将3.72g金属钠、氧化钠和过氧化钠的混合物与足量水反应,在标准状况下得到672mL混合气体,将混合气体电火花点燃,恰好完全反应,则原混合物中钠、氧化钠、过氧化钠的物质的量之比为
A.3:2:1 B.4:2:1 C.1:1:1 D.2:1:1
2. 碳酸钠和碳酸氢钠
| 碳酸钠 | 碳酸氢钠 | |
| 化学式 | ||
| 颜色状态 | ||
| 二者溶解性比较 | (这与其它正盐及其酸式盐的溶解性关系一样吗?) | |
| 跟碱的反应 NaOH Ca(OH)2 | ||
| 跟盐的反应 CaCl2 Al2(SO4)3 | ||
| 跟酸的反应 | ||
| 二者与酸反应的差别:① ② ③ | ||
| 热稳定性 | ||
| 如何验证产物? | ||
| 相互转化 | 正盐和其酸式盐相互转化途径总结: | |
碳酸钠、碳酸氢钠的鉴别及除杂问题:
(1)如何用盐酸来鉴别碳酸钠和碳酸氢钠?
两瓶无色溶液分别为碳酸钠和盐酸,不外加试剂如何来鉴别?
练习6. 在1L态1 mol/L Na2CO3 溶液中逐滴加入200 mL 6 mol/L HCl ; 在200mL 6 mol/LHCl中逐滴加入1L1mol/LNa2CO3 溶液. 两种实验操作在相同状态下产生的CO2气体
(A) 相等 (B) 前者多 (C) 后者多 (D) 无法判断
(2)
练习7. 判定碳酸钠粉末中是否含有碳酸氢钠的方法是_________________
练习8. 判定碳酸氢钠白色粉末中是否混有碳酸钠的方法是
(A) 加热并将生成物导入澄清石灰水中, 看石灰水是否变混浊
(B) 加入盐酸中观察生成气体的速度
(C) 加入澄清石灰水中观察有无沉淀生成
(D) 加入氯化钙溶液中观察有无沉淀生成
练习9. 用两种不同的方法来区别碳酸钠和碳酸氢钠固体.
3.氢氧化钠
(1)主要物理性质: 色固体,易吸收空气中的水而 , 溶解于水,并且放出大量的热,水溶液有 性,俗名有 、 、 。
(2)为一元强碱,具有碱的通性
①NaOH溶于水后,完全电离,能与酸碱指示剂或试纸作用;
②与酸和酚发生中和反应:
③与酸酐发生反应:如SO2、CO2、SiO2、SO3;
④与两性物质反应:如Al、Al2O3、Al(OH)3;
⑤与盐发生复分解反应:如NH4+、Cu2+、HCO3-、H2PO4-、HSO3-;
⑥与某些非金属单质反应:如Cl2、S;
⑦提供碱性环境发生无机和有机反应:如卤代烃的水解反应和消去反应,酯类的水解、油脂的皂化。
三.碱金属元素
碱金属元素在元素周期表中位于________, 包括____________________________
(写元素符号及名称)六种元素。它们原子结构的相似性为______________________
差别及递变规律为_______________________________________________________。
单质熔点依次_________, 金属性依次__________。这一族元素之所以称为碱金属是因为
__________________________。
能够说明碱金属单质的金属性随核电荷数的递增依次增强的事实有:
(1)结构事实:碱金属元素原子随核电荷数的递增其电子层数依次________,半径依次 ,核对最外层电子的束缚能力依次___________失电子的能力依次 ,金属性依次_______。
(2)实验事实:
四. 实验
1. 焰色反应
__________ 或___________在灼烧时使火焰呈特殊的颜色, 这在化学上称为焰色反应. 含钠元素的物质的焰色为___色, 含钾元素的物质的焰色为___ 色. 观察钾的焰色时要透过_________, 目的是________________________________.焰色反应的操作要点有_______
__________________________________________________________________________.
2. 从草木灰中提取钾盐
可分为四个步骤:______,_______,_______,________.对提取的草木灰做如下实验:
(1) 进行焰色反应, 火焰呈_____ 色, 说明有___________ 存在;
(2) 加入盐酸有气体生成, 则由此可推断草木灰中有___________, 为草木灰的主要成分;
(3) 加入氯化钡溶液有白色沉淀生成,再加盐酸沉淀不溶解, 说明有________;
(4) 加入硝酸银溶液有白色沉淀生成,再加硝酸沉淀不溶解, 说明有_______.
五.钠及其钠的化合物
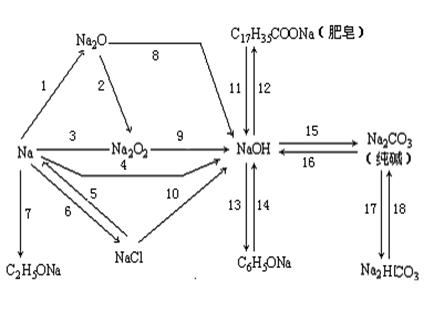
完成上述各步化学反应方程式
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18