高三化学月考试题
一: 选择题.(下列各题每小题只有一个正确答案,每题6分,共48分.)
1.xR2++yH++O2=mR3++nH2O的离子方程式中,对m和R3+的判断正确的是 ( )
A.m=4, R3+是氧化产物 B.m=n, R3+是氧化产物
C.m=2, R3+是还原产物 D.m=2n, R3+是还原产物
2.在给定的四种溶液中,加入以下各种离子,各离子能在原溶液中大量共存的有 ( )
A.滴加石蕊试液显红色的溶液
Fe3+ 、NH![]() 、Cl- 、SCN-
、Cl- 、SCN-
B.pH值为1的溶液
Cu2+、Na+ 、Mg2+、NO![]()
C.水电离出来的c(H+)=10-13mol/L的溶液 K+、HCO![]() 、Br-、Ba2+
、Br-、Ba2+
D.所含溶质为Na2SO4的溶液 Ba2+ 、CO![]() 、NO
、NO![]() 、Al3+
、Al3+
3.设NA代表阿伏加德罗常数的值,下列说法正确的是 ( )
A.1.8g铵根离子所含的电子数为1.1NA
B.1mol白磷分子中所含共价键数为4NA
C.标准状况下22.4L乙醇所含的分子数必定为NA
D.在电解食盐水的实验中,测得电解后溶液pH为14,又知电解后溶液总体积为1L,
则阴极析出的气体的分子数为0.5NA
4.假设![]() 的相对原子质量为24,则下列推断不正确的是 ( )
的相对原子质量为24,则下列推断不正确的是 ( )
A.标准状况时11.2
L![]() 的质量为32g
的质量为32g
B.![]() 的相对原子质量为32
的相对原子质量为32
C.44g![]() 和28gCO含有相同的分子数
和28gCO含有相同的分子数
D.标准状况时44g![]() 的体积是22.4L
的体积是22.4L
5.超临界流体是物质介于气态和液态之间的一种新的状态。目前应用最广的是超临界二氧化碳,在化学工业上可取代氟利昂等溶剂、发泡剂。下列有关超临界二氧化碳的说法中
错误的是 ( )
A.超临界二氧化碳是新合成的一种物质
B.超临界二氧化碳由CO2分子构成
C.用超临界二氧化碳溶解物质后,可在常温常压下使二氧化碳挥发除去
D.用超临界二氧化碳代替氟利昂可减轻对臭氧层的破坏
6.共价健、离子键和分子间作用力是微粒之间的不同作用力,下列①Na2O2 ②SO2 ③石墨④金刚石 ⑤NaCl ⑥白磷,含有其中两种结合力的是 ( )
A.①②⑤ B.①③⑥ C.②④⑥ D.①②③⑥
7.在体积固定的密闭容器里,按2:1的体积比充入SO2和O2两种气体,在一定温度和催化剂条件下进行反应2SO2+O2![]() 2SO3,反应进行1 min时,以SO2表示的平均反应速率为A mol/(L·min),当反应进行2min时,SO3还在不断增加,则2min内仍用SO2表示该反应的化学反应速率将是
2SO3,反应进行1 min时,以SO2表示的平均反应速率为A mol/(L·min),当反应进行2min时,SO3还在不断增加,则2min内仍用SO2表示该反应的化学反应速率将是
A、小于A mol/(L·min) B、大于A mol/(L·min)
C、等于A mol/(L·min) D、无法确定
8.向少量Mg(OH)2悬浊液中加入适量的饱和氯化铵溶液,结果固体完全溶解。甲同学解释是:
Mg(OH)2(s) ![]() Mg2+
+ 2OH- ①
Mg2+
+ 2OH- ①
NH4+ + H2O ![]() NH3·H2O
+ H+ ②
NH3·H2O
+ H+ ②
H+ + OH-=== H2O ③
由于③的发生使平衡①右移,沉淀溶解
乙同学的解释是:Mg(OH)2(s) ![]() Mg2+ + 2OH- ①
Mg2+ + 2OH- ①
NH4+ + OH- === NH3·H2O ②
由于②的发生使平衡①右移,沉淀溶解
丙同学用下面的一种试剂里作了试验,证明甲、乙的解释只有一种正确,他用的试剂是(已知CH3COONH4溶液为中性)
A、NH4NO3 B、CH3COONH4 C、(NH4)2SO4 D、氨水
二:填空题(按要求作答)
9(4分).已知A、B两种气体在一定条件下可发生反应:2A+B![]() C+3D+4E。现将相对分子质量为M的A气体mg和足量B气体充入一密闭容器中恰好完全反应后,有少量液滴生成;在相同温度下测得反应前后压强分别为6.06×105Pa和1.01×105Pa,又测得反应共放出QkJ热量。试根据上述实验数据写出该反应的热化学方程式:
C+3D+4E。现将相对分子质量为M的A气体mg和足量B气体充入一密闭容器中恰好完全反应后,有少量液滴生成;在相同温度下测得反应前后压强分别为6.06×105Pa和1.01×105Pa,又测得反应共放出QkJ热量。试根据上述实验数据写出该反应的热化学方程式:
________________________________________________________
10.(8分).化合物A是一种不稳定的物质,它的分子组成可用QxFy表示。10mLA气体能分解生成15mLO2和10mLF2(同温同压)。
(1)A的化学式是_______,推断理由是___________________________。
(2)已知A分子中x个氧原子呈…O—O—O…链状排列,则A分子的电子式是_______,A分子的结构式是_______。
11.(6分).A、B两种金属元素的相对原子质量之比是8∶9。将两种金属单质按物质的量之比为3∶2组成1.26g混合物。将此混合物与足量稀硫酸溶液反应,放出1.344L(标准状况)氢气。若这两种金属单质在反应中生成氢气的体积相等,则A的摩尔质量是_______,B的摩尔质_________________。
12.(12分).某电解质溶液中,可能大量存在有Ag+、H+、Cu2+、CO32-、OH-、Cl-离子,你认为一定有的离子是______,一定没有的离子是_______;还需要进一步确认的离子是_______,怎样判断有无_______
13.(20分).A、B、C、D、E五种元素,它们的核电荷数按C、A、B、D、E顺序增大,C、D都能分别与A按原子个数比为1∶1或1∶2形成化合物,CB可与EA2反应生成C2A与气体物质EB4,E的M层电子数是K层电子数的2倍。请回答:
(1)写出这五种元素的名称:A______,B______,C______,D______,E______;
(2)画出E原子结构示意图:___________;
(3)写出D2A2和EB4的电子式:______,______;
(4)写出D单质与铜盐溶液反应的离子方程式:_________________。
量是______。
14.(12分).可逆反应:aA(气)+bB(气) ![]() cC(气)+dD(气);△H=Q试根据图回答:
cC(气)+dD(气);△H=Q试根据图回答:

(1)压强P1比P2______(填大、小)
(2)体积(a+b)比(c+d)______(填大、小)
(3)温度t1℃比t2℃______(填高、低)
(4)Q值是______(填正、负)
参考答案
1 A 2B 3.D 4. A 5 .A 6 .B 7. A 8. B
9.2A(气)+B(气)=C(气)+3D(液)+4E(气);△H=-![]() Q kJ/mol
Q kJ/mol
10.(1)O3F2;质量守恒定律和阿伏加德罗定律
(2)电子式为:![]() .结构式为:F—O—O—O—F
.结构式为:F—O—O—O—F
11.24g/mol,27g/mol
12.Cl-;Ag+、CO32-、OH-;H+、Cu2+;观察溶液颜色,如为蓝色则有Cu2+;加足量铁粉,有气泡产生,则有H+。
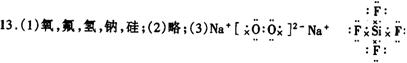 (4)2Na+Cu2++2H2O
(4)2Na+Cu2++2H2O![]() Cu(OH)2↓+2Na++H2↑
Cu(OH)2↓+2Na++H2↑
14.(1)小 (2)小 (3)高 (4)正