高三化学专题复习—元素推断
1、周期表前20号元素中,它们形成离子化合物时,原子数之比为1﹕2,且阴阳离子的电子层结构相同。写出这些化合物的化学式____________________________________________ 。
2、A、B两元素,A的原子序数为X,A、B所在周期的元素种类分别为m和n,若A和B同主族,当B在A的上一周期时,B的原子序数为__________________。B在A的下一周期时,B的原子序数为_____________。
3、A、B、C、D为短周期元素,A和B同周期相邻,A和C同主族相邻,ABC三种元素的原子序数之和为31,D元素与ABC既不同周期又不同主族,请回答:
(1)元素符号 A ________B _________C_________D____________ .
(2)A、B、D组成为D4B2A3的离子化合物,其水溶液的PH值小于7的原
因是
![]() (3)比较B、D形成的化合物与A、D形成的阴离子结合质子能力强弱_______. 请用方程式表示_____________________________________________________________
(3)比较B、D形成的化合物与A、D形成的阴离子结合质子能力强弱_______. 请用方程式表示_____________________________________________________________
(4)用电子式表示D2A形成过程___________________________________________。
4.有A、B、C、D四种短周期的非金属元素(其单质也可分别用A、B、C、D表示),四种元素的原子序数按B、D、C、A顺序增大,D、C元素在周期表中位置相邻。在一定条件下,B可以分别和A、C、D化合生成甲、乙、丙化合物,C和D化合可得丁。已知乙、丙两个分子中各含有10个电子,并且甲、乙、丙、丁、戊有如下的变化关系:
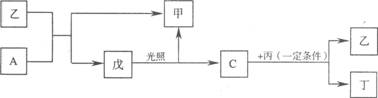
请填写下列空格:
(1)甲的浓溶液与一种黑色粉末共热可得A,则甲为_______,乙为___________。
(2)戊的结构式是______________,DB4+的电子式是_______________。
(3)丙+丁→D在一定条件下反应,是一种治理污染的好办法,写出该反应的化学方程式,
并标明电子转移情况:________________________________________________ .
5.气体A只含X、Y两种短周期元素,X的原子序数大于Y的原子序数。常温下B、D、E是常见气体,C是液体。各物质有如下图所示的转化关系。
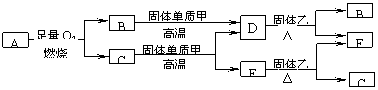 |
试回答下列问题:
(1)若气体A是纯净物,且A分子的空间构型为直线型,则A的电子式为 ;
(2)若气体A是混合气体,且X与Y的质量比小于3,则气体A中肯定有(写化学式)
;
⑶若D与固体乙反应过程中有明显的颜色变化,则乙可能为 (写化学式);
⑷C与固体甲在高温下反应的化学方程式为 ;
6.短周期的三种元素分别为X、Y和Z,已知X元素的原子最外层只有一个电子,Y元素原子的M电子层上的电子数是它的K层和L层电子总数的一半,Z元素原子的L电子层上的电子数比Y元素原子的L电子层上电子数少2个,则这三种元素所组成的化合物的分子式不可能是 ( )
A.X2YZ4 B.XYZ3 C.X3YZ4 D.X4Y2Z7
7.A元素的原子最外层电子数是a,次外层电子数是b;B元素的原子M层电子数是(a—b),L层电子数是(a+b),则A、B两种元素形成的化合物的化学式可能表示为 ( )
A.B3A2 B.BA2 C.A3B2 D.AB2
8.某主族元素的离子X2+有6个电子层,最外层有2个电子,当把XO2溶于浓盐酸时,有黄色气体产生,则下列说法不正确的是 ( )
A.X2+具有还原性 B.X的+2价化合物比+4价化合物稳定
C.XO2具有强氧化性 D.该元素是第ⅡA族元素
9.推断下列化合物的化学式:
⑴X、Y两元素能形成XY2型化合物,XY2中共有38个电子,若XY2是离子化合物,其化学式是_____;若XY2是共价化合物其化学式是______。
⑵第三周期内,X、Y两元素的原子序数之差为4,它们组成的XY型化合物,其化学式为______。
⑶1mol某物质含有不同周期三种元素的原子各1mol,其质子总数为20mol,该物质的化学式为______。
⑷某非金属X的最高正价为+m,它的最高价氧化物对应的水化物中有b个氧原子,则这种酸的化学式是________。
⑸X元素的最高正价和负价绝对值之差为6,Y元素和X元素原子的次外电子层上都有8个电子,X和Y形成的化合物在水溶液中能电离出电子层结构相同的离子,则该化合物是_________ 。
10.A、B、C、D、E都是短周期元素,原子序数依次增大,B、C同周期,A、D同主族。A、B能形成两种液态化合物甲和乙,原子个数比分别为2∶1和1∶1。根据以上信息回答下列问题:
⑴甲、乙两分子中含有非极性共价键的物质的电子式是______________________,C元素在周期表中的位置是__________________。
⑵C和D的离子中,半径较小的是__________(填离子符号)。
⑶将D的单质投入甲中,待D消失后再向上述溶液中加入E的单质,此时发生反应的化学方程式是______________________________________________________。
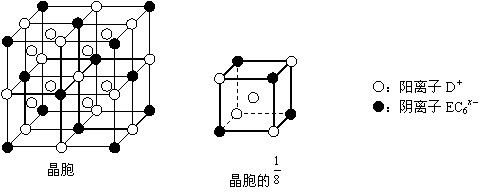
⑷C、D、E可组成离子化合物DxEC6,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如下图所示,阳离子D+(用○表示)位于正方体的棱的中点和正方体内部;阴离子EC6x-(用●表示)位于该正方体的顶点和面心。该化合物的化学式是_________。
11.A、B、C、D是中学化学中常见的含有相同电子数的离子或分子。其中A是由5个原子构成的粒子。它们之间的相互反应关系如下图。
⑴写出A、B的电子式。A B 。
⑵C与D相似,在液态时C也可以发生微弱的电离,电离出含有相同电子数的两种微粒,则C的电离方程式为____________________________________。
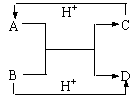 ⑶金属钠能与液态C反应:Na+C→X+H2,写出在液态C中X跟NH4Cl反应的化学方程式
。
⑶金属钠能与液态C反应:Na+C→X+H2,写出在液态C中X跟NH4Cl反应的化学方程式
。
12.短周期元素A、B、C、D中,0.5mol A元素的离子得到6.02×1023个电子被还原为中性原子,0.4g A的氧化物恰好与100ml 0.2mol/L的盐酸完全反应,A原子核内质子数目与中子数目相等,B元素原子核外M层电子数目比K层多1个,C―比A元素的离子多1个电子层,D元素的原子核外L层比K层多2个电子。
(1)A、B、C、D四种元素的名称分别是 、 、 、 。
(2)画出C―和D原子的结构示意图
(3)向B、C两种元素形成的化合物的水溶液里逐滴滴入苛性钠溶液,现象为______________________,写出有关离子方程式_________________________________;_________________________________。
13.据2004年1月17日网易报道,意大利科学家使用普通氧分子和带正电的氧化离子作用,制出了新型的氧分子O4,它的结构很复杂,可能具有与S4相似的长方形结构,是一种高能量分子。
(1)下列有关O4的说法正确的是: ▲
A.O4分子内存在极性共价键
B.合成O4的反应可看作核聚变反应,即不属于化学变化
C.O4与O3、O2都是氧的同素异形体
D.O4将来可用作更强有力的火箭推进的氧化剂
(2)制备含O2-、O22-甚至O2+的化合物都是可能的,通常它们是在氧分子进行下列各种反应时生成的:
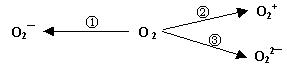
上述反应中, (填序号)相当于氧分子的氧化; (填序号)相当于氧分子的还原。
(3)写出O22—的电子式:
(4)O2[PtF6]是一种含有O2+的化合物,请写出一种含有O2-的氧化物的化学式:__________________。
14.常温下, A是只含X和Y两种短周期元素的气体,X的原子序数小于Y,甲、乙分别是X、Y元素的单质,丙也是某元素的单质。甲、乙、丙和B、C、D都是常见的物质,他们之间有如下的转化关系,请回答下列问题:
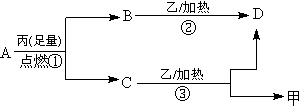
试回答下列问题:
⑴若气体A是纯净物,且X和Y的质量比为1:3,则A的化学式是 (写化学式),它的分子构型是 ,键角是 。
⑵若气体A中X和Y的质量比大于1:3,则气体A中肯定有 (写化学式)。
⑶若气体A的分子为线形结构,且Y和X的质量比在数值上等于Y的相对原子量,则A的化学式为
⑷写出化学式:B C
D 甲
⑸仅由X与丙所含元素可以形成两种化合物,它们的电子式分别为 和 。
⑹写出反应①②③中属于置换反应的化学方程式: 。
15、(1998年)(7分)BGO是我国研制的一种闪烁晶体材料,曾用于诺贝尔奖获得者丁肇中的著名实验,它是锗酸铋的简称。若知:①在GBO中,锗处于其最高价态 ②在GBO中,铋的价态与铋跟氯形成某种共价氯化物时所呈的价态相同,在此氯化物中铋具有最外层8电子稳定结构 ③GBO可看作是由锗和铋两种元素的氧化物所形成的复杂氧化物,且在GBO晶体的化学式中,这两种氧化物所含氧的总质量相同。请填空:
(1)锗和铋的元素符号分别是 和 。
(2)GBO晶体的化学式是 。
(3)GBO晶体中所含铋氧化物的化学式是 。
16.(1996上海改编).A、B、C、D是短周期元素,A元素的最高价氧化物的水化物与它的气态氢化物反应得到离子化合物,1摩该化合物含有42摩电子,B原子的最外层电子数为次外层的3倍。C、D两原子的最外层电子数分别是内层电子数的一半.C元素是植物生长的营养元素之一.
试写出:
(1)A、B元素形成的酸酐的化学式 ;
(2)D元素的单质与水反应的化学方程式 ;
(3)A、C元素气态氢化物的稳定性大小 < (用分子式表示).
17.A、B、C三种物质,每个分子中都含有14个电子,其中A的分子属于非极性分子,但只有非极性键;B的分子也是非极性分子,但既有非极性键又有极性键,C的分子属于极性分子.则A的电子式__________B的电子式___________C的化学式是___________.:
18.短周期元素A、B、C、D中,0.5mol A元素的离子得到6.02×1023个电子被还原为中性原子,0.4g A的氧化物恰好与100ml 0.2mol/L的盐酸完全反应,A原子核内质子数目与中子数目相等,B元素原子核外M层电子数目比K层多1个,C―比A元素的离子多1个电子层,D元素的原子核外L层比K层多2个电子。
(1)A、B、C、D四种元素的名称分别是 、 、 、 。
(2)画出C―和D原子的结构示意图
(3)向B、C两种元素形成的化合物的水溶液里逐滴滴入苛性钠溶液,现象为______________________,写出有关离子方程式_________________________________;_________________________________。
元素推断题答案
1、 Na2O K2S MgF2和CaCl2
2、X-n或X-m X+m或X+n
3、⑴ O、N、S、H
⑵ 少量铵根离子与水电离的OH-结合,生成了难电离的物质,促进了水的电离,最终H+浓度大于OH-浓度
⑶ OH-大于NH3, OH- + NH4+ = NH3 + H2O
4.(1)甲:HCl 乙:H2O ⑵H-O-Cl
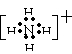 12e—
12e—
⑶4NH3+6NO=5N2+6H2O
5.⑴
⑵H2 ⑶Fe2O3若CuO ⑷C+H2O![]() CO+H2
CO+H2
6.A 7.B 8.D
9.⑴CaF2 CS2 (2)MgS (3)NaOH 或 LiHS
(4)H2b-mXOb (5)KCl 或CaCl2
10.⑴![]() 第二周期、第ⅦA族 ⑵
Na
第二周期、第ⅦA族 ⑵
Na
⑶ 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ ⑷
Na3AlF6
![]() 11.(1)略 (2)2NH3 NH4++NH2-
(3)NaNH2 + NH4Cl
= NaCl + 2NH3
11.(1)略 (2)2NH3 NH4++NH2-
(3)NaNH2 + NH4Cl
= NaCl + 2NH3
12. (1)镁、铝、氯、碳;
(2) 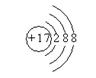 、
、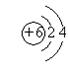 ;
;
(3)Al3++3OH-===Al(OH)3↓;Al(OH)3+OH-==AlO2-+2H2O。
13.(1)C、D (2)②;①③ (3)![]() ; (4)KO2(其它合理的化学式也同样给分)。
; (4)KO2(其它合理的化学式也同样给分)。
14. ⑴ A的化学式是 :CH4,分子构型是:正四面体,键角是:109°28′。
⑵
H2。 ⑶ C2H2
⑷
B、CO2 ;C、H2O;D、CO;甲:H2
⑸ ![]()
⑹![]()
15、(7分)(1)Ge,Bi (每空1分,共2分) (2)Bi4Ge3O12[或2Bi2O3·3GeO2、Bi4(GeO4)3] (3分) (3)Bi2O3 (2分)
16.(1)N2O3或N2O5(2)2Li+2H2O=2LiOH+H2↑(3)PH3<NH3
18. (1)镁、铝、氯、碳;
(2)  、
、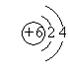 ;
;
(3)Al3++3OH-===Al(OH)3↓;Al(OH)3+OH-==AlO2-+2H2O。