高三化学自主复习测试题一:基本概念
本试卷分为第Ⅰ卷和第Ⅱ卷两部分.满分120分.考试时间90分钟.
相对原子质量:H—1 C—12 N—14 O—16 S—32 I—127 Ca—40 K—39
Al—27 Fe—56 Zn—65 Ag—108
第Ⅰ卷(72分)
一、选择题(本题包括9小题,每小题4分,共36分。每小题只有一个选项符合题意)
1.我国的“神舟五号”载人飞船已发射成功,“嫦娥”探月工程也已正式启动。据科学家预测,月球的土壤中吸附着数百万吨的![]() ,每百吨
,每百吨![]() 核聚变所释放出的能量相当于目前人类一年消耗的能量。在地球上,氦元素主要以
核聚变所释放出的能量相当于目前人类一年消耗的能量。在地球上,氦元素主要以![]() 的形式存在。下列说法正确的是
的形式存在。下列说法正确的是
A.![]() 原子核内含有4个质子 B.
原子核内含有4个质子 B.![]() 和
和![]() 互为同位素
互为同位素
C.![]() 原子核内含有3个中子 D.
原子核内含有3个中子 D.![]() 的最外层电子数为2,所以
的最外层电子数为2,所以![]() 具有较强的金属性
具有较强的金属性
2.下列各项中表达正确的是
A.F—的结构示意图:![]() B.CO2的分子模型示意图:
B.CO2的分子模型示意图:![]()
C.NaCl的电子式:![]() D.N2的结构式: :N≡N:
D.N2的结构式: :N≡N:
3.任何酸溶液都具有的性质是
A.能与纯碱反应并生成CO2 B.能与锌反应并生成H2
C.能使甲基橙试液变红 D.能与烧碱起中和反应
4.下列说法:①元素的相对原子质量是该元素一个原子的质量与12C原子质量的1/12的比值;②分子是保持物质性质的一种微粒;③原子是构成物质的最小微粒;④任何元素的原子都由质子、中子、电子构成;⑤具有相同质量的原子,其化学性质基本相同;⑥具有相同质子数的微粒属于同一种元素;⑦同种元素组成的物质是单质。其中正确的说法是
A.全都正确 B.全都错误
C.只有①、⑤、⑦正确 D.除⑦外都正确
5.下列物质中,肯定是纯净物的是
A.只由一种元素组成的物质 B.只由一种原子组成的物质
C.只由一种分子组成的物质
D.只由一种元素的阳离子跟另一种元素的阴离子组成的物质
6.因发生氧化还原反应,不能在溶液中大量共存的一组离子是:
A.Ag+、Na+、Br-、NO![]() B.Ca2+、H+、Cl-、CO
B.Ca2+、H+、Cl-、CO![]()
C.K+、H+、SO![]() 、OH- D.Na+、S2-、SO
、OH- D.Na+、S2-、SO![]() 、H+
、H+
7.下列各组变化中,前者是物理变化,后者是化学变化的是
A.风化、裂化 B.分馏、干馏 C.渗析、盐析 D.水解、电解
8.下列说法正确的是(NA表示阿伏加德罗常数的数值)
A.28 g氮气含有的原子数目为NA
B.4 g金属钙变成钙离子时失去的电子数目为0.1NA
C.1 mol甲烷的质量与NA个甲烷分子的质量之和相等
D.在标准状况下,11.2 L甲烷和乙炔混合物所含分子数为NA
9.密度为0.91/cm3的氨水,质量分数为25%,该氨水用等体积的水稀释后,所得溶液的质量分数是
A. 等于12.5% B.大于12.5% C.小于12.5% D.无法确定
二、选择题(本题包括9小题,每小题4分,共36分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分。)
10.某单质X能从某盐溶液中置换出单质Y,由此推断下列各有关说法中,正确的是
A.X一定是排在金属活动性顺序中氢以前的金属
B.X是金属时,Y可能是金属,也可能是非金属
C.X是金属时,Y也是金属;X是非金属时,Y也是非金属
D.X、Y都是金属时,X一定比Y活泼
11. 分别取等质量的80℃的甲、乙两种化合物的饱和溶液,降温至20℃后,所析出的甲的质量比乙的大(甲与乙均无结晶水)。下列关于甲、乙溶解度的叙述中肯定正确的是
A.温度对甲的溶解度影响较大 B.温度对乙的溶解度影响较大
C.20℃时,乙的溶解度比甲大 D.80℃时,甲的溶解度比乙大
12.下列反应的离子方程式正确的是
A.NaHS水解:HS-+H2O![]() H3O++S2-
H3O++S2-
B.钠与CuSO4溶液反应:2Na+Cu2+==Cu+2Na+
C.向CaCl2溶液中通入少量CO2气体:Ca2++CO2+H2O==CaCO3↓+2H+
D.澄清石灰水跟盐酸反应:H++OH-==H2O
13.某元素 A 形成的 A2 分子共有三种,其相对分子质量(分子量)依次为158、160、162。 此三种分子的物质的量之比为7:10:7,则下列说法正确的是
A.A元素有三种同位素
B.三种分子的平均相对分子质量为159
C.A的一种同位素质量数为80
D.A的各种同位素的原子个数百分比相同
14.依照阿伏加德罗定律,下列叙述中正确的是
A.同温同压下两种气体的体积之比等于摩尔质量之比
B.同温同压下两种气体的物质的量之比等于密度之比
C.同温同压下两种气体的摩尔质量之比等于密度之比
D.同温同体积下两种气体的物质的量之比等于压强之比
15.将m1 g锌加到m2 g 20% HCl 溶液中去,反应结果共放出n L H2(标准状况),则被还原的HCl的物质的量是
A. ![]() mol B.
mol B.![]() mol C.
mol C.![]() mol D.
mol D.![]() mol
mol
16.下列几种方法制备O2:①KClO3 和MnO2共热;②Na2O2加水;③H2O2中加MnO2;④KMnO4受热分解。若要制相同质量的O2,则上述反应中相关物质转移的电子数之比为
A.3:2:2:4 B.1:1:1:1 C.2:1:1:2 D.1:2:1:2
17.某实验室用下列溶质配制一种混合溶液,已知溶液中 c(K+)=c(Cl-)=1/2c(Na+)=c(![]() )
)
则其溶质可能是
A.NaCl,K2SO4 B.KCl,Na2SO4,NaCl
C.NaCl,Na2SO4,K2SO4 D.KCl,K2SO4,Na2SO4
18.还原2.4×10-3mol XO(OH)3+到X元素的低价态时,消耗0.2mol/L的Na2SO3溶液30mL,则X元素的低价态是( )
A.+1 B.-1 C.0 D.-2
第Ⅱ卷(48分)
三、(共2小题)
19.某同学配置好两瓶Na2SO4溶液,一瓶为饱和溶液,另一瓶为 0.1 mol·L-1的非饱和溶液,还没来得及贴上标签就搞混了。区别这两种溶液最简单的方法是什么?
答: 。
20. 实验室有一包 KCl和 AlCl3的固体混合物,通过以下实验可确定 KCl和 AlCl3的质量之比,试根据实验方法和主要步骤,回答有关问题:
(1)调整托盘天平的零点时,若指针偏向右边,应将右边的螺丝向 旋动。
(2)某学生用已知质量为 y g的表面皿准确称取 W g样品,他在托盘天平的右盘上放上(W+y)g的砝码,在左盘的表面皿中放入样品,此时指针稍偏右边,该学生应怎样操作 ;
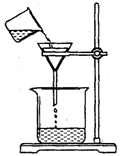 (3)将样品置于烧杯中加适量水溶解,滴入过量的A溶液,烧坏中有沉淀物,则A溶液的名称是
;
(3)将样品置于烧杯中加适量水溶解,滴入过量的A溶液,烧坏中有沉淀物,则A溶液的名称是
;
(4)过滤,某学生欲用右图装置操作,错误之处应怎样纠正?
答: ;
(5)甲学生用水多次洗涤过滤所得沉淀物,然后使其干燥,得到固体纯净物C,质量为W2g,C的名称是 ;
6)乙学生将过滤所得滤液跟甲学生洗涤沉淀所得液体混合,然后蒸干溶剂,再充分加热,最后得到纯净KCl固体W1g,则原混合物中KCl与AlCl3的质量之比的计算式为 。
四、(共2小题)
21.(1) 如果Fe3O4可写作FeO·Fe2O3或FeFe2O4,与此类似,Pb3O4则可写作___________或______________。
(2) 写出由化合反应一步制取FeCl2的化学反应方程式:
________________________________________________
(3)高锰酸钾和氢溴酸溶液可以发生下列反应:
KMnO4+ HBr→ Br2+ MnBr2+ KBr+ H2O
①配平上面化学方程式,
②其中还原剂是 ,若消耗0.1 mol氧化剂,则被氧化的还原剂的物质的量是 。
(4)①向NaHSO4溶液中,逐滴加入Ba(OH)2溶液到中性,请写出发生反应的离子方程式:_____________________________________。
②在以上中性溶液中,继续滴加 Ba(OH)2溶液, 请写出此反应的离子方程式:_________________________。
24.甲、乙、丙、丁分别是盐酸、碳酸钠、氯化钙、硝酸银4种溶液中的一种。将它们两两混合后,观察到的现象是:①甲与乙或丙混合都产生沉淀;②丙与乙或丁混合也产生沉淀;③丁与乙混合产生无色气体。回答下面问题:
(1)这四种溶液分别是甲:_________、乙:_________、丙:_________、丁:_________。
(2)写出丁与乙反应的离子方程式:________________________________________。
五、(共2小题)
23.向碘化钾溶液中加入AgNO3溶液,直到完全反应为止,结果反应后溶液的质量恰好等于原碘化钾溶液的质量,求该硝酸银溶液的质量分数。
24.将30克铁粉(过量)与44mL浓硫酸在加热条件下充分反应,共收集到11.2L(标准状况)气体,其质量为19.6克.试计算:
(1)浓硫酸的物质的量浓度.
(2)反应后剩余铁粉的质量.
高三化学自主复习测试题一:基本概念
非选择题答题卡
班级 学号 姓名 分数
三、(共2小题,14分)
19.答:
。(3分)
20.(1) ;(1分)
(2)
;(3分)
(3) ;(1分)
(4)
;(3分)
(5) ;(1分)
(6) 。(2分)
四、(共2小题,18分)
21.(1) 或 ;(2分)
(2) ;(2分)
(3)① KMnO4+ HBr→ Br2+ MnBr2+ KBr+ H2O;(2分)
② , 。(2分)
(4)① ,(2分)
② 。(2分)
22.(1)这四种溶液分别是甲:_________、乙:_________、
丙:_________、丁:_________。(4分)
(2)写出丁与乙反应的离子方程式:(2分)
。
五、(共2小题,16分)
23.向碘化钾溶液中加入AgNO3溶液,直到完全反应为止,结果反应后溶液的质量恰好等于原碘化钾溶液的质量,求该硝酸银溶液的质量分数。(6分)
24.将30克铁粉(过量)与44mL浓硫酸在加热条件下充分反应,共收集到11.2L(标准状况)气体,其质量为19.6克.试计算:
(1)浓硫酸的物质的量浓度,
(2)反应后剩余铁粉的质量。(10分)
高三化学自主复习测试题一:基本概念
参考答案
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | B | A | D | B | C | D | B | C | C |
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | BD | A | D | D | CD | B | C | C | A |
三、(共2小题,14分)
19.答:各取一定量的溶液于两支试管中,分别往试管加入少量的硫酸钠粉末,硫酸钠粉末溶解(或消失)的是0.1 mol·L-1的非饱和溶液,硫酸钠粉末不溶解的是饱和溶液。(其它合理表达也给分)
20.(1)左;(2)往左盘表面皿上慢慢加少量样品,使指针指向标尺中间;(3)氨水;(4)漏斗下端管口应紧靠烧杯内壁,倾倒液体时应用玻璃棒引流;(5)氢氧化铝;
(6)W1:(W-W1)或W1:(133.5W2/78)
四、(共2小题,18分)
21.(1)2PbO·PbO2,Pb2PbO4;(2)2FeCl3+Fe=3FeCl2
(3) ① 2 KMnO4+ 16 HBr= 5 Br2+ 2 MnBr2+ 2 KBr+ 8 H2O ②HBr; 0.5mol.
(4)①2H++SO42-+Ba2++2OH -=BaSO4↓+2H2O ②Ba2++SO42-=BaSO4↓
22.(1)氯化钙、碳酸钠、硝酸银、盐酸(或写化学式)
(2)2H++CO32- === H2O+CO2↑
五、(共2小题,16分)
23.解:依题意可知,加入的AgNO3溶液的质量等于反应生成沉淀AgI的质量,(2分)
依反应:AgNO3+KI= AgI↓+KNO3可知n(AgNO3)=n(AgI),设有1mol的AgI生成,(2分)可得:
w(AgNO3)=M(AgNO3)/M(AgI)×100%=170/235=72.3% (2分)
24.解:设生成的![]() 的物质的量为x,
的物质的量为x,![]() 的物质的量为y.(1分)
的物质的量为y.(1分)
依反应![]() (1分)
(1分)
和![]() (1分)
(1分)
可得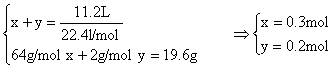 (3分)
(3分)
∴(1)c(![]() )=(2×0.3+0.2)mol/0.044L=18.2mol/L(1分)
)=(2×0.3+0.2)mol/0.044L=18.2mol/L(1分)
(2)剩余m(Fe)=30g-(0.3+0.2)mol×56g/mol=2g(1分)
答:(略)