高三化学综合测试卷
第I卷I(选择题 共72分)
一、选择题(每小题只有一个选项符合题意)
1.为探索月球上是否有生命存在的迹象,首先分析月球岩石是否含碳氢化合物.科学家用氘盐酸(即DCl的![]() 溶液)处理岩石样品,收集放出的气体分析,结果发现了一些碳氘化合物,据此推断所得碳氘化合物是由氘盐酸与岩石中的那种物质反应的产物( )
溶液)处理岩石样品,收集放出的气体分析,结果发现了一些碳氘化合物,据此推断所得碳氘化合物是由氘盐酸与岩石中的那种物质反应的产物( )
A.岩石中的碳酸盐 B.岩石中的碳酸氢盐
C.岩石中的碳化物 D.岩石中的碳氢化合物
2.下列表达方式错误的是( )
A.甲基的电子式![]() B.氟化钠的电子式
B.氟化钠的电子式![]()
C.硫离子的结构示意图![]() D.碳-12原子
D.碳-12原子![]()
3.生活中的某些问题,常常涉及到化学知识,下列分析正确的是( )
A.氯气和二氧化硫均可作为漂白剂,若同时使用它们去漂白某一润湿的有色物质,漂白效果会明显加强
B.为了消除碘缺乏病,卫生部规定食盐必须加碘,其中碘以单质的形式存在
C.苯酚有杀菌和止痛作用,药皂中也掺有少量苯酚,所以我们可以用苯酚对环境消毒或直接涂抹于皮肤上进行消毒
D.工业酒精不能加水当饮料品尝,其原因是它含有甲醇,它虽具有酒香味,但饮后会导致中毒,甚至死亡
4.试管装有足量的煤油和水的混合物,静置后投入一小块碱金属.可观察到金属在煤油和水的界面附近上下往复运动,下列说法不正确的是( )
A.此碱金属可能是钾或钠 B.若是金属锂则不能观察到上述现象
C.碱金属上下运动是由于与水反应产生了氢气 D.反应一段时间煤油会燃烧
5.下列各项中的“黄色”,不属于因化学反应而产生的现象的是( )
A.无色试剂瓶中的浓硝酸呈黄色
B.在硫化钠溶液中加入双氧水后有黄色沉淀生成
C.食盐在无色的火焰上灼烧时,火焰呈黄色
D.久置的碘化钾溶液呈黄色
6.由短周期两种元素形成化合物![]() ,
,![]() 比
比![]() 少一个电子层,且
少一个电子层,且![]() 具有与Ne原子相同的核外电子层结构,下列说法正确的是( )
具有与Ne原子相同的核外电子层结构,下列说法正确的是( )
A.![]() 是三氧化二铝
B.
是三氧化二铝
B.![]() 和
和![]() 最外层上的电子数相同
最外层上的电子数相同
C.A是第2周期第ⅢA族的元素 D.B是第3周期第ⅣA族的元素
7.某溶液含有较多的![]() 和少量的
和少量的![]() ,若用该溶液制取芒硝,可供选择的操作有:①加适量
,若用该溶液制取芒硝,可供选择的操作有:①加适量![]() 溶液,②加金属Na,③结晶,④加过量NaOH溶液,⑤加强热脱结晶水,⑥过滤。正确的操作步骤是( )
溶液,②加金属Na,③结晶,④加过量NaOH溶液,⑤加强热脱结晶水,⑥过滤。正确的操作步骤是( )
A.④⑥①③ B.②⑥③ C.④⑥③② D.②⑥①③⑤
8.为检验某病人血液中的含钙量,现取10mL血液样品稀释后用草酸铵[![]() ]处理成草酸钙沉淀,将此沉淀溶于过量的稀
]处理成草酸钙沉淀,将此沉淀溶于过量的稀![]() 中,然后用
中,然后用![]() 溶液(生成
溶液(生成![]() 、
、![]() 、
、![]() )恰好消耗1.6mL,则该病人血液中含钙量为 ( )
)恰好消耗1.6mL,则该病人血液中含钙量为 ( )
A.2.4 g/L B.8 g/L C.6 g/L D.12 g/L
二、选择题(每小题有一个或两个选项符合题意)
9.对某酸性溶液(可能含有![]() ,
,![]() ,
,![]() ,
,![]() )分别进行如下实验:
)分别进行如下实验:
①加热时放出的气体可以使品红溶液褪色;
②加碱调至碱性后,加热时放出的气体可以使润湿的红色石蕊试纸变蓝;
③加入氯水时,溶液略显黄色,再加入![]() 溶液,产生的白色沉淀不溶于稀硝酸.
溶液,产生的白色沉淀不溶于稀硝酸.
对于下列物质不能确认其在原溶液中是否存在的是( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
10.在100mL混合溶液中,![]() 和
和![]() 物质的量浓度分别为
物质的量浓度分别为![]() 和
和![]() ,向该溶液中加入1.92g铜粉,加热,待充分反应后,所得溶液中
,向该溶液中加入1.92g铜粉,加热,待充分反应后,所得溶液中![]() 物质的量浓度(
物质的量浓度(![]() )为( )
)为( )
A.0.15 B.0.20 C.0.225 D.0.45
11.设![]() 为阿伏加德罗常数,下列说法不正确的是 ( )
为阿伏加德罗常数,下列说法不正确的是 ( )
A.标准状况下的22.4L辛烷完全燃烧,生成的二氧化碳的分子数为8![]()
B.1mol乙基中含有的电子数为18![]()
C.46g二氧化氮和46g四氧化二氮含有的原子数均为3![]()
D.在![]() 的硝酸镁溶液中含有的硝酸根离子数为4
的硝酸镁溶液中含有的硝酸根离子数为4![]()
12.下列各组离子一定能在指定环境中大量共存的是 ( )
A.在由水电离出的C(H+)=1×10—12mol/L的溶液中:Fe3+、ClO—、Na+、SO42—
B.在pH=1的溶液中:NO3—、SO42—、Na+、Fe2+
C、能溶解铝片并放出氢气的溶液中:Na+、Mg2+、Cl—、NO3—
D.在pH=13的溶液中:SO32—、S2—、Na+、K+
13.能正确表示下列化学反应的离子方程式是( )
A.用碳酸钠溶液吸收少量二氧化硫:![]()
![]()
![]()
B.硫酸亚铁溶液中加入过氧化氢溶液:![]()
![]()
![]()
C.次氯酸钙溶液中通入过量的SO2气体:![]()
![]()
![]()
D.碳酸镁溶于硝酸中:![]()
![]()
![]()
14.a mol铜跟含b mol![]() 的硝酸溶液恰好完全反应,则被还原的
的硝酸溶液恰好完全反应,则被还原的![]() 的物质的量一定是( )
的物质的量一定是( )
A.(b-2a)mol B.b/4mol C.2a/3mol D.2amol
15.脑白金的主要成分的结构简式为: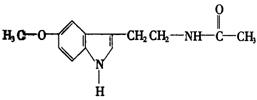 下列对脑白金主要成分的推论错误的是( )
下列对脑白金主要成分的推论错误的是( )
A.其分子式为![]() B.能水解生成氨基酸
B.能水解生成氨基酸
C.能与溴水发生加成反应 D.其营养成分及官能团与葡萄糖相同
16.用惰性电极实现电解,下列说法正确的是( )
A.电解稀硫酸溶液,实质上是电解水,故溶液pH不变
B.电解稀氢氧化钠溶液,要消耗![]() ,但溶液pH却增大
,但溶液pH却增大
C.电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为1∶1
D.电解硫酸钠溶液,在阴极上和阳极上析出产物的物质的量之比为1∶2
17.已知某溶液中存在![]() 、
、![]() 、
、![]() 和
和![]() 四种离子,其浓度大小有如下关系,其中可能的是( )
四种离子,其浓度大小有如下关系,其中可能的是( )
①![]() ②
②![]()
③![]() 且
且![]() ④
④![]()
⑤![]()
A.①④ B.③⑤ C.①②③ D.④⑤
18.反应![]()
![]() 2AB在不同温度和压强改变条件下,产物AB的生成情况,如图1所示:a为500℃,b为300℃时情况,c为300℃时从时间
2AB在不同温度和压强改变条件下,产物AB的生成情况,如图1所示:a为500℃,b为300℃时情况,c为300℃时从时间![]() 开始向容器中加压的情况,则下列叙述正确的是( )
开始向容器中加压的情况,则下列叙述正确的是( )
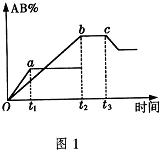
A.![]() 、
、![]() 、AB均为气体,正反应放热
、AB均为气体,正反应放热
B.AB为固体,![]() 、
、![]() 中最少有一种为非气体,正反应吸热
中最少有一种为非气体,正反应吸热
C.AB为气体,![]() 、
、![]() 中最少有一种为非气体,正反应吸热
中最少有一种为非气体,正反应吸热
D.AB为气体,![]() 、
、![]() 中最少有一种为非气体,正反应放热
中最少有一种为非气体,正反应放热
第II卷(非选择题 共78分)
三、(本题包括2小题,共18分)
19.(6分)下列有关实验的叙述,正确的是(填序号)________。
A.浓硫酸不小心沾到皮肤上,立即用稀NaOH溶液洗涤
B.用渗析法分离淀粉中混有的NaCl杂质
C.用分液漏斗将甘油和水的混合液体分离
D.用碱式滴定管量取20.00mL高锰酸钾溶液
E.为了测定某溶液的pH,将未经湿润的pH试纸浸入到待测溶液,过一会取出,与标准比色卡进行对比
F.用浓氨水洗涤做过银镜反应的试管
G.配制银氨溶液时,将稀氨水慢慢滴加到硝酸银溶液中,产生沉淀后继续滴加到沉淀刚好溶解为止
20.(12分)实验室可通过多条途径得到氮气,常见的三种方法是:
方法一,将氨气通入灼热的氧化铜粉末,得到纯净的氮气和铜.
方法二,将空气通过灼热的铜,得到较纯净的氮气和氧化铜粉末.
方法三,将亚硝酸钠(![]() )和氯化铵的混合溶液加热,逸出氮气.
)和氯化铵的混合溶液加热,逸出氮气.
下列是进行实验时可选择的实验仪器(其它必要的仪器如:铁架台、铁夹、铁圈、石棉网、酒精灯等未列出):
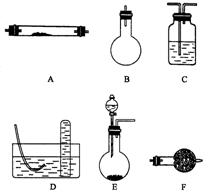
请回答下列问题:
(1)方法一制氮气:氨气是用浓氨水跟生石灰反应得到,此反应最好选用(填仪器的编号)________作发生装置,该反应的化学方程式_________________________________
_____________________。要制取并收集纯净的氮气(可含有少量的水),还使用上述仪器中的(填仪器的编号,并按气流方向从左向右列出)_____________________。
(2)在制取氮气的三种方法中,方法一和方法二越来越受到人们的关注,经常被联合使用。这两种方法与方法三相比,其优越性在于___________________________________
______________________________________________________。
四、(本题包括2小题,共19分)
21.(10分)下列转化关系,A~L均是中学化学中常见的物质.其中D为金属单质,构成D的元素在元素周期表中位于第四周期、Ⅷ族;B在常温常压下为无色液体;G为不溶于水但可溶于酸的白色固体,其水溶液能使酚酞试液变红;I为无色气体且能使湿润的红色石蕊试纸变蓝;L为无色气体,遇空气变为红棕色.
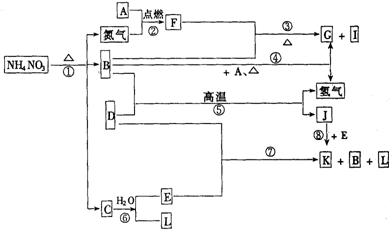
请回答:
(1)构成单质A的元素在周期表中处于________周期,________族。
(2)I物质的电子式为_______________,F物质的化学式为____________________;它们的晶体类型分别为_________________________________,_______________________________________。
(3)写出下列反应的化学方程式(是离子反应的,写离子方程式)
③____________________________________________________________;
⑤____________________________________________________________。
22.(9分)A,B,C,D是四种短周期元素,它们的原子序数依次增大,其中A,C及B,D分别是同一主族元素,B,D元素的原子核中质子数之和是A,C两元素原子核中质子数之和的两倍,又知四种元素的单质中有两种气体、两种固体.
(1)写出四种元素的名称:
A_________;B_________;C_________;D_________。
(2)写出两种均含A,B,C,D四种元素的化合物相互间发生反应,且生成气体的离子方程式___________________________________________________。
(3)写出C和D两元素形成化合物的电子式:_________________________。
(4)用A元素的单质与B元素的单质可以制成电池,电池中装有KOH浓溶液,用多孔的金属惰性电极浸入KOH溶液,两极均有特制的防止透过的隔膜,在一极通入A的单质,另一极通入B的单质,写出该电池发生的电极反应式:A极________________________;B极________________________。
五、(本题包括2小题,共19分)
23.(7分)充分燃烧含有碳、氢、氧的一类有机物,消耗氧气的体积与生成二氧化碳的体积之比为9∶8(相同条件下)
(1)该类有机物最简通式是下列各式的________(填代号)。
A.![]() B.
B.![]() C.
C.![]()
D.![]() E.
E.![]() F.
F.![]()
(2)符合该通式的某有机物的相对分子质量为136,则其化学式为:________;若该有机物属于酯类且分子中含有苯环.则其可能的同分异构体有________种,写出其中不能发生银镜反应的同分异构体的结构简式 __。
24.(12分)已知(1)![]() (R和
(R和![]() 代表烃基)
代表烃基)
(2)苯的同系物能被高锰酸钾氧化,如:
化合物C是制取消炎灵(盐酸祛炎痛)的中间产物,其合成路线为:
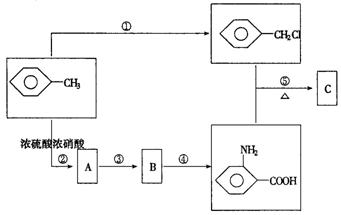
请回答下列问题:
(1)写出反应④的主要产物中含有官能团(除苯环外)的结构简式____________________。
(2)B物质的结构简式是___________________。
(3)反应①②的化学方程式
①_______________________________________________;
②_______________________________________________。
(4)反应①~⑤中,属于取代反应的是(填反应序号)________。
六、(本题包括2小题,共22分)
25.(10分)将一定量由碳、氢、氧三种元素组成的有机化合物A的蒸气与3.2g氧气混 合点燃,再将生成的气体依次通过①盛有浓硫酸的洗气瓶②灼热的氧化铜③饱和石灰水(设 每个装置中的反应物均过量)。经测定①中增重3.60g ②中减重1.60g ③中增重8.80g。A 蒸汽的密度为3.393g/L(已换算成标准状况)。又测知A既能与碳酸钠溶液反应又能与金属钠反应,且均有气体生成,但分别得到的气体在相同条件下体积不同。
试求该有机物的分子式,并写出其可能的结构简式。
26.(12分)取0.45mol
NaOH、0.35mol Na2CO3和0.20mol NaHCO3溶解于水,该混合液中逐渐加入盐酸,反应明显分三个阶段进行。若加入的HCl为n mol,溶液中NaCl、Na2CO3、NaHCO3分别为xmol、ymol、zmol,试分别计算在n值增大的过程中,不同反应阶段的n值范围和所对应的x、y、z值。将其结果填入下表。(提示:Na2CO3+HCl![]() NaHCO3+NaCl,NaHCO3+HCl
NaHCO3+NaCl,NaHCO3+HCl![]() NaCl+H2O+CO2↑)
NaCl+H2O+CO2↑)
| 加入的HCl n(mol) | 溶液中的NaCl x(mol) | 溶液中的Na2CO3 y(mol) | 溶液中的NaHCO3 z(mol) |
参考答案:
选择题
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | ||
| C | A | D | D | C | B | A | B | ||
| 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| B | C | AB | D | AD | A | BD | BC | C | D |
19.B、G
20.(1)E ![]() E→F→A→C→D
E→F→A→C→D
(2)Cu和CuO可以循环使用,避免因使用有毒的物质![]() 而造成污染
而造成污染
21. 1)第三 ⅡA
(2) ![]()
![]() 分子晶体 离子晶体
分子晶体 离子晶体
(3)![]()
![]()
22.(1)氢 氧 钠 硫 (2)![]()
![]()
![]()
(3)![]() (4)
(4)![]()
![]()
![]()
![]()
![]()
![]()
![]()
23.(1)C (2)![]() 6
6 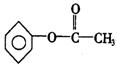
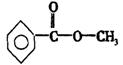
24.(1)—![]() —COOH(另外多答
—COOH(另外多答![]() 不扣分)
不扣分)
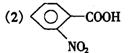
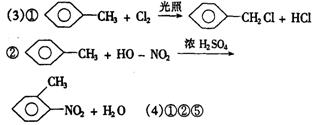
25.解:A的摩尔质量为3.393g/L×22.4L/mol=76g/mol
由浓硫酸增重可知一定量A中氢原子的物质的量:![]() ×2=0.4mol
×2=0.4mol
由氧化铜减重可求知一氧化碳的物质的量:![]() =0.1mol
=0.1mol
由石灰水增重可求知二氧化碳的物质的量:![]() -0.1mol=0.1mol
-0.1mol=0.1mol
一定量A中氧原子的物质的量为![]() =0.3mol
=0.3mol
所以A的实验式为C2H4O3,其式量为76
由A的摩尔质量为76g/mol确定其分子式为C2H4O3。
![]()
26.解: 当三种物质溶于水,立即发生如下的反应:
NaOH+NaHCO3![]() Na2CO3+H2O
Na2CO3+H2O
三种物质,物质的量将发生如下变化:
NaOH 0.45-0.20=0.25(mol)
NaHCO3 0.20-0.20=0
Na2CO3 0.35+0.20=0.55(mol)
当向溶液中逐步加入盐酸时,反应明显分三步进行:
(1)NaOH+HCl![]() NaCl+H2O
NaCl+H2O
(2)Na2CO3+HCl![]() NaCl+NaHCO3
NaCl+NaHCO3
(3)NaHCO3+HCl![]() NaCl+H2O+CO2↑
NaCl+H2O+CO2↑
由反应可知消耗HCl的量就是生成NaCl的量(Cl元素守恒)。溶液中NaOH、Na2CO3 、NaHCO3的量随HCl物质的量nmol改变而改变。
| 加入的HCl n(mol) | 溶液中的NaCl x(mol) | 溶液中的Na2CO3 y(mol) | 溶液中的NaHCO3 z(mol) |
| 0~0.25 | n | 0.55 | 0 |
| 0.25~0.80 | n | 0.80-n | n-0.25 |
| 0.80~1.35 | n | 0 | 1.35-n |