高三年级化学阶段检测题
一. 选择题(每小题有1—2个选项符合题意)
1.将1molN2和3molH2反应,达到平衡时,混和气体中含92%(体积百分含量)的NH3,则H2体积百分含量为
A 2% B 3% C 4% D 6%
2.在一个密闭容器中用等物质量的A和B发生如下的反应:A(g)+2B(g)![]() 2C(g) 反应达到平衡时若A和B的物质的量之和与C的物质的量相等,则此时A的转化率为
2C(g) 反应达到平衡时若A和B的物质的量之和与C的物质的量相等,则此时A的转化率为
A 50% B 60% C 40% D 70%
3.25℃时,在浓度均为1mol/L的(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2,三种溶液,若测得其中[NH4+]分别为a、b、c(单位:mol/L),则下列判断正确的是
A a=b=c B c>a>b C b>a>c D a>c>b
4.室温时,0.01 mol·L-1某一元弱酸的电离度为1%,则下列说法正确的是
A 上述弱酸溶液的pH=4
B 加入等体积0.01 mol·L-1 NaOH溶液后,所得溶液的pH=7
C 加入等体积0.01 mol·L-1 NaOH溶液后,所得溶液的pH>7
D 加入等体积0.01 mol·L-1 NaOH溶液后,所得溶液的pH<7
5.常温下的下列物质中,含离子数目最多的是
A 20mL冰醋酸 B 20mL0.2mol/L的CH3COOH溶液
C 20mL0.2mol/L的BaCl2溶液 D 20mL0.15mol/L的AlCl3溶液
6.在室温下等体积的酸和碱的溶液,混和后pH值一定等于7的是
A pH=3的硝酸跟pH=11的氢氧化钾溶液
B pH=3的盐酸跟pH=11的氨水
C pH=3的硫酸跟pH=11的氢氧化钠溶液
D pH=3的硫酸跟pH=11的氢氧化钡溶液
7.25℃时,在0.1mol/L NaX溶液中,水的电离度为a1;在0.1mol/L盐酸中,水的电离度为a2,若a1/a2=109,则NaX溶液的pH值为
A 5 B 7 C 10 D 11
8.为了除去FeSO4溶液中的Fe3+,可用加入纯铁屑的方法,但此法很费时;现有一种方法是在蒸馏水沸腾时加入粉未状的绿矾(少量多次),搅拌,直到观察到有褐色沉淀产生即可停止加入药品,煮沸1~2分钟,趁热过滤,密封保存所得的FeSO4溶液,此法的原理是
A Fe3+易水解,它的水解产物之一能抑制的Fe2+ 水解
B Fe2+ 有较强的还原性,它能还原Fe3+
C Fe3+有较强的氧化性,它能氧化Fe2+
D Fe3+的水解是吸热反应,升温能促进它的水解
9.将过氧化钠加入到氯化亚铁溶液中,可以观察到的现象是
A 生成白色沉淀 B 生成红褐色沉淀
C 有气泡产生 D 无现象
10.把一定量的铁和铜的混和粉未投入到FeCl3溶液中,充分反应后,下列情况不可能的是
A 铁和铜都有剩余 B 铁和铜都无剩余
C 只有铁剩余没有铜剩余 D 没有铁剩余只有铜剩余
11.把铁和铜的混和物放入稀硝酸中,反应后过滤,滤出的固体物质投入盐酸中无气体放出,则滤液中一定含有的是
A Fe(NO3)2 B Cu(NO3)2 C Fe(NO3)3 D HNO3
12.把铁、铜、氯化铁、氯化亚铁、氯化铜溶液放在一起反应后,铁有剩余,则溶液中所含有的最多的阳离子是
A Cu2+ B Fe3+ C Fe2+ D H+
13.向Fe2O3、CuO、Fe、Cu的混和粉未中加入过量的稀硫酸,充分反应后,仍有红色粉未存在,则关于溶液中阳离子的判断正确的是
A 只有Fe2+和Cu2+ B 一定有Fe2+、Cu2+,可能有Fe3+
C 一定有Fe2+,可能有Cu2+ D 只有Fe2+
14.向500mLFeCl3溶液中通入一定量的H2S气体,恰好完全反应,过滤,所得滤液的质量比原溶液的质量增加0.5g,则原FeCl3溶液的物质的量的浓度为
A 2mol/L B 1mol/L C 0.1mol/L D 0.2mol/L
15.在同样条件下,将铁和铝投入质量相等、且为足量的稀硫酸中,反应结束后,两溶液的质量仍然相等,则
A 所投入的铁、铝质量相等
B 所投入的铁的质量大于铝的质量
C 所投入的铝的质量大于铁的质量
D 铁、铝产生氢气的质量相等
16.有一块铝铁合金,将其溶于足量盐酸中,再加入过量的NaOH溶液,在空气中静置,当红褐色沉淀不再增加时,将沉淀过滤出并灼烧,得到的固体残留物恰好跟原来合金的质量相等,则此合金中铝的百分含量为
A 22.2% B 75.5% C 30.0% D 80.6%
17.在100mLCaCl2与盐酸的混和溶液中逐滴加入Na2CO3溶液时,生成沉淀的质量与加入Na2CO3溶液的体积之间的关系如图。
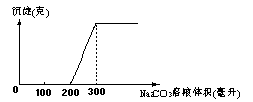
若CaCl2溶液的浓度为0.25mol/L,则原溶液的pH值为
A 0 B 1 C 1.7 D 2
18.将足量CO2通人KOH和Ca(OH)2的混合稀溶液中,生成沉淀的物质的量(n)和通入CO2体积(y)的关系正确的是
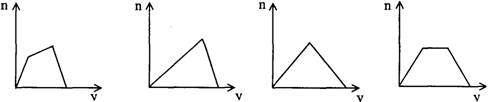
A B C D
19.今有四种固体投入水中分别产生E、F、G、M四种气体,这四种气体之间的反应如下:E+F→N;F+G→Q;Q+E→N+W;G+E→N+W;M+E→N+I,其中I是双原子分子中键 能最大的单质气体,则按产生气体E、F、G、M的顺序四种固体物质分别是
A Na2O2 Na CaC2 Mg3N2 B Na2O2 Li CaC2 (NH4)2S
C Na Na2O2 CaC2 (NH4)2S D Na Na2O2 CaC2 Mg3N2
二. 填空题:
20.在一定条件下可实现下图所示的各物质之间的变化:
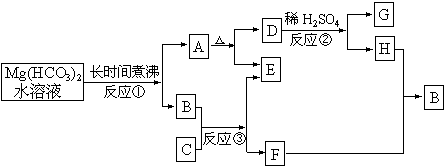
请填写下列空白:
(1)写出A、G的化学式:A 、G ;
(2)反应②中加入稀硫酸的作用是 ;
(3)写出反应③的化学方程式 ;
(4)反应①能生成A物质的原因是 。
21.已知X、Y均为短周期元素,X在空气中燃烧发出耀眼白光。气体G与氢气密度之比为8.5,B是一种化肥的重要组成部分,可由人体肝脏产生,也可由C分解而成。D是一种高分子化合物,能作为重金属盐中毒后的解毒剂。
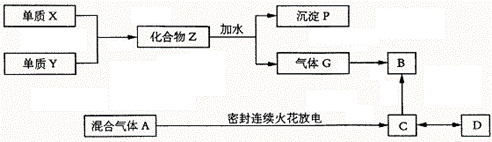
(1)写出X、Y、Z、P、G的化学式。
(2)写出B、C、D的名称。
(3)A中所含的主要气体成分是 ,这一实验最先由 设计完成。
(4)C分解成B是通过 作用。D是生物体内的 细胞器合成。
22.在MgCl2和AlCl3的混和溶液中,逐滴加入NaOH溶液直至过量,经测定,加入NaOH的物质的量和所得沉淀的物质的量的关系如下图所示,则:
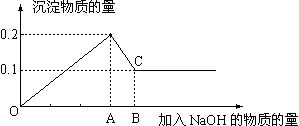
(1)图中C点表示当加入 molNaOH时,Al3+已经 ,Mg2+已经 。
(2)图中线段OA︰AB= 。
一定条件下,可逆反应A2+B2![]() 2C达到平衡后,c(A2)=0.5mol/L,c(B2)=0.1mol/L,c(C)=1.6mol/L。若A2、B2、C的起始浓度分别为amol/L、bmol/L、gmol/L。请确定:
2C达到平衡后,c(A2)=0.5mol/L,c(B2)=0.1mol/L,c(C)=1.6mol/L。若A2、B2、C的起始浓度分别为amol/L、bmol/L、gmol/L。请确定:
(1)a、b应满足的关系式__________________
(2)若反应从正反应方向开始进行,当g=__________是,a有最大值为_________
(3)若反应从逆反应方向开始进行,当b=__________是,a有最小值为_________
(4)综合⑵、⑶的结论,可知本题中a的取值范围为________________________。
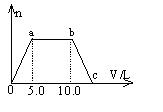 23. 向Ba(OH)2和NaOH的混合稀溶液中通入足量的CO2气体,生成的沉淀的物质的量(n)和通入CO2气体体积(V)的关系如右图,试回答:
23. 向Ba(OH)2和NaOH的混合稀溶液中通入足量的CO2气体,生成的沉淀的物质的量(n)和通入CO2气体体积(V)的关系如右图,试回答:
(1)a点之前的反应的离子方程式为:
________________________________________.
(2)a点到b点之间的反应离子方程式是:
________________________________________.
(3)c点的二氧化碳体积是 L
(4)混合稀溶液中Ba(OH)2和NaOH的物质的量之比为
24.现有废液,其中含有CuCl2、FeCl2、HCl。某课外活动小组计划用它得到纯净的FeCl2晶体。为此,设计如下实验方案:
| 序号 | A | B | C | D | E |
| 仪器及药品 |
|
|
|
|
|
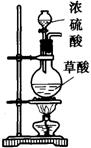
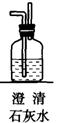
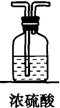
第一步:用上图中的仪器和药品组装一套实验装置制取干燥纯净的CO,用CO还原Fe2O3粉末制取还原铁粉。(制取CO的原理为:H2C2O4![]() CO2↑+CO↑+H2O)
CO2↑+CO↑+H2O)
(1)如果所制气体流向从左向右时,上述组装的实验装置从左向右直接连接顺序(填仪器序号)是 → → → → 。
(2)正确的操作步骤中第一步应是: ;最后一步应是熄灭 处的酒精灯。
(3)装置B的作用是 ;装置E的作用是 。
第二步:将制得的还原铁粉放入原混合溶液中,制得纯净的FeCl2溶液。
(4)必须进行的操作是 。
第三步:得到纯净的FeCl2晶体。
(5)必须进行的操作是 。
三. 计算题:
25.现将11.2g铁粉完全溶解在500mL稀硝酸中,硝酸的还原产物是NO,反应结束后,再加入6.4g铜粉,试求下列情况下硝酸物质的量的浓度:
(1)铜粉恰好完全溶解且无气体放出
(2)铜粉恰好完全溶解一半且无气体放出
26.在微热条件下,将11.2g铁粉恰好溶解在100mL10mol/L的浓硝酸中,若反应的气体产物为NO和NO2的混和物,且整个过程中不考虑硝酸的挥发、分解,也不考虑NO2的聚合,求气体产物中NO2与NO的物质的量之比。
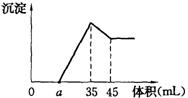 27.准确称取6g铝土矿样品(含Al2O3、Fe2O3、SiO2),放入100mL 浓度的H2SO4溶液中,充分反应后过滤,向滤液中加入10mol/L的NaOH溶液,产生沉淀与加入NaOH溶液的体积的关系如右图所示,求:
27.准确称取6g铝土矿样品(含Al2O3、Fe2O3、SiO2),放入100mL 浓度的H2SO4溶液中,充分反应后过滤,向滤液中加入10mol/L的NaOH溶液,产生沉淀与加入NaOH溶液的体积的关系如右图所示,求:
(1)H2SO4溶液的物质的量浓度;
(2)若a=2.3mL,计算各组分的质量;
(3)计算a值的取值范围。
28.将nmol木炭粉和1mol氧化亚铁在反应器中混和,隔绝空气加强热。
(1)可能发生反应有:
①FeO+C=Fe+CO↑ ②2FeO+C=2Fe+CO2↑
③FeO+CO=Fe+CO2↑ ④
(2)若n<1/4,充分反应后,反应器中的固体物质是 ,气体产物是 。
(3)若n>4,充分反应后,反应器中的固体物质是 ,气体产物是 。
(4)若反应的气体产物是混和物,n的取值范围是 。
(5)若反应的气体产物是混和物,且混和物中CO和CO2的物质的量相等,则n的值为 。
高三年级化学阶段检测题参考答案:
1 D 2C 3B 4A、C 5D 6 D 7 C 8 A、D 9B、C 10C 11A 12C 13C 14B 15C 16C 17B 18D 19A
20(1)Mg(OH)2 H2 (2)增加水的导电性,使水的电解得以顺利进行 2Mg+CO2=2MgO+C 加热时先生成碳酸镁,它再水解生成更难溶于水的氢氧化镁
21(1)X Mg Y N2 Z MgN2 P Mg(OH)2 G NH3 (2)B 尿素 C 氨基酸 D 蛋白质 (3)甲烷、氢气、氨气、水蒸气 米勒 (4)脱氨基 核糖体 (5)Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑ 1.5mol
22 0.6、全部转化成偏铝酸根离子、全部转化成氢氧化镁、5︰1
23 略
24(1)A→E→C→D→B (2)连接好并检查气密性,A (3)处理未反应完CO和新生成的CO2,除CO2 (4)搅拌、过滤 (5)在HCl气氛中加热浓缩,冷却结晶
25(1)[HNO3]=1.6摩/升 (2)[HNO3]=1.33摩/升
26 3︰1
27(1)1.75mol/L (2)Al2O3为5.1g;Fe2O3为0.72g;SiO2为0.18g (3)1.622<a<5(提示:由Fe2O3为“0”或SiO2为“0”分别可得到两个点)
28(1)C+CO2=2CO (2)FeO和Fe CO2 (3)C和Fe CO (4)1/2<n<1 (5)2/3